Диагноз бесплодия у семейной пары ставится при условии отсутствия зачатия в течение 1 года регулярной половой жизни без контрацепции [8].
МКБ-10 • N46 Мужское бесплодие.
Эпидемиология
Около 25% семейных пар не достигают беременности в течение 1 года, среди них 15% супружеских пар лечатся по поводу бесплодия, но все же менее 5% семейных пар так и остаются бесплодными. Примерно 40% случаев приходится на мужское бесплодие, 40% – на женское, еще 20% – на смешанное [8, 24, 29].
Профилактика
- Раннее выявление и лечение инфекционных заболеваний мочеполовой системы, в том числе заболеваний, передаваемых половым путем; коррекция сахарного диабета; своевременное оперативное лечение по поводу крипторхизма, варикоцеле, гидроцеле [7, 29].
- Планирование семьи, разъяснительно-образовательные беседы.
- Отказ от вредных привычек: курения, употребления алкоголя, наркотиков.
- Исключение профессиональных вредностей: ионизирующего излучения, контакта с анилиновыми красителями, пестицидами, тяжелыми металлами.
- Отказ от приема анаболических стероидов, частых тепловых процедур (баня).
Классификация
- Секреторное бесплодие, обусловленное врожденными и приобретенными заболеваниями.
- Экскреторное бесплодие, обусловленное нарушением транспорта сперматозоидов по семявыносящим путям.
- Иммунологическое бесплодие.
- Бесплодие, когда секреторная недостаточность половых желез сочетается с обструктивным, иммунологическим или воспалительным процессами.
- Относительное бесплодие [1].
- По отношению к основному органу репродуктивной системы, яичку, выделяют претестикулярные, тестикулярные и посттестикулярные причины [1, 7, 8, 24].
КЛАССИФИКАЦИЯ ВОЗ (1992) [1]
- 01 – психосексуальные расстройства;
- 02 – причин бесплодия не выявлено;
- 03 – изолированные патологические изменения семенной плазмы;
- 04 – ятрогенные причины;
- 05 – системные заболевания;
- 06 – врожденные аномалии;
- 07 – приобретенное повреждение яичек;
- 08 – варикоцеле;
- 09 – инфекция половых органов;
- 10 – иммунологический фактор;
- 11 – эндокринные причины;
- 12 – идиопатическая олигозооспермия;
- 13 – идиопатическая астенозооспермия;
- 14 – идиопатическая тератозооспермия;
- 15 – обструктивная азооспермия;
- 16 – идиопатическая азооспермия.
Диагностика
Диагностика мужского бесплодия включает сбор анамнеза, обследование обоих половых партнеров, физикальное и инструментальное обследования, исследование спермы, определение уровней гормонов, инфекционный скрининг, проведение иммунологических тестов и проб на совместимость партнеров. На основании полученных данных выбирают метод лечения: медикаментозное, хирургическое, эмпирическое лечение [1, 7, 20, 29, 30]. Обязательно исследование каждого пациента, состоящего в бесплодном браке, независимо от характера его репродуктивной функции в прошлом. Правильно собранный анамнез, проведенное урогенитальное обследование и выполненный анализ эякулята представляют достаточно полную информацию об основных причинах ммужского бесплодия.

ОСНОВНЫЕ ПРИЧИНЫ МУЖСКОГО БЕСПЛОДИЯ [1, 8, 24]
- Тестикулярные причины:
- крипторхизм;
- орхит (вирусный);
- перекрут яичка;
- цитостатическая, цитотоксическая терапия (химиотерапия);
- радиотерапия;
- генетические причины (синдром Клайнфелтера, Y-делеция).
- Эндокринные причины:
- гипергонадотропный гипогонадизм (первичный);
- гипогонадотропный гипогонадизм (вторичный);
- нормогонадотропный гипогонадизм;
- гиперпролактинемия;
- тестостерондефицитные состояния.
- Посттестикулярные причины:
- врожденная аплазия придатка или семявыносящего протока;
- мюллеровы простатические кисты;
- обструкция придатка яичка (врожденная, приобретенная);
- после операций на мошонке и в паху;
- антиспермальные антитела.
- Лекарственные препараты, экологические факторы, стресс, болезни.
- Варикоцеле.
- Сексуальные проблемы или расстройства эякуляции.
- Идиопатические причины.
МЕТОДЫ ДИАГНОСТИКИ МУЖСКОГО БЕСПЛОДИЯ
- Клинические методы:
- первичный опрос (сбор анамнеза);
- общее медицинское обследование;
- урогенитальное обследование;
- обследование терапевтом, генетиком, сексопатологом (по показаниям).
- Лабораторно-диагностические методы:
- спермограмма;
- цитология секрета простаты и семенных пузырьков;
- исследование на хламидиоз, уреаплазмоз, микоплазмоз, цитомегаловирус, вирус простого герпеса;
- бактериологический анализ спермы;
- определение антиспермальных антител;
- УЗИ органов малого таза;
- УЗИ щитовидной железы;
- гормональный скрининг (тестостерон, ФСГ, пролактин, ТТГ, эстрадиол, ГСПГ);
- ПСА общий;
- медико-генетическое исследование.
- Рентгенологические методы:
- исследование черепа (томография турецкого седла);
- почечная флебография;
- Тестикулярная биопсия.
Жалобы и анамнез
Важно узнать от пациента о подробностях половой жизни. Большинство (80%) мужчин не знают, когда зачатие наиболее вероятно. Тем не менее оценить эту вероятность несложно, если узнать, насколько регулярна половая жизнь. Как правило, сперматозоиды сохраняют жизнеспособность в слизи и железах шейки матки в течение 2–5 сут, а значит, в большинстве случаев одного полового акта через день для зачатия достаточно [1, 3, 20].
Собирая анамнез, необходимо выяснить у пациента следующие сведения.
- Перенесенные заболевания:
- лихорадка;
- системные заболевания (сахарный диабет, злокачественные опухоли, инфекции);
- наследственные болезни (муковисцидоз, синдром Клайнфелтера);
- болезни мочевыводящих путей и половых органов;
- травма, перекрут яичка.
- Перенесенные операции:
- орхидопексия по поводу крипторхизма;
- операция по поводу паховой грыжи;
- операции на органах малого таза (в том числе на мочевом пузыре) и забрюшинном пространстве;
- трансуретральная резекция предстательной железы.
- Сексуальный анамнез:
- начало полового развития;
- сведения о фертильности: случались ли беременности у бывших или настоящих половых партнерш;
- длительность бесплодия;
- лечение по поводу бесплодия;
- сведения о половой жизни и эрекции – время половых актов относительно овуляции и их частота, применение увлажняющих средств.
- Семейный анамнез:
- крипторхизм;
- синдром Картагенера;
- гипоспадия;
- прием тератогенных препаратов матерью во время беременности;
- другие редкие синдромы, например синдром Игла–Барретта.
- Прием лекарственных средств: нитрофурантоин, циметидин, сульфасалазин, спиронолактон, α-адрено-блокаторы.
- Вредные привычки:
- частые тепловые процедуры (баня);
- употребление алкоголя;
- курение;
- употребление кокаина и других наркотических средств;
- применение анаболических стероидов;
- профессиональные вредности;
- воздействие ионизирующего излучения;
- контакт с анилиновыми красителями;
- контакт с пестицидами;
- контакт с тяжелыми металлами (например, свинцом).
Физикальное обследование
Осмотр
При общем физическом обследовании оценивают рост, массу тела, АД, особенности телосложения, тип распределения волосяного покрова и подкожной жировой клетчатки. Форму и степень развития грудных и половых желез оценивают по шкале Таннера (Tanner). Проводят осмотр и пальпацию грудных желез для выявления ложной и истинной гинекомастии.
Урогенитальный статус
Проводят осмотр и пальпаторное обследование органов мошонки с указанием положения, консистенции и размеров яичек, придатков и семявыносящих протоков, при этом нормальные размеры яичка соответствуют 15 см3 и больше и определяются с помощью орхидометра Прадера.
Варикоцеле диагностируют и классифицируют [1, 22, 29]:
- по степени изменения варикозного расширения семенного канатика, определяемого в ортостазе:
- субклиническая степень варикоцеле определяется только с помощью скротальной термографии и/или допплеровского УЗИ;
- варикоцеле I степени определяется пальпаторно с использованием приема Вальсальвы;
- варикоцеле II степени определяется пальпаторно без приема Вальсальвы;
- варикоцеле III степени определяется визуально и пальпаторно;
- по локализации:
- левостороннее;
- правостороннее;
- двустороннее;
- по состоянию сперматогенной функции:
- с нарушением сперматогенеза;
- без нарушения сперматогенеза.
Для выявления состояния придаточных половых желез выполняется пальцевое ректальное обследование предстательной железы и семенных пузырьков, которые в норме не пальпируются.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Исследование эякулята [48]
В стандартное обследование мужчин входит помимо анамнеза и физикального обследования анализ эякулята. Показатели анализа эякулята (табл. 1) стандартизируются ВОЗ и распространяются в публикациях ВОЗ по лабораторной проверке и обработке человеческого эякулята (5-е издание).

Частота выполнения анализа эякулята
Если в соответствии с критериями ВОЗ показатели эякулята находятся в пределах нормативных показателей, достаточно выполнения 1 теста. Если имеются отклонения от нормы по крайней мере 2 показателей, это является показанием к обследованию у уролога.
Важно различать следующие понятия для описания отклонений от нормативных показателей эякулята:
- олигозооспермия: <15 млн сперматозоидов в 1 мл;
- астенозооспермия: <32% подвижных сперматозоидов;
- тератозооспермия: <4% сперматозоидов нормальной формы.
Довольно часто все 3 параметра встречаются вместе (ОАТ-синдром).
В случаях выраженного ОАТ-синдрома (<1 млн сперматозоидов/мл), как при азооспермии, отмечается высокая встречаемость обструкции семенных путей, а также генетических аномалий.

Гормональное обследование
Для выявления эндокринных нарушений и уточнения генеза бесплодия необходимо определение следующих половых гормонов в крови: ФСГ, ЛГ (лютеинизирующий гормон), тестостерона, пролактина, Е2 (эстрадиол) и желательно тестостерона, связанного глобулинами.
При азооспермии или выраженной олигоастенотератозооспермии необходимо различать обструктивные и необструктивные причины. Нормальный уровень ФСГ и достаточный размер обоих яичек могут стать критерием для того, чтобы заподозрить обструкцию. Однако у 29% мужчин с нормальным уровнем ФСГ, тем не менее, имеются нарушения сперматогенеза.
Забор крови для определения гормонов выполняют с 9.00 до 11.00 для исключения влияния циркадианного ритма и при половом воздержании не менее 2 дней. Перед исследованием не следует проводить каких-либо обследований, включая инструментальные. Если полученные результаты не соответствуют предполагаемому диагнозу или противоречивы, исследование следует повторить.
Достоверный показатель андрогенной функции половых желез – определение тестостерона как гормона, обладающего наиболее важным, специфическим и общим действием на мужской организм. Наиболее часто определяют концентрацию общего тестостерона, который циркулирует в крови в связанном с белками (98%) и в свободном состоянии (2%). Однако именно свободный тестостерон взаимодействует с рецепторами и обладает биологической активностью. В связи с этим знание уровня свободного тестостерона позволяет выявить различные гормонально-поведенческие корреляции и объективно оценить эффективность гормонотерапии.
Гипергонадотропный гипогонадизм
Первичный гипогонадизм развивается в результате непосредственного поражения яичек патологическим процессом, при этом наблюдаются недостаточная продукция андрогенов яичками и ответное повышение продукции гонадотропинов. Причины могут быть врожденными и приобретенными.
- Врожденные: синдром Клайнфелтера (иногда в сочетании с гинекомастией), анорхия, синдромы Нунан, Рейнфенштейна (неполной маскулинизации), Дель-Кастилло (отсутствие герминативных клеток).
- Приобретенные: перенесенный орхит, перекрут яичка, кастрация и цитотоксическая терапия.
Гипогонадотропный гипогонадизм
Вторичный гипогонадизм развивается вследствие гипоталамогипофизарной дисфункции, что выражается снижением секреции гонадотропинов. Его причины следующие.
- Гипоталамические нарушения.
- Врожденные: синдромы Кальмана, Лоренса–Муна–Барде–Бидля, Прадера–Вилли, атаксия Фридрейха.
- Приобретенные: постэнцефалитический, посттравматический, опухолевый, при гранулематозных заболеваниях, системных заболеваниях.
- Гипофизарные нарушения.
- Врожденные: аплазия, изолированная недостаточность гонадотропинов с преимущественным дефицитом ЛГ и ФСГ, синдром Мэддока.
- Приобретенные: травма, опухоль, гипофизэктомия, сосудистая недостаточность.
При подозрении на гипогонадотропный гипогонадизм необходимо в плане обследования выполнять МРТ головного мозга (гипофиза) и тест со стимуляцией ЛГ-рилизинг-гормона (люлиберина).
Базальный (фоновый) уровень гормонов чаще характеризует заболевание в общем, и по нему не всегда можно определить степень эндокринных нарушений. Проведение в таких сомнительных случаях функциональных и гормональных проб [проба с хорионическим гонадотропином (ХГ), тест с ЛГ-рилизинг-гормоном] позволяет оценить состояние различных звеньев репродуктивной системы, уточнить характер поражения и разграничить патологические отклонения и варианты физиологической нормы.
Измерение концентрации тестостерона в крови следует проводить у мужчин с клиническими признаками гипогонадизма, нарушениями сексуальной функции и при патозооспермии.
Определение уровня ФСГ в крови выполняют для дифференциальной диагностики гипогонадизма, оно имеет прогностическую ценность для пациентов с варикоцеле и патозооспермией, поскольку высокая его концентрация не позволяет надеяться на восстановление фертильности.
По данным ряда авторов, целесообразность определения ЛГ в крови заключается в выявлении соотношения ЛГ/тестостерон, что будет указывать на резистентность клеток Лейдига и плохой прогноз в терапии бесплодия. Показания к измерению уровня пролактина в крови – ЭД, клинические признаки гипоандрогении и низкая концентрация тестостерона. Определение концентрации Е2 в крови проводят пациентам с гинекомастией, которая может наблюдаться при опухолях надпочечников или яичек.
Микробиологическое исследование
Воспалительный процесс мужской репродуктивной системы является одной из частых причин мужского бесплодия. Высокая частота инфекций половых органов в браке обусловлена распространенностью воспалительного процесса, возможностью длительного бессимптомного поражения половых желез, имеющего часто хроническое и рецидивирующее течение.
Выделяют различные патогенетические механизмы влияния инфекции на физиологию репродуктивного процесса:
- микроорганизмы оказывают прямое и непосредственное действие на сперматозоиды, вызывая их агглютинацию и иммобилизацию (например, хламидии активизируют процессы апоптоза сперматозоидов или, локализуясь на сперматозоидах, снижают подвижность за счет механического фактора);
- нарушение секреторной функции половых желез приводит к изменению реологических и химических компонентов эякулята, поддерживающих и защищающих факторов, тем самым влияя на функциональное состояние сперматозоидов (большинство ИППП);
- вызывая воспаление и склероз в тканях, инфекция создает условия для нарушения проходимости путей для сперматозоидов (гонококковое поражение органов половой системы);
- инфекции активизируют возникновение иммунологических реакций, с появлением антиспермальных антител (АСАТ) становится невозможным продвижение сперматозоидов к яйцеклетке. Показания к проведению микробиологического исследования: изменения в анализе мочи, нормального объема спермы, нарушение подвижности и агглютинация сперматозоидов, отклонения в биохимических показателях спермы и секрета половых желез, ИМП, простатит, эпидидимит, скрытые инфекции семявыносящих путей и заболевания, передаваемые половым путем.
Проведение инфекционного скрининга основывается на выполнении следующих исследований: цитологического анализа отделяемого уретры, секрета простаты и семенных пузырьков, бактериологического анализа спермы и секрета простаты: ПЦР-диагностики хламидий, микоплазм, уреаплазм, цитомегаловируса, вируса герпеса.
Генетическое обследование
Значительная часть случаев мужского бесплодия, расценивавшихся ранее как идиопатические, связана с генетическими отклонениями, которые могут быть выявлены при тщательном изучении родословной и анализе кариотипа, что в конечном счете позволит правильно поставить диагноз и провести адекватное лечение. Среди причин, приводящих к нарушению фертильности мужчин, патологические изменения хромосом составляют 5–15%. У мужчин с олигозооспермией хромосомные аномалии определяют в 11% случаев, а при азооспермии – в 21% случаев [5, 8, 24]. Патозооспермия может быть обусловлена хромосомными аберрациями как в соматических, так и в половых клетках. В связи с этим не вызывает сомнений тот факт, что в определенных клинических ситуациях необходимо проводить цитогенетический и морфологический анализ хромосом. В этом случае исследование включает изучение кариотипа соматических клеток, позволяющих определить числовые и структурные аномалии митотических хромосом по лимфоцитам периферической крови и половых клеток в эякуляте и/или биоптате яичка. Высокая информативность количественного кариологического и цитологического анализа половых клеток позволяет выявлять различные нарушения на всех стадиях сперматогенеза, что во многом предопределяет тактику ведения бесплодной супружеской пары.
Синдром Клайнфелтера – самый частый генетический дефект, вызывающий азооспермию [2, 8]. На него приходится 14% случаев мужского бесплодия (распространенность – 1 на 600 мужчин). Классический синдром Клайнфелтера проявляется триадой симптомов – недоразвитыми плотными яичками, гинекомастией и азооспермией [2, 8]. В 90% случаев синдром Клайнфелтера обусловлен полисомией по Х-хромосоме (кариотип 47 ХХY), в 10% – мозаицизмом 46 ХY/47 ХХY. Фертильность больных возможна при мозаицизме и легких формах синдрома.
Кариотип 46 ХХ
Эта аномалия хромосом обусловлена изменением их структуры и числа, она представляет собой вариант синдрома Клайнфелтера и проявляется у мальчиков пубертатного возраста гинекомастией, у мужчин – азооспермией.
Кариотип 47 ХYY
Эта хромосомная аномалия встречается примерно с той же частотой, что и синдром Клайнфелтера, но отличается большим разнообразием фенотипических проявлений. При исследовании спермы выявляют олиго- или азооспермию. При биопсии яичка картина бывает разной, чаще всего это отсутствие сперматогенеза или изолированная аплазия сперматогенного эпителия.
Синдром Нунан, или Мужской синдром Тернера
Клинические проявления обоих синдромов весьма сходны, хотя при синдроме Нунан кариотип нормальный (46 ХY) или мозаичный (45 Х/46 ХY).
Делеции Y-хромосомы
Примерно у 7% больных олигозооспермией и у 13% больных азооспермией находят структурные изменения длинного плеча Y-хромосомы [6, 14, 24, 26]. Ген SRY, определяющий развитие яичка, не изменен, однако обширные делеции других участков проявляются нарушением сперматогенеза. Делеции хромосом выявляют в клетках крови с помощью ПЦР. Вероятно, в будущем частью исследования спермы станет и анализ дезоксирибонуклеиновой кислоты сперматозоидов. Поскольку у мужчин с делециями Y-хромосомы азооспермия бывает не всегда, при искусственном оплодотворении генетический дефект будет наверняка передаваться сыновьям.
Проведение генетического обследования особенно важно перед использованием вспомогательных репродуктивных технологий, в частности интрацитоплазматической инъекции сперматозоида, так как дефектный генетический материал может стать причиной невынашивания беременности, а в случае родоразрешения быть переданным следующим поколениям.

Биохимическое исследование спермы
Проводят для изучения морфологических и физиологических свойств семенной жидкости, что важно в оценке патологических изменений сперматогенеза. Практическое значение получило определение в сперме лимонной кислоты, кислой фосфатазы, ионов цинка, фруктозы. Секреторную функцию простаты оценивают по содержанию лимонной кислоты, кислой фосфатазы и цинка. Отмечена четкая корреляция между этими показателями, поэтому можно определять только два показателя: лимонную кислоту и цинк. Функцию семенных пузырьков оценивают по содержанию фруктозы. Это исследование особенно важно выполнять при азооспермии, когда низкий уровень фруктозы, рН и ненормально высокое содержание лимонной кислоты указывают на врожденное отсутствие семенных пузырьков [1, 6, 10, 24].
Инструментальные исследования
Включают термографию и УЗИ. Термографический анализ органов мошонки, позволяющий выявлять субклинические стадии варикоцеле и контролировать эффективность хирургического лечения, проводят с помощью специальной термографической пластины или дистанционного тепловизора.
У больных варикоцеле при термографии отмечается термоасимметрия правой и левой половины мошонки в пределах от 0,5 до 3,0°C. Данный метод позволяет устанавливать температурные соотношения также при гидроцеле, паховой грыже, воспалительных заболеваниях органов мошонки. УЗИ выполняют для оценки анатомо-функционального состояния простаты и семенных пузырьков в сагиттальной и поперечной плоскостях с помощью наружного либо трансректального датчика; ультразвуковая допплерометрия имеет аналогичные с термометрией показания.
Иммунологическое обследование
Для определения АСАТ применяются радиоиммунный анализ, твердофазный иммуноферментный анализ и иммуноглобулиновый тест на полиакриловых микросферах (IBT). В настоящее время описано более 90 антигенов сперматозоидов, которые являются как полифункциональными, так и блокирующими тот или иной сегмент взаимодействия сперматозоида и яйцеклетки. Наиболее подробно изучены несколько спермальных антигенов (САГ), ассоциированных с бесплодием, а также кодирующие их гены. Эти САГ: YWK-ll, BE-20, rSMP-B, BS-63, BSll, HED-2, каждый из которых отличается от остальных по структуре и синтезируется разными клетками репродуктивного тракта (половыми клетками, клетками эпителия придатка яичка и клетками Сертоли).
Все изучаемые АСАТ обладают агглютинирующими или иммобилизирующими сперматозоиды свойствами. К методам диагностики иммунологического бесплодия, связанного с выработкой АСАТ, относятся следующие.
- Посткоитальный тест, или тест взаимодействия сперматозоидов со слизью шейки матки. Он проводится в двух вариантах:
- тест in vivo (проба Шуварского–Симса–Хюнера). Пациентка приезжает на исследование после полового акта в дни, предшествующие овуляции. Исследуется содержимое влагалища и шейки матки. Хотя допустимый срок между половым актом и исследованием 24 ч, рекомендуется проведение этой пробы через 3–12 ч после полового акта. Отрицательный («плохой») тест – когда подвижность сперматозоидов в половых путях женщины часто снижается;
- тест in vitro (проба Курцрока–Миллера). Супруги приезжают на исследование в дни, предшествующие овуляции. Муж сдает сперму, а у жены берется капелька слизи шейки матки. Оценивается взаимодействие сперматозоидов и слизи шейки матки под микроскопом. Отрицательным («плохим») результатом теста является снижение поступательного движения сперматозоидов в слизи шейки матки.
- MAR-тест. Тест, который определяет процент сперматозоидов, связанных с антителами классов IgG и IgA (прямой MAR-тест), и титр антиспермальных антител в биологических жидкостях (спермоплазма, слизь шейки матки, плазма крови) (непрямой MAR-тест). Тест является международно признанным стандартом диагностики АСАТ, обладает средней специфичностью и не всегда высокой чувствительностью.
- Immunobead-тест. Является аналогом MAR-теста. Спектры антител, определяемых тестами MAR и immunobead, не всегда совпадают,что объясняет часто наблюдаемое расхождение между результатами тестов у одного и того же пациента.
- Иммуноферментный метод (ELISA). Обычно используется для определения АСАТ в плазме крови. Является дополнительным методом диагностики АСАТ. Высокие титры АСАТ, определяемые методом ELISA, в крови у женщин не всегда связаны с ухудшением прогноза наступления беременности. Следует помнить, что самой частой причиной отрицательного посткоитального теста является наличие АСАТ в сперме (т.е. проблема связана с мужем), а не в шейке матки. Однако очень часто наблюдается сочетание роли как мужских, так и женских факторов. Посткоитальный тест является одним из самых «капризных» тестов в обследовании бесплодия. Достаточно велик процент ложных результатов этого исследования. Поэтому посткоитальный тест необходимо дополнять проведением специальных исследований на АСАТ [1, 8, 13, 27].
Тестикулярную биопсию проводят у пациентов с азооспермией, отсутствием в эякуляте клеток сперматогенеза, нормальными объемом яичек и концентрацией ФСГ в плазме крови. Результат теста оценивают, как нормо-, гипо- и асперматогенез. Рекомендуют применять открытую биопсию и при наличии сохраненного сперматогенеза проводить хирургическую коррекцию семявыносящих путей одновременно. Данную манипуляцию желательно проводить в условиях клиники ВРТ, чтобы предотвратить потери биопсийного материала и минимизировать риск развития аутоиммунного бесплодия, возникающий при повторном повреждении гематотестикулярного барьера. Данный метод позволяет выполнять дифференциальную диагностику между обтурационной и необтурационной формами азооспермии, определяя степень патологического процесса.
Лечение
В зависимости от выявленных причин заболевания предусматривают различные виды лечения, которые можно разделить на консервативные, хирургические и альтернативные.
Инфекции добавочных мужских половых желез и бесплодие [48]
Инфекции урогенитального тракта у мужчин относятся к числу потенциально излечимых заболеваний при мужском бесплодии [1–3]. В соответствии с рекомендациями ВОЗ различают уретрит, простатит, орхит и эпидидимит. Все они объединены общим понятием – инфекции добавочных мужских половых желез. Однако не существует прямых данных, подтверждающих отрицательное влияние инфекций на качество эякулята и фертильность мужчин.
АНАЛИЗ ЭЯКУЛЯТА
Анализ эякулята позволяет определить степень поражения инфекционным процессом предстательной железы и получить информацию о качестве спермы. Кроме того, анализ числа лейкоцитов позволяет дифференцировать синдром хронической тазовой боли – воспалительного и невоспалительного характера (NIH IIa против IIIb NIH).
Результаты микробиологического исследования
После исключения уретрита и цистита наличие пероксидаза положительных лейкоцитов в числе более 106 на 1 мл эякулята свидетельствует о воспалительном процессе. В этих случаях проводится бактериологический анализ на часто встречающиеся уропатогены и особенно на грамотрицательные бактерии. Концентрация патогенов мочевого тракта в эякуляте >103 КОЕ/мл свидетельствует о значительной бактерио-
спермии. В клиниках, занимающихся бесплодием, из мочеполового тракта мужчин выделяются и идентифицируются разнообразные микроорганизмы, при этом в большинстве случаев обнаруживается более 1 штамма возбудителей [1]. Время взятия анализа может влиять на уровень представленности микроорганизмов в эякуляте и частоту выделения различных штаммов [6]. В настоящее время идеального диагностического теста для Chlamydia trachomatis в эякуляте мужчин не создано [7]. В отличие от результатов серологических исследований у женщин антитела к C. trachomatis в плазме эякулята отражают наличие инфекции, если не используются специфические методы [7].
Ureplasma urealyticum обладает патогенными свойствами только при высокой концентрации (>103 КОЕ/мл
эякулята). Такие концентрации уреаплазмы обнаруживаются не более чем в 10% проанализированных образцов [8]. При анализе эякулята колонизация мочеиспускательного канала нормальной микрофлорой затрудняет выделение инфекций, ассоциированных с урогенитальными микоплазмами [9].
Лейкоциты
Клиническое значение повышения концентрации лейкоцитов в эякуляте противоречиво [10]. На инфекцию указывает повышение уровня лейкоцитов (особенно полиморфноядерных) и продуктов их метаболизма (например, лейкоцитарной эластазы), выделяемых в семенную жидкость. Большинство лейкоцитов составляют нейтрофилы, на это указывает специфическое окрашивание при пероксидазной реакции [2]. И хотя лейкоцитоспермия (пиоспермия) является признаком воспаления, она не всегда ассоциирована с бактериальной или вирусной инфекцией [11]. Более ранние исследования показали, что повышение уровня лейкоцитов в эякуляте не служит истинной причиной мужского бесплодия [12]. В соответствии с классификацией ВОЗ наличие >1×106 лейкоцитов/мл определяется как лейкоцитоспермия. Только в двух исследованиях проведен анализ содержания лейкоцитов в эякуляте при доказанном простатите [13, 14]. Оба исследования показали, что при простатите количество лейкоцитов в эякуляте больше, чем при отсутствии воспаления (синдром хронической тазовой боли, тип NIH IIIb).
Качество эякулята
Обсуждается отрицательное влияние хронического простатита на плотность, подвижность и морфологию сперматозоидов [1]. Все исследования показывают противоречивые результаты и не подтверждают негативного влияния хронического простатита на параметры качества сперматозоидов [15–17].
Изменения в семенной плазме
Эластаза в семенной плазме служит биохимическим индикатором активности полиморфноядерных лейкоцитов в эякуляте [1, 18, 19]. Считается, что верхняя граница нормы (пороговая концентрация) эластазы составляет приблизительно 600 нг/мл [1]. В процессе воспаления участвуют различные цитокины, которые могут влиять на функции сперматозоидов. В ряде исследований изучалась связь между уровнями интерлейкина (ИЛ), лейкоцитов и функциями сперматозоидов [20–22] – корреляций не обнаружено. Следует отметить, что предстательная железа является основным источником продукции ИЛ-6 и ИЛ-8 в семенной плазме. Цитокины, особенно ИЛ-6, играют важную роль в процессах воспаления добавочных мужских желез [23]. Тем не менее увеличение уровней цитокинов напрямую не связано с числом лейкоцитов в секрете предстательной железы [24].
Нарушение секреции добавочных мужских половых желез
Инфекции половых желез могут влиять на их секреторную функцию. Индикаторами нарушения нормальной секреции предстательной железы являются снижение уровня лимонной кислоты, фосфатазы, фруктозы, цинка и активности α-глутамилтрансферазы [1]. Снижение концентрации фруктозы отражает нарушение функции семенных пузырьков [8, 25].
Антитела к сперматозоидам
Определение антител плазмы крови к антигенам сперматозоидов при обследовании по поводу бесплодия у мужчин имеет небольшую ценность. В более ранних сообщениях указывалось на связь между высоким уровнем антител к сперматозоидам в плазме крови и абактериальным простатитом [26, 27]. Тем не менее за исключением случаев подозрения на хламидийную инфекцию [28] только вазэктомия в анамнезе является предиктором образования антител [29].
Активные формы кислорода
Свободные радикалы кислорода могут быть повышены при хронических урогенитальных инфекциях, ассоциированных с повышенным числом лейкоцитов [30]. Однако их биологическое значение при простатитах остается неясным [1].
ЛЕЧЕНИЕ
Лечение хронического простатита обычно направлено на устранение симптомов болезни [31,32]. При нарушениях в составе эякулята у мужчин с воспалительными процессами в урогенитальном тракте назначения андролога должны быть нацелены на:
- уменьшение числа или эрадикацию микроорганизмов в простатическом секрете и эякуляте;
- нормализацию лабораторных показателей воспаления (например, лейкоцитов) и секреторной функции;
- улучшение показателей эякулята для восстановления нарушенной фертильности [33].
Лечение включает назначение антибиотиков, противовоспалительных препаратов, хирургические процедуры, нормализацию уродинамики, физиотерапию, а также изменение образа жизни и полового поведения.Только антибиотикотерапия при хроническом простатите (ХБП, NIH II) позволяет устранять симптомы болезни, обеспечивать эрадикацию патогенных микроорганизмов, снижать клеточные и гуморальные параметры воспаления в урогенитальных секретах. Использование α-адреноблокаторов для устранения симптомов болезни спорно. Хотя антибиотики могут улучшать качество эякулята [33], не существует доказательств того, что лечение хронического простатита увеличивает способность к зачатию [1, 34].
ЭПИДИДИМИТ
Воспаление придатка яичка проявляется односторонней болью и отеком, как правило, имеет острое начало. Среди сексуально активных мужчин младше 35 лет эпидидимит чаще всего вызывается Chlamydia trachomatis или Neisseria gonorrhoea [35, 36]. Эпидидимит, передаваемый половым путем, обычно сопровождается уретритом. Эпидидимит, не ассоциированный с половыми инфекциями, связан с инфекциями мочевыводящих путей и чаще наблюдается у мужчин старше 35 лет, которым проводились эндоуретральные процедуры, операции на мочевыводящих путях или при наличии аномалий мочевыводящих путей [37].
Анализ эякулята
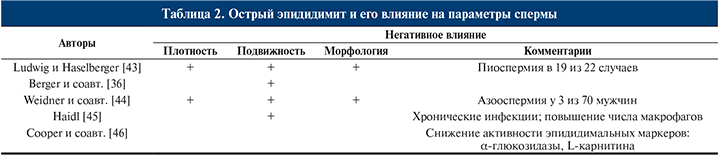
Анализ эякулята по критериям ВОЗ должен включать анализ лейкоцитов, выявляющий актив-ность воспалительного процесса. В большинстве случаев наблюдается транзиторное снижение числа сперматозоидов и их поступательного движения [36, 38, 39]. Вялотекущий ипсилатеральный орхит [40, 41] может стать причиной незначительных изменений качества эякулята (табл. 2) [42].
Наиболее серьезными последствиями двустороннего эпидидимита являются развитие стеноза эпидидимального протока, снижение числа сперматозоидов и азооспермия. Частота развития азооспермии после эпидидимита неизвестна.
Лечение
Антибактериальная терапия показана до получения результатов посева. Лечение эпидидимита приводит к:
- эрадикации возбудителя инфекции;
- устранению симптомов болезни;
- предотвращению поражения яичек и передачи инфекции;
- снижению риска развития осложнений (например, бесплодия и хронической тазовой боли).
С пациентами, у которых выявлен или подозревается эпидидимит, вызванный N. gonorrhoea или
C. trachomatis, следует провести беседу о необходимости обследования и лечения полового партнера [47].
КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
Патогенетическое лечение
Направлено на устранение механизма бесплодия. Как правило, оно оправданно с экономической точки зрения. Иногда достаточно скорректировать образ жизни пациентов, их пристрастия, устранить вредные факторы воздействия для восстановления нормального сперматогенеза.
Рекомендации по половой жизни
Супружеским парам нужно рассказать, когда зачатие наиболее вероятно, как установить момент овуляции (по изменению базальной температуры или по уровню ЛГ в моче, который повышается менее чем за 24 ч до овуляции) и какие вещества снижают фертильность. Поскольку сперматозоиды выживают в шеечной слизи в течение 48 ч, не обязательно, чтобы половой акт точно совпадал с овуляцией. Об этом тоже нужно рассказать и тем самым уменьшить психологическое напряжение, которое испытывает бесплодная супружеская пара. Достаточно одного полового акта через день незадолго до и после овуляции. В качестве увлажняющих средств лучше пользоваться растительным, например оливковым, маслом или вазелином.
Консервативные методы лечения применяют в основном при инфекции половых органов, патозооспермии, эндокринном бесплодии и сексуально-эякуляторных нарушениях.
Ретроградная эякуляция – результат неполного закрытия шейки мочевого пузыря во время эякуляции [1, 7, 8, 13]. Диагноз подтверждают, выявляя сперматозоиды в моче, полученной из мочевого пузыря после эякуляции. Лечение начинают с адреномиметиков, которые частично устраняют ретроградную эякуляцию в 20% случаев. За несколько суток до полового акта назначают имипрамин по 25–50 мг внутрь 2 раза в сутки. Из-за побочных эффектов эти препараты часто приходится отменять. При неэффективности медикаментозного лечения прибегают к ЭКО.
Встречается и другое нарушение – преждевременная эякуляция. В таких случаях бывает очень эффективной психотерапия в сочетании с трициклическими антидепрессантами или ингибиторами обратного захвата серотонина (например, флуоксетином).
Бесплодие при иммунных нарушениях
Этот вид бесплодия трудно поддается лечению. Применяют глюкокортикоиды, отмывание сперматозоидов, искусственное осеменение, экстракорпоральное оплодотворение с микроинъекцией сперматозоидов в цитоплазму яйцеклетки.
Лечение супружеских пар с выявленным повышением уровня АСАТ проводится по-разному – в зависимости от всего комплекса данных обследования. Начинают обычно с применения барьерного метода (презерватив) в постоянном режиме сроком на 3–6 мес или в прерывистом режиме (половая жизнь без презерватива только в дни, благоприятные для наступления беременности). Параллельно может назначаться терапия, снижающая вязкость слизи шейки матки (гвайфенезин) и подавляющая продукцию АСАТ у супругов. При неудаче консервативной терапии проводятся курсы внутриматочной инсеминации спермой мужа или оплодотворение in vitro (ЭКО).
Для снижения уровня АСАТ назначают преднизолон (Божедомов В.А. и др., 2000) в дозе 40 мг/сут курсами до 3–5 дней. Назначение преднизолона короткими курсами в указанной дозе подавляет выработку антиспермальных антител. Модификацией способа является назначение преднизолона в течение 5 дней ежедневно, в суточной дозе 1,2 мг на 1 кг массы тела больного (по 30 мг per os 3 раза в день, что составляет 90 мг при средней массе тела больного 75 кг). После окончания лечения преднизолоном пациенту через день проводят курс плазмафереза, до нормализации показателей (Кореньков Д.Г. и др., 2004). Как сообщают авторы, у 89% больных улучшились основные показатели спермограммы, а эффективность лечения подтвердилась наступлением беременности в большинстве наблюдений.
В последнее время появились сообщения об экспериментальном назначении антиоксиданта эмоксипина при высоком уровне АСАТ. Препарат обладает антитоксическим и мембраностабилизирующим действиями. Назначение раствора эмоксипина в дозе 0,3–0,5 мл внутримышечно мужчине в первые 14 дней овуляторного цикла у партнерши приводит к выраженному снижению уровня АСАТ с высокой долей вероятности. Для эффективного снижения АСАТ необходимо два подобных курса (Божедомов В.А. и др., 2011). Полученные результаты неоднозначны и ввиду отсутствия эффективных методик по снижению АСАТ заслуживают самого пристального внимания.
В целом лечение показано, если с АСАТ связано более 10% сперматозоидов.
Бесплодие при эндокринных нарушениях
Проводят корригирующую гормональную терапию. Она должна быть целенаправленной, а не эмпирической. При выявлении эндокринных расстройств необходимо подключение эндокринологов.
При гиперпролактинемии прекращается импульсный выброс гонадолиберина. При макроаденоме гипофиза показана транссфеноидальная аденомэктомия. При микроаденоме – терапия бромокриптином 5–10 мг/сут внутрь [8, 13, 22].
Бесплодие возможно при заболеваниях щитовидной железы. На сперматогенез влияют и снижение, и повышение уровней тиреоидных гормонов. С заболеваниями щитовидной железы связано 0,5% случаев мужского бесплодия, причем они хорошо поддаются лечению [8]. Поскольку и гипотиреоз, и тиреотоксикоз обычно проявляются клинически, определять уровни тиреоидных гормонов у всех бесплодных мужчин нецелесообразно.
При врожденной гиперплазии коры надпочечников чаще всего наблюдают недостаточность 21-гидроксилазы, яички не развиваются, так как секреция гонадотропных гормонов подавлена высоким уровнем андрогенов коры надпочечников. Эта болезнь встречается редко и обычно проявляется в период полового развития. Диагноз устанавливают лабораторными методами. У больных обоего пола для лечения и основного заболевания, и бесплодия применяют глюкокортикоиды.
Избыток и дефицит тестостерона
Для синдрома Кальманна характерен дефицит гонадолиберина, необходимого для нормального функционирования гипофиза. При этом синдроме весьма эффективным бывает ХГ по 1000–2000 ЕД внутримышечно 3 раза в сутки и менотропин (комбинация ЛГ и ФСГ) 75 МЕ ФСГ и 75 МЕ ЛГ внутримышечно 2 раза в неделю. При патологических изменениях гипофиза наиболее эффективны ХГ и менотропин. При бесплодии на фоне изолированного дефицита ЛГ (синдром Паскуалини) назначают ХГ. Поскольку эти препараты предназначены для инъекции и дороги, как только в эякуляте появляются подвижные сперматозоиды, следует сразу прибегнуть к их криоконсервации. Как правило, для этого требуется 6–9 мес лечения.
Эмпирическое медикаментозное лечение [48]
- У 44% мужчин с бесплодием достоверные причины его возникновения обнаружить не удается [1].
- Несмотря на большой выбор препаратов для лечения идиопатического мужского бесплодия, научная доказательность эмпирического подхода в терапии невелика [2].
- Андрогены, ХГЧ/человеческий менопаузальный гонадотропин, бромкриптин, α-адреноблокаторы, си-
стемные кортикостероиды и препараты магния неэффективны в лечении ОАТ-синдрома.
- Фоликулостимулирующий гормон может оказывать положительное воздействие на определенных пациентов [3].
- Кокрейновское исследование показало, что у мужчин, принимающих антиоксиданты перорально, значительно увеличивался коэффициент рождаемости [ОШ=4,85; 95% ДИ: 1,92–12,24, р=0,0008; I (2)=0%] по сравнению с мужчинами, получавшими контрольную терапию.
- Отсутствуют исследования, которые показали бы вредные побочные эффекты от антиоксидантной терапии.
- Данные свидетельствуют о том, что применение антиоксидантов у субфертильных мужчин может улучшить результаты живорождения и частоты наступления беременности для пар, проходящих циклы вспомогательных репродуктивных технологий.
![]()
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Время доказало эффективность хирургических методов лечения бесплодия – они нередко помогают устранить его причину и избежать искусственного оплодотворения, сопряженного с большими финансовыми затратами.
Варикоцеле
Хотя большинство мужчин с варикоцеле фертильны, причинно-следственная связь между этим заболеванием и бесплодием подтверждена клиническими наблюдениями, а также ретроспективными и проспективными исследованиями. При варикоцеле применяют открытые и малоинвазивные вмешательства. Среди них лапароскопическая или открытая перевязка яичковой вены забрюшинным, паховым или подпаховым доступом и эмболизация яичковой вены. Цель любого из этих вмешательств – прекращение ретроградного тока венозной крови по яичковой вене. Следует учесть, что частота зачатия при выжидательной тактике составляет 16%, при экстракорпоральном оплодотворении – 35% [8, 13, 23]. Частота осложнений после открытого вмешательства по поводу варикоцеле – 1%, после лапароскопической операции – 4%, после эмболизации – 10–15%. Последний показатель отражает и те случаи, когда яичковую вену не удается катетеризировать и эмболизировать.
Тем не менее следует учитывать, что хирургическое лечение варикоцеле, по данным многих рандомизированных исследований (Krause et al., 2002; Unalet al., 2001; Grasso et al., 2000; Yamamoto et al., 1996; Madgar et al., 1995; Nilsson et al., 1979; Nieschlag et al., 1998), не увеличивает количество и подвижность сперматозоидов.

Обструктивная азооспермия
Оперативное лечение в зависимости от места наложения анастомоза делят на три группы: вазовазоанастомоз, вазоэпидидимоанастомоз, вазотестикулоанастомоз [1].
Вазовазостомия
О непроходимости семявыносящих путей следует думать при нормальных уровнях половых и гонадотропных гормонов, нормальных размерах яичек и азооспермии.
Разработано несколько равноценных по эффективности методик вазовазостомий. Использование операционного микроскопа позволяет точнее сопоставлять концы семявыносящего протока. Обычно накладывают одно- или двухрядный анастомоз.
Независимо от методики успех любой операции зависит главным образом от искусства хирурга. Через 8 лет после операции успешность вазовазостомий составляет менее 50% [24]. При длинном (более 2,7 см) участке семявыносящего протока между яичком и местом перевязки, а также при поступлении из просвета пересеченного участка прозрачной жидкости, содержащей сперматозоиды, прогноз благоприятный. В этом случае вазовазостомия оказывается эффективной более чем в 95% случаев. Если в жидкости, полученной из семявыносяшего протока, сперматозоиды отсутствуют, скорее всего, при этом поврежден достаточно уязвимый проток придатка яичка, длина которого составляет примерно 5,5 мм. Чем больше срок после вазэктомии, тем выше давление в дистальной культе семявыносяшего протока, в результате может происходить разрыв протока придатка яичка – самого слабого участка семявыносящих путей. Заживая, поврежденный участок становится непроходимым. В этом случае показана эпидидимовазостомия, при которой семявыносящий проток соединяют с протоком придатка яичка проксимальнее уровня обструкции.

Эпидидимовазостомия устраняет азооспермию в 60–65% случаев, ее микрохирургическая модификация еще эффективнее [8, 11].
Как правило, после вазовазостомий беременность наступает не более чем в 67% случаев, поэтому, прежде чем решаться на операцию, нужно исключить женское бесплодие. Вазоэпидидимоанастомоз рекомендуют совмещать с аспирацией семенной жидкости и криоконсервацией полученных сперматозоидов для возможного использования в последуюшем экстракорпоральных методов оплодотворения.
Тестикуловазоанастомоз выполняют после резекции придатка в зоне rete testis [1].
Аспирация сперматозоидов
Применяют при нарушении транспорта сперматозоидов из-за аплазии семявыносящих путей или их неустранимой непроходимости на любом уровне от придатка яичка до семенного бугорка. Примеры – аплазия семявыносящего протока или неудачный исход вазовазостомии. Сперматозоиды можно получить из семявыносящего протока, яичка или его придатка. Безусловно, в таких случаях зачатие без экстракорпорального оплодотворения невозможно. В связи с этим конечный результат зависит от правильного выбора методики искусственного оплодотворения. При аспирации сперматозоидов из яичка или его придатка перед экстракорпоральным оплодотворением необходимы микроманипуляции. Понятно, что это возможно только при сохраненном сперматогенезе. Косвенно наличие сперматогенеза подтверждают по уровням гормонов и объему яичка, но самый точный метод диагностики в данном случае – биопсия яичка.
Аспирация сперматозоидов из семявыносящего протока
Процедуру выполняют под местной анестезией через разрез на мошонке. Под операционным микроскопом рассекают семявыносящий проток, вытекающую сперму аспирируют и помещают в питательную среду. Когда получено достаточное количество сперматозоидов (10–20 млн), на семявыносящий проток накладывают швы. Самые зрелые и жизнеспособные сперматозоиды получают именно из семявыносящего протока, так как они уже прошли придаток яичка, где происходит их окончательное созревание.
Аспирация сперматозоидов из придатка яичка
К этому методу прибегают в том случае, когда семявыносящий проток либо отсутствует, либо непроходим на обширном участке после перенесенных операций, травмы или инфекции. Доступ к придатку яичка такой же, как к семявыносящему протоку, через разрез на мошонке, хотя часто выполняют простую пункцию. Сперматозоиды получают из одного выделенного протока – аспирируют 10–20 млн (их используют для экстракорпорального оплодотворения), после чего проток придатка яичка ушивают. Сперматозоиды, полученные из придатка яичка, не столь зрелые, как те, которые прошли через придаток яичка в семявыносяший проток, поэтому, как уже говорилось, перед экстракорпоральным оплодотворением требуются микроманипуляции. При использовании материала из придатка яичка оплодотворение наблюдается в 65% случаев, беременность – в 50%, но в каждом случае вероятность успеха определяется характеристиками и сперматозоидов, и яйцеклеток [8, 17, 24].
Получение сперматозоидов из яичка
Эта методика появилась в 1995 г. Ее успешность доказала, что сперматозоидам не обязательно проходить через придаток яичка, чтобы приобрести способность к оплодотворению. Получение сперматозоидов из яичка показано при обструкции придатка в месте соединения с яичком и непроходимости выносящих канальцев [8, 19, 25]. Еще одно показание – тяжелая тестикулярная недостаточность, при которой вырабатывается так мало сперматозоидов, что они не попадают в эякулят.Техника манипуляции такая же, как при биопсии, – получение участка ткани яичка под местной анестезией. Затем полученный материал обрабатывают в лаборатории, чтобы отделить сперматозоиды от других клеток. При использовании сперматозоидов, полученных из яичка, оплодотворение может наступать в 50–65% случаев, беременность – в 40–50%.
Анэякуляторный синдром
Отсутствие эякуляции чаще всего обусловлено повреждением спинного мозга и операциями на органах малого таза или забрюшинного пространства с повреждением симпатических нервов. В этом случае при введении электрода в прямую кишку (метод трансректальной электроэякуляции) удается стимулировать сокращение семявыносящих протоков и семенных пузырьков и вызывать рефлекторную эякуляцию. Сперму, предназначенную для искусственного оплодотворения, собирают из полового члена и мочевого пузыря, так как после электростимуляции эякуляция часто бывает ретроградной.
Трансректальная электроэякуляция эффективна после забрюшинной лимфаденэктомии. При этом подвижность сперматозоидов снижена, что нельзя объяснить ни воздействием электрического тока, ни выделением тепла во время процедуры. У мужчин с повреждением спинного мозга выше сегмента T5 эякуляцию нередко удается вызывать с помощью высокочастотного (100 Гц) вибратора для полового члена с амплитудой колебаний 2–3 мм. Мужчину обучают этой методике. Для сбора спермы и искусственного осеменения используют шеечный колпачок [8, 10].

Орхидопексия
На первом году жизни крипторхизм выявляют у 0,8% мальчиков. В возрасте старше 1 года вероятность самопроизвольного опускания яичка в мошонку очень мала. Хотя орхипексию выполняют в основном из-за высокого риска злокачественной опухоли яичка, чтобы в случае развития опухоли своевременно выявить ее при пальпации, целью операции является и сохранение фертильности (как уже отмечалось выше, эффективность орхипексии в этом отношении сомнительна). При гистологических исследованиях не опустившегося в мошонку яичка обнаружено, что к 2 годам в нем значительно уменьшается число сперматогониев. Орхипексию рекомендуют выполнять не позже этого возраста, чтобы предотвратить изменения, хотя теоретические предпосылки на практике не оправдываются. Однако поскольку сперматозоиды для искусственного оплодотворения можно получить даже из атрофированного яичка со сниженной функцией, предпочтительна именно орхипексия, а не орхэктомия [8, 21]. Следует отметить, что при наличии признаков атрофии возникает высокий риск развития аутоиммунного бесплодия за счет повышения уровня антиспермальных антител, которые могут повреждать сперматогенез в здоровом яичке при полной сохранности его гормонпродуцирующей функции, поэтому чем раньше пациент перенесет данную операцию, тем больше шансов на восстановление уровня сперматогенеза. Минимальный возраст для выполнения операции составляет 3 мес (после 2 курсов ХГЧ-стимулирующей терапии).
Перекрут яичка – неотложное урологическое заболевание. Результаты экспериментов на животных показывают, что после перекрута одного яичка во втором нарушается сперматогенез. Этот процесс называют симпатической орхипатией, и ее причиной считают аутоиммунную реакцию.
Тем не менее в литературе почти нет доказательств, что у человека происходит аналогичный процесс. Сторонники гипотезы о симпатической орхипатии для ее профилактики рекомендуют удалять перекрученное яичко сразу после постановки диагноза [28]. Однако при современных методах лечения бесплодия сперматозоиды можно получить даже при тестикулярной недостаточности, поэтому в настоящее время упомянутая тактика не рекомендуется.
ИСКУССТВЕННОЕ ОПЛОДОТВОРЕНИЕ
Если мужское бесплодие не поддается медикаментозному и хирургическому лечению, прибегают к искусственному оплодотворению.
Искусственное осеменение (внутриматочная инсеминация)
Принцип искусственного осеменения – введение отмытой спермы непосредственно в полость матки. Главное показание – гибель сперматозоидов в шеечной слизи. В этом случае беременность возможна, если сперматозоиды минуют шейку матки. Другие показания – неудовлетворительные показатели исследования спермы, иммунные нарушения и пороки развития (например, гипоспадия), из-за которых нарушен транспорт сперматозоидов. Искусственное осеменение дает шансы на успех, если в эякуляте содержится 5–40 млн
подвижных сперматозоидов. Эффективность этой методики очень непостоянна и зависит от репродуктивной функции женщины. Частота беременности после одного цикла лечения при мужском бесплодии составляет 8–16%. Сроки искусственного осеменения определяют с помощью УЗИ и по уровню ЛГ в сыворотке крови [8,16, 29].
Экстракорпоральное оплодотворение и микроинъекция сперматозоидов в цитоплазму яйцеклетки
Экстракорпоральное оплодотворение – технически более сложная, чем искусственное осеменение, процедура. Она позволяет избегать любые нарушения транспорта сперматозоидов по женским половым органам. Экстракорпоральное оплодотворение включает индукцию овуляции и взятие яйцеклеток из яичников под контролем УЗИ до наступления овуляции с последующим оплодотворением их в чашке Петри 0,5–5,0 млн сперматозоидов. Эта методика весьма эффективна при тяжелом мужском бесплодии, когда число подвижных сперматозоидов резко снижено. Экстракорпоральное оплодотворение со временем дополнили принципиально новой процедурой – микроинъекцией сперматозоидов в цитоплазму яйцеклетки. С этого времени необходимость использовать сотни сперматозоидов для экстракорпорального оплодотворения отпала, так как для микроманипуляции достаточно одного жизнеспособного сперматозоида. В свою очередь эта методика ускорила появление новых хирургических методов, предназначенных для получения сперматозоидов у мужчин с азооспермией. Вместо эякулята для получения сперматозоидов начали использовать семявыносящие пути. В настоящее время сперматозоиды для микроинъекции в цитоплазму яйцеклетки берут из семявыносяшего протока, яичка и его придатка. Недостаток экстракорпорального оплодотворения с микроманипуляциями – устранение естественного отбора, который действует при обычном оплодотворении, из-за чего генетические дефекты, вызывающие бесплодие, с высокой вероятностью наследуются потомством [8, 16, 18]. Это сопряжено с рядом этических проблем, особенно при лечении мужчин с синдромом Клайнфелтера, который может проявиться у внуков мужчины, страдающего излечимым благодаря современным методам бесплодием.


