Введение. В настоящее время «золотой» стандарт оперативного лечения почечно-клеточного рака (ПКР) на стадии Т1а – органосохранные операции (ОСО). На стадиях Т1b и Т2 ОСО могут быть выполнены при наличии технической возможности проведения пособия [1–3]. Для выполнения ОСО хирург может воспользоваться одним из следующих доступов: открытым, лапароскопическим, робот-ассистированным, а также аблативными методами с чрескожным доступом.
Первая лапароскопическая резекция почки (ЛРП) при доброкачественном заболевании почки выполнена Winfield в 1992 г., и только к началу 2000-х гг. появились первые публикации об успешных сериях ЛРП больным ПКР [4–6]. Однако на то, чтобы накопить достаточный объем операций, ушло почти 10 лет, в чем непоследнюю роль играет более длинная кривая обучения важнейшим хирургическим приемам видеоэндоскопических пособий [7, 8]. Между тем выбор в пользу ЛРП оправдан тем, что данный доступ позволяет соблюдать принципы онкологической абластичности в полном объеме и обеспечивает сокращение сроков госпитализации пациента [9].
Для принятия решения о хирургической тактике лечения больного ПКР в настоящее время разработаны и применяются более 10 шкал морфометрической оценки. Наиболее известные и часто используемые шкалы нефрометрии: RENAL, PADUA, С-index [10–12].
С целью оценки краткосрочных результатов ОСО в настоящее время широко используются показатели MIC (время тепловой ишемии ≤20 мин, отрицательный хирургический край резекции, степень осложнений по шкале Clavien–Dindo ≤II) или трифекта (время тепловой ишемии ≤25 мин, отрицательный хирургический край резекции, отсутствие послеоперационных осложнений) [13, 14].
В исследованиях кривой обучения ЛРП, имеющихся в настоящее время, в большинстве случаев представлен опыт одного хирурга или сравнительный анализ навыков двух хирургов при выполнении ОСО из различных доступов [15–17].
Цель настоящего исследования: провести анализ кривой обучения ЛРП хирургов в наблюдениях с локализованными образованиями паренхимы почки посредством расчета показателя MIC в зависимости от степени сложности, определяемой на основании нефрометрических индексов RENAL и PADUA.
Материалы и методы. В ретроспективный анализ включены 320 пациентов с новообразованиями почки. Критерий включения в исследование: ЛРП, выполненная из трансабдоминального доступа в Институте урологии и репродуктивного здоровья человека Сеченовского Университета с января 2014 по июнь 2019 г. Критерии невключения: операции на единственной почке, при аномалиях почки, при множественных новообразованиях почки, а также операции из ретроперитонеоскопического доступа. Из клинических показателей учитывали возраст, пол, индекс массы тела (ИМТ), индекс коморбидности Charlson [18], скорость клубочковой фильтрации (СКФ) до операции и через 24 ч после операции, индексы RENAL и PADUA.
Всем пациентом до операции проведены стандартные физикальные и инструментальные обследования. Дополнительно проводилась мультиспиральная компьютерная томография с контрастированием с последующим 3D-моделированием. Кроме того, виртуально осуществляли операции при помощи программы 3D-моделирования Amira компании VSG версии 5.4.5 (лицензия ASTND.44644) по ранее описанной методике [19]. Расчет индексов RENAL и PADUA проводил один опытный врач-уролог по 3D-построениям.
Согласно балльной оценке индексов нефрометрии, выделено 3 степени сложности: 1-я – RENAL 4–6 баллов, PADUA – 6–7; 2-я степень – RENAL – 7–8 баллов, PADUA 8–9; 3-я степень – RENAL ≥ 9баллов, PADUA ≥10.
Операции были выполнены четырьмя урологами, каждый из которых имеет свой индивидуальный номер в базе статистики Института урологии и репродуктивного здоровья человека Сеченовского Университета (1Е.С., 4Е.Ш., 7Е.Б., 13М.Е.)7. База ведется с 2011 г.. Каждый из хирургов имеет опыт выполнения не менее 30 вмешательств из лапароскопического доступа.
Учитывали длительность пособия, объем кровопотери, время тепловой ишемии, вид ишемии, наличие положительного хирургического края, развитие послеоперационных осложнений по классификации Clavien–Dindo [20].
Было выделено две эры, каждая их которых включила 40 последовательно выполненных каждым хирургом ЛРП.
Расчет MIC проводили отдельно для каждого оператора в зависимости от степени сложности наблюдений и эры.
Все ЛРП выполнены по стандартной методике с использованием инструментов и видеоэндоскопического оборудования компаний «Карл Шторц» и «Эскулап».
Статистическая обработка полученных результатов проведена при помощи компьютерной программы IBM SPSS, версия 22.0. С целью определения значимых параметров, при помощи которых можно определить MIC для каждого пациента, проведен дискриминантный анализ с использованием метода принудительного включения. В дискриминантный анализ были включены следующие параметры: пол, возраст, абсолютный объем образований, оператор, СКФ до операции, сложность, индекс Charlson, ИМТ, индексы RENAL и PADUA.

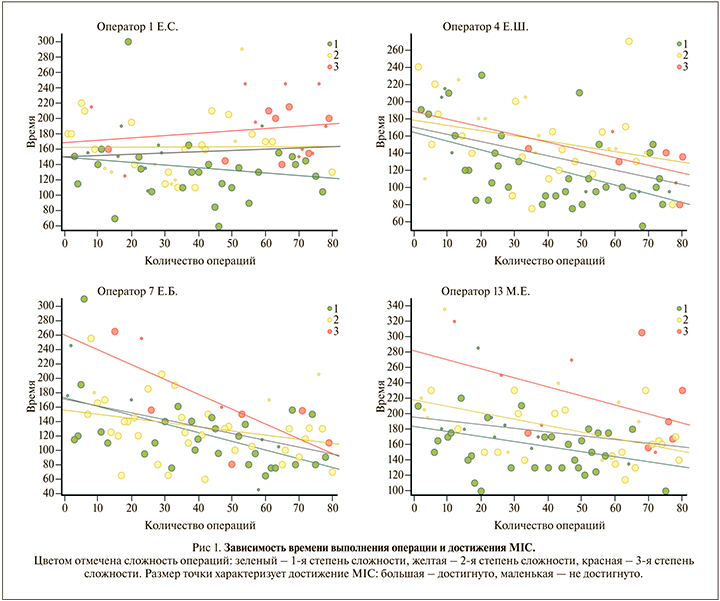
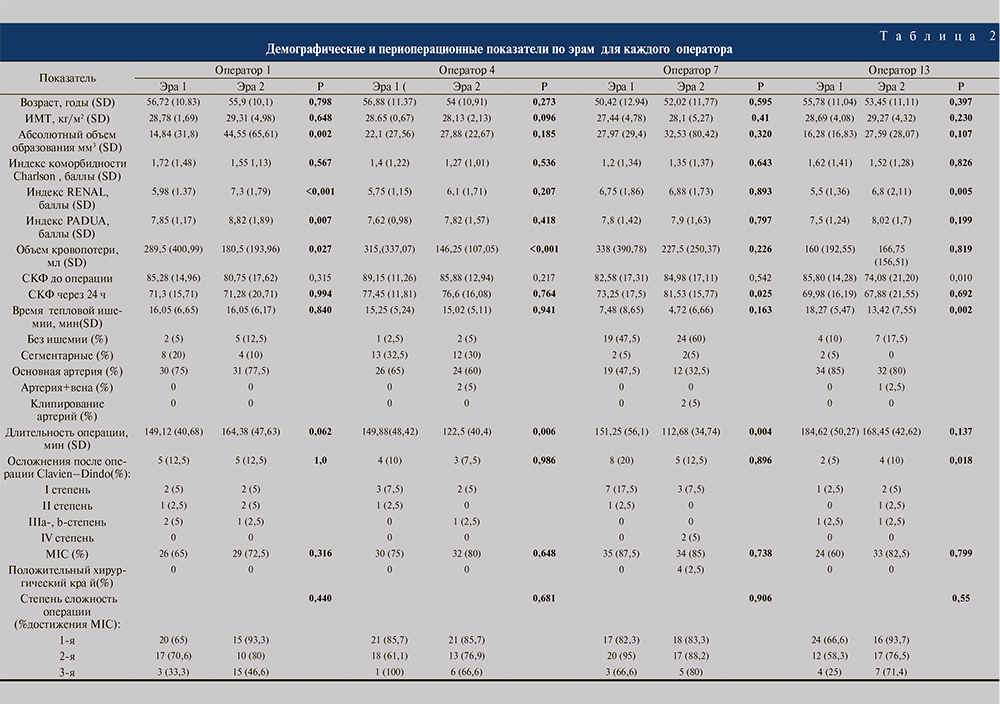
Результаты. Показатель MIC достигнут в 243 (75,9%) наблюдениях. В эру 1 MIC был достигнут в 71,9% наблюдений, в эру 2 – в 80%. В эре 2 статистически значимо уменьшились длительность пособий (рис. 1), объем кровопотери (рис. 2) и время тепловой ишемии (рис. 3), несмотря на увеличение абсолютного объема образований паренхимы почки и значений нефрометрических индексов. Другие периоперационные показатели по эрам представлены в табл. 1.
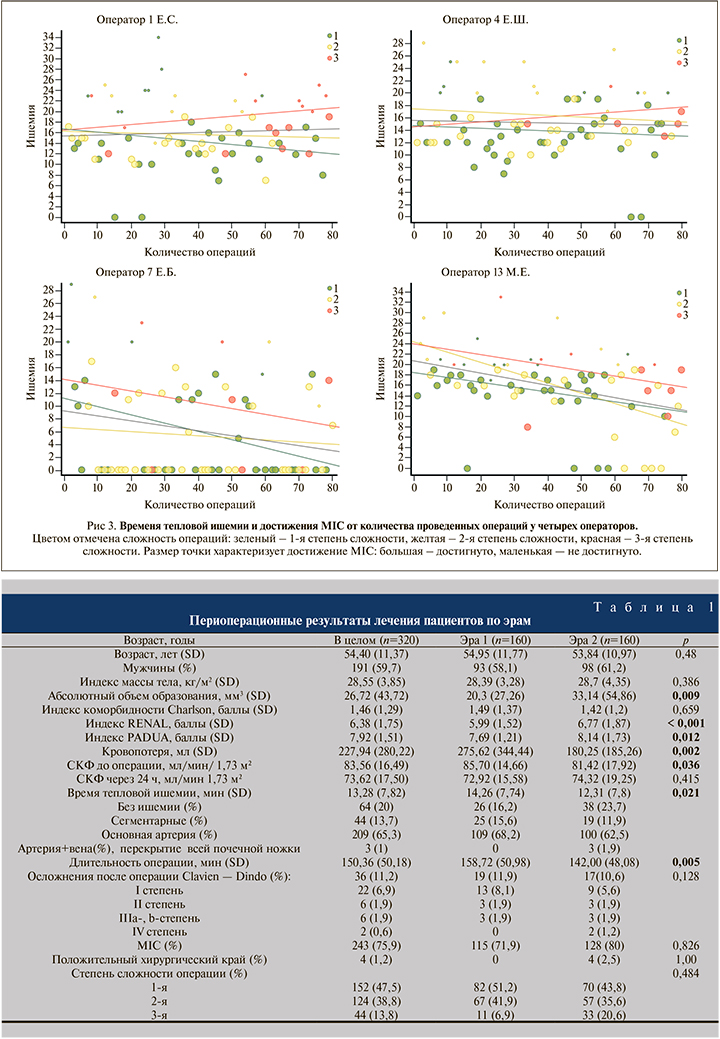
При сравнительном анализе периоперационных результатов ЛРП по эрам три хирурга увеличили частоту достижения показателя МIC: хирург 1 – с 65 до 72,5%, хирург 4 – с 75 до 80%, хирург 13 – с 60 до 82,5%. У оператора 7 Е.Б. во всех случаях показатель MIC был выше 80%, при этом в эру 2 он чуть снизился, составив 85 против 87,5% в эру 1 (табл. 2).
Дискриминантный анализа с использованием метода принудительного включения выявил значимые параметры в определении MIC для каждого пациента (табл. 3).
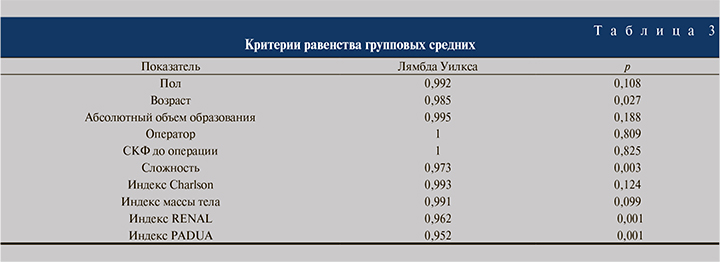
Наиболее значимые параметры в определении MIC на основании критерия равенства групповых средних следующие: возраст (р=0,027), сложность (р=0,003), индексы RENAL и PADUA (р˃0,001).
Обсуждение. В настоящее время ОСО являются основной опцией оперативного лечения пациентов с локализованным ПКР [21]. Данный факт связан с тем, что ОСО позволяют достигать лучших функциональных и онкологических результатов при низком уровне летальности по сравнению с органоуносящими пособиями [22].
Согласно клиническим рекомендациям, для выполнения ОСО используются три вида оперативных доступов: открытый, лапароскопический и робот-ассистированный [1–3]. Число оперативных вмешательств, которое требуется для достижения навыка проведения ОСО, различается в зависимости от доступа. В медицине для обозначения промежутка времени, необходимого для освоения методики лечения, используется понятие «кривая обучения»[23]. Из трех оперативных доступов при выполнении ОСО самая длинная кривая обучения у ЛРП [17, 24].
Для оценки кривой обучения применяются различные показатели, связанные как с самой операцией (длительность пособия, величина кровопотери и др.), так и с ее результатами (функциональные, онкологические). В нашем исследовании для анализа кривой обучения мы использовали показатель MIC. Выбор в пользу МIC обусловлен тем, что данный показатель характеризует краткосрочные результаты ОСО [13, 25].
По итогам нашей работы показатель МIC всех хирургов в эру 1 после выполнения 40 операций достигнут в 71,9% наблюдений, при этом необходимо отметить, что начальный опыт различного вида лапароскопических операций у всех 4 операторов был не менее 30 вмешательств. В эру 2 средний показатель МIC достигнут в 80% наблюдений, при этом каждый хирург провел 80 ЛРП. Результаты нашего исследования отличаются от данных работы F. Porpiglia et al. [25], согласно которым для достижения МIC ≥80% необходимо выполнить не менее 150 ЛРП.
Однако в нашем исследовании оценивалась кривая обучения четырех хирургов, тогда как F. Porpiglia et al. [25] анализировали кривую обучения одного оператора. Тем не менее, если в нашем исследовании анализировать кривую обучения каждого хирурга по отдельности, только 3 хирурга в эре 2 достигли МIC ≥80%, у одного оператора (1Е.С.) в эру 2 МIC достигнут в 72,5% наблюдений. При анализе вероятных причин такого результата установлено, что оператор 1Е.С. в эру 2 выполнил больше всего операций 3-й степени сложности – 15 вмешательств, при этом у других операторов наблюдений 3-й степени сложности было не больше 7. Также среднее значение индекса PADUA оператора 1Е.С., 8,82±1,89 балла, было выше среднего показателя индекса PADUA, 8,14±1,73 балла, всех наблюдений операторов в эру 2. Данное обстоятельство свидетельствует о том, что при повышении нефрометрической оценки сложности образований почки снижается количество наблюдений с уровнем МIC ≥80%. Это было подтверждено данными дискриминантного анализа, по результатам которого значимыми параметрами в достижении MIC были сложность (р=0,003), индекс RENAL и индекс PADUA (р˃0,001), что согласуется с результатами работы [25], в соответствии с которым степень сложности по индексу PADUA обратно пропорционально коррелирует с достижением MIC (р=0,001).
При оценке влияния степени сложности на три составляющих показателя МIC в наблюдениях оператора 1Е.С. было установлено, что у пациентов с 3-й степенью сложности МIC не был достигнут за счет времени тепловой ишемии >20 мин, при этом не было установлено осложнений выше IIIа-степени по шкале Clavien–Dindo) и наличия положительного хирургического края. Анализ кривой обучения хирурга 7Е.Б. показал, что более 50% ОСО оператор выполнил без создания тепловой ишемии, в результате чего достиг лучших значений МIC – 87 и 85% в эру 1 и эру 2 соответственно. Однако при оценке других показателей кривой обучения хирурга 7Е.Б. в 4 наблюдениях установлен положительный хирургический край, у 2 пациентов были осложнения IV степени по шкале Clavien–Dindo, чего не было зафиксировано ни у одного оператора.
Таким образом, по нашему мнению, проведение ОСО с нулевой ишемией, несомненно, является полезной техникой при выполнении ОСО и позволяет достигать лучших функциональных результатов. Однако при любой ОСО необходимо добиваться полного удаления образования паренхимы почки, поэтому нулевую ишемию следует использовать при более прецизионном предоперационном планировании, строгом соблюдении техники выполнения резекции и при кривой обучения не менее 80 ОСО.
Несмотря на то что нами определено, что количество ЛРП, необходимое для достижения MIC ≥70%, должно быть не менее 40, нельзя не принимать во внимание и тот факт, что хирурги в означенный период времени выполняли и другие вмешательства из лапароскопического доступа, поэтому более точно определить число ОСО, необходимое для достижения мастерства, сложно. Вероятно, выполнение полного спектра оперативных вмешательств из лапароскопического доступа улучшает мануальные навыки и уменьшает кривую обучения [26, 27]. Также мы согласны с H. Abboudi et al. [24] в том, что в настоящее время необходимо выделять и разграничивать два понятия: кривая обучения и кривая освоения новой оперативной техники, так как хирурги используют для оперативного лечения заболеваний различные доступы и методики выполнения оперативных вмешательств.
Наше исследование имело некоторые ограничения. Несмотря на то что мы проанализировали кривую обучения ЛРП четырех хирургов, работа выполнялась ретроспективно в одном учреждении. Также все хирурги имели опыт выполнения резекций почки из открытого доступа, а три оператора (4Е.Ш., 7Е.Б., 13М.Е.) в означенный период времени выполняли операции из робот-асситированного доступа, что, вероятнее всего, могло стать положительным фактором в достижении показателя MIC.
Заключение. Показатель MIC у всех хирургов с приобретением навыков выполнения ЛРП увеличивается, однако был более низким при увеличении степени сложности операций. Минимальное чиссло ЛРП, требуемое для достижения показателя MIC ≥70%, должно быть не менее 40.



