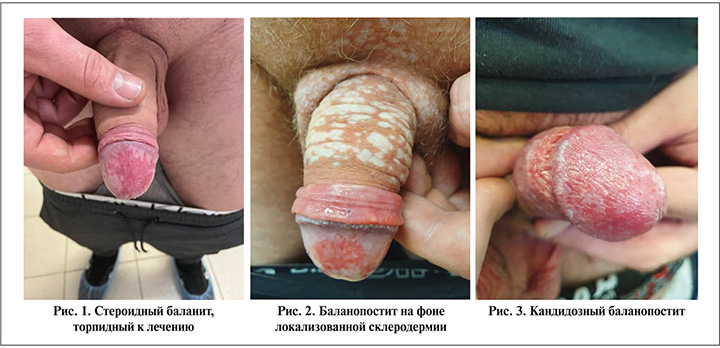
Баланопостит (БП) – распространенное самостоятельное заболевание кожи полового члена, характеризующееся поражением головки и внутреннего листка крайней плоти. Воспалительный процесс, возникающий на головке полового члена, называется баланитом (рис. 1); воспаление, локализующееся только на крайней плоти, называется поститом, а одновременное проявление патологического процесса в указанных областях называется БП (рис. 2) [1]. Установлено, что БП может быть ассоциирован с различными заболеваниями: инфекционными (бактериальными, грибковыми, вирусными), воспалительными или аллергическими дерматозами, травмами (физическими, химическими), аутоиммунными, онкологическими процессами, а также фиксированной эритемой, связанной с приемом лекарственных средств (тетрациклины, салицилаты, фенацетин, фенолфталеин и некоторые снотворные препараты) [2].
Эпидемиология
Распространенность БП в различных регионах мира зависит от весьма разнообразных факторов, включая уровень жизни, гигиеническую культуру населения, религиозные, этнические и другие особенности. Заболевание возникает как у детей, так и у взрослых мужчин. При этом частота выявления баланита составляет 4% у детей, 11–13% у взрослых мужчин без обрезания и 2% у взрослых мужчин с обрезанием крайней плоти в анамнезе [3, 4]. У мальчиков БП чаще всего наблюдается в возрасте от 2 до 5 лет, что, вероятно, связано с физиологическим фимозом и ненадлежащей гигиеной наружных половых органов. У взрослых необрезанных мужчин с сахарным диабетом риск развития БП самый высокий и составляет около 35% [5, 6].
Мета-анализ научных исследований свидетельствует, что обрезание крайней плоти может снижать распространенность воспалительных заболеваний кожи головки полового члена у мужчин на 68% [7].
Этиология
Наиболее частой причиной БП является недостаточная (или, наоборот, чрезмерная) интимная гигиена, обычно приводящая к неспецифическому БП. Также БП может развиваться при воспалительных и аллергических заболеваниях кожи, различных инфекциях, травматизации и онкологических заболеваниях [1–8]. Инфекционные агенты способны вызывать патологический процесс головки полового члена и кожи крайней плоти как при наличии предрасполагающих факторов, так и самостоятельно. В препуциальном пространстве вследствие повышенной температуры и влажности, щелочного значения рН, обусловленного экскрецией кожных желез и разлагающейся смегмой (физиологический секрет сальных желез половых органов), создаются благоприятные условия для размножения аэробных и анаэробных микроорганизмов и вирусов. Кандидозная инфекция как этиологический фактор БП (рис. 3) часто возникает у детей и может быть связана с опрелостями [2].
К другим инфекционным агентам относятся аэробные бактерии, такие как золотистый стафилококк и стрептококк группы А, анаэробные бактерии и вирусы (вирус простого герпеса, вирус папилломы человека) (рис. 4–5).
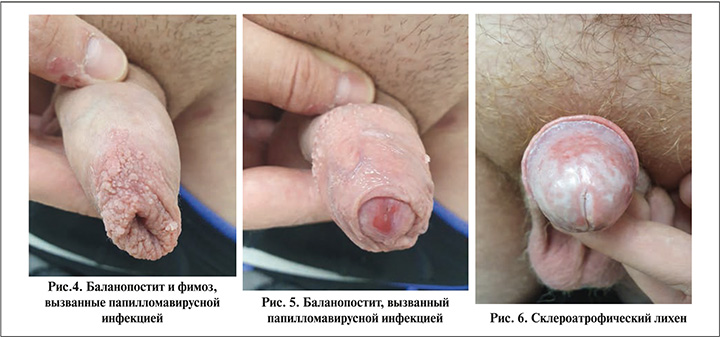
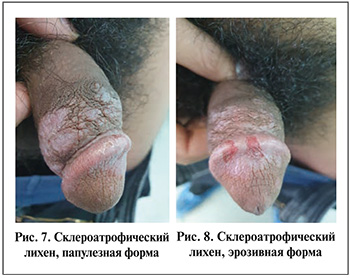
Некоторые воспалительные заболевания кожи, такие как контактный ирритантный или аллергический дерматит, склероатрофический лихен (рис. 5–8), также могут приводить к развитию БП [8]. Основные состояния, приводящие к развитию БП, перечислены в табл. 1 [9].

Патофизиология
Патофизиологические процессы широко варьируются в зависимости от этиологии и могут быть аллергическими, инфекционными, аутоиммунно-опосредованными и вторичными вследствие травмы или онкологического процесса [1–9].
В большинстве случаев БП начинается с того, что влажная среда, воздействие мочи и смегмы, уретральных выделений, вагинального секрета (после незащищенного полового контакта) способствуют формированию благоприятной среды для бактерий, вирусов и грибов [8, 9]. Активизация действия указанных факторов может происходить при наличии фимоза, избыточной крайней плоти, при несоблюдении правил личной гигиены, а также у пациентов с эндокринными нарушениями (сахарным диабетом, гипотиреозом, микседемой) и в пожилом возрасте [5, 6].
БП может быть спровоцирован внешними раздражителями и аллергенами, вызывающими неспецифическое воспаление, приводящее к появлению эритемы, отека, зуда, жжения и диспареунии [10].
Особенности микробиома при баланопостите
В состав нормальной микрофлоры препуциального пространства входит ограниченное число микроорганизмов: Staphylococcus spp., Propionibacterium acnes, Bacterioides melanogenicus и редко Proteus mirabilis. В настоящее время научные исследования установили, что состав бактериального сообщества кожи полового члена весьма разнообразен и может зависеть от обрезания ранее крайней плоти и вагинального статуса сексуальной партнерши у моногамных пациентов [11–13]. Например, после циркумцизии наблюдается значительное уменьшение количества семейств анаэробных бактерий, особенно семейств Clostridiales и Prevotellaceae [12, 14, 15].
На микробиом кожи мужских половых органов могут влиять целостность эпидермального барьера, воспаление, антимикробные пептиды [16, 17].
Как правило, пациенты имели более высокие риски заражения инфекциями, передаваемыми половым путем (ИППП). На некоторые бактерии влияли образ жизни пациента и его сексуальные практики, например, Staphylococcus warneri обнаруживался в изобилии у пациентов с БП при использовании презервативов, а Prevotella bivia выявлялась у пациентов с БП без сексуальной активности [17].
Учитывая, что избыточное количество крайней плоти является одной из ведущих клинических причин БП, гипергидратация кожи может не только нарушать ультраструктуру ее рогового слоя, но и способствовать росту различных условно-патогенных микроорганизмов [18].
Научное исследование установило, что Staphylococcus warneri и Prevotella bivia являются основными видами, ассоциированными с БП, которые более распространены у пациентов с высокой тяжестью течения заболевания. Staphylococcus warneri – коагулазонегативный патоген, который может адгезировать, проникать в эпителиальные клетки человека, образуя биопленку, и разрушать клетки своими внеклеточными токсинами [19].
Таким образом, состав микробиома при БП может быть связан с клиническими симптомами, длиной крайней плоти, состоянием кожного барьера и поведенческими факторами. Staphylococcus warneri и Prevotella bivia выявлялись преимущественно при БП, но их патогенная роль остается неопределенной в настоящее время [11].
Отдельное внимание следует уделить связи Gardnerella vaginalis с поражением половой системы у мужчин.
G. vaginalis – грамвариабильная бактерия, известная как этиологический фактор бактериального вагиноза (БВ) у женщин [20–22].
Некоторые авторы относят G. vaginalis к возбудителям ИППП, при которых партнеры-мужчины являются бессимптомными носителями. По их мнению, G. vaginalis может быть возбудителем инфекций мочеполовой системы у мужчин и в редких случаях приводить к симптомам БП, уретрита, цистита и простатита [22–25].
Распространенность G. vaginalis как возбудителя в мужском урогенитальном тракте до конца не изучена [22, 26, 27]. Научные исследования свидетельствуют, что у 7,2–11,4% мужчин были выявлены положительные результаты лабораторного обследования на наличие G. vaginalis, однако большинство этих клинических наблюдений протекали бессимптомно [23, 24].
Важно отметить, что особенности строения и физиологии мужского мочеиспускательного канала и предстательной железы являются неподходящими условиями для существования и размножения G. vaginalis. Кроме того, высокий уровень цинка в ткани предстательной железы затрудняет адгезию G. vaginalis. Тем не менее отмечены клинические наблюдения, когда G. vaginalis была инфекционным агентом при заболеваниях мочеполовой системы у мужчин, таких как БП, уретрит и единичные случаи цистита [22].
В большинстве таких зарегистрированных клинических наблюдений у пациентов отмечаются выделения из уретры с характерным «рыбным запахом», дизурия, учащенное мочеиспускание и гематурия [24]. Поскольку мужской урогенитальный тракт не является идеальной средой обитания для G. vaginalis, можно предположить, что клинические симптомы у мужчин могут возникать в условиях высокой микробной нагрузки условно-патогенными возбудителями [22].
Таким образом, в настоящее время отсутствуют достоверные научные исследования, позволяющие отнести G. vaginalis к этиологическим факторам БП у мужчин. Однако следует учитывать, что БП может иметь полимикробную и синергическую этиологию с участием G. vaginalis и анаэробных бактерий, при этом клинические проявления могут быть аналогичнымим таковым при БВ у женщин.
Клинические проявления
Характер клинических проявлений заболевания в каждом конкретном случае зависит от вида повреждающего агента (инфекционного или неинфекционного) и наличия предрасполагающих факторов (сахарный диабет, избыточная крайняя плоть и др.). БП может сопровождаться дискомфортными и болезненными ощущениями, зудом, выделениями из уретры, эритемой и сыпью. Как правило, БП проявляется только у необрезанных мальчиков и мужчин. Заболевание более часто выявляется у пациентов при несоблюдении правил интимной гигиены [1–10].
В зависимости от этиологии заболевания БП может протекать с формированием фимоза или без него, а также с рубцеванием крайней плоти, невозможностью опорожнения мочевого пузыря, эрозиями и кожной сыпью [10].
Диагностика
Диагностические критерии этого относительно распространенного заболевания остаются расплывчатыми и зависят главным образом от клинических проявлений. Требуется исключение ИППП наряду со специфическими воспалительными и неопластическими заболеваниями кожи мужских половых органов [11].
В большинстве случаев для установления диагноза и определения курса лечения достаточно тщательного сбора анамнеза и физикального обследования пациента. Важно оценить продолжительность симптомов, гигиенические привычки, воздействие инфекций, потенциальные аллергены и сексуальные практики. Обследование должно быть сосредоточено на обнаружении выделений из мочеиспускательного канала, симптомов задержки мочи, эритемы, отека, болезненности, рубцевания, а также пахового лимфаденита [10].
При подозрении у пациента наличия ИППП следует рекомендовать комплексное лабораторное обследование – бактериальный посев и соскоб из уретры (методом амплификации нуклеиновых кислот) с целью выявления патогенных микроорганизмов (например, трихомонадная, гонококковая, хламидийная инфекции и др.). Помимо этого может быть показан бактериальный посев на бета-гемолитический стрептококк группы А [10].
В случаях БП кандидозной этиологии может потребоваться обследование на наличие инсулинорезистентности, поскольку это может быть первым признаком сахарного диабета [5]. Данные микроскопического и культурального исследований позволяют установить правильный диагноз.
Пациентам с рецидивирующими или торпидными к лечению симптомами БП через 4 недели может потребоваться гистологического исследование патологических участков кожи (биопсия) для определения этиологии и подбора соответствующего лечения. Основной целью гистологического исследования является подтверждение особого типа БП, такого как цирцинарный баланит и плазмоклеточный баланит (баланопостит Зуна), а также исключение предраковых состояний кожи головки полового члена [2].
Лечение
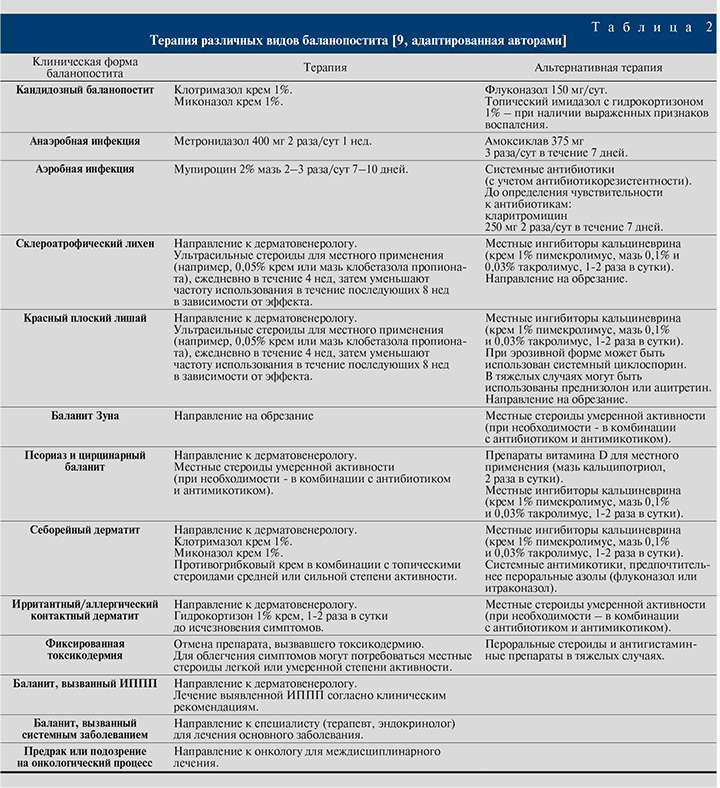
Терапия различных видов БП приведена в табл. 2 [9]. Рефрактерные к терапии случаи БП могут представлять собой онкологические или предраковые поражения, включая облитерирующий ксеротический баланит или плоскоклеточный рак [28, 29]. Клиницисты могут пропустить их без выполнения гистологического исследования [30]. Для установления гистологического диагноза необходимо обрезание или клиновидная биопсия пораженного участка длиной 1 см [29]. Это может потребовать реконструктивной хирургии, лучевого облучения и химиотерапии в зависимости от стадии заболевания.
Из-за ограниченного числа случаев симптоматической инфекции G. vaginalis у мужчин научные исследования и публикации по лечению практически отсутствуют. У женщин с БВ предпочтительно использовать в лечении местные формы метронидазола или клиндамицина [9]. Однако у мужчин, страдающих простатитом, вызванным G. vaginalis, лечение должно включать применение системных антибиотиков, хорошо проникающих в ткань предстательной железы. Недавние обзоры научной литературы свидетельствуют о том, что мужчин с симптомами уретрита или простатита, вызванных G. vaginalis, следует лечить с использованием метронидазола или тинидазола [22].
Профилактика
БП можно предотвратить, установив надлежащие гигиенические привычки. Для ежедневного очищения интимной области необходимо использовать синдетные или рН-нейтральные средства, а также обращать внимание на малое количество ингредиентов, отсутствие парабенов, отдушек и красителей в моющих средствах. Следует избегать использования мыла. В некоторых случаях допустимо очищение наружных половых органов водой без использования моющих средств.
Еще одним достоверным способом профилактики БП является обрезание (циркумцизия). Хотя существуют разногласия относительно рекомендаций по обрезанию новорожденных, исследования свидетельствуют, что это сокращает заболеваемость дерматозами полового члена (инфекционными, аллергическими, ирритантными), инфекциями мочевыводящих путей, раком полового члена и даже ИППП, такими как ВИЧ-инфекция и сифилис [29, 31].
Существуют противоречивые научные сведения относительно того, предотвращает ли обрезание крайней плоти возникновение баланита (по сравнению с необрезанными пациентами) [31, 32]. Однако данные мета-анализа свидетельствуют, что воспалительные заболевания кожи головки полового члена в 3,1 раза чаще встречаются у необрезанных мужчин [33].
Важно отметить, что отказ пациента от рискованного сексуального поведения позволяет предотвращать развитие БП и снижать риск возникновения ИППП, таких как сифилис, простой герпес, инфекции, вызванные вирусом папилломы человека и др.
Заключение
Баланопостит – полиэтиологическое заболевание. Важно помнить, что БП может иметь полимикробную и синергическую этиологию с участием G. vaginalis и анаэробных бактерий в урогенитальном тракте. Большинство пациентов без четкой инфекционной этиологии отреагируют на изменения в гигиене и эмпирическую терапию смягчающими средствами в течение одной-двух недель. Однако примерно у каждого десятого из этих пациентов симптомы рецидивируют, требуя дальнейшей оценки и более целенаправленного лечения.
Пациенты с рецидивирующими или торпидными к лечению симптомами БП, с сопутствующим патологическим фимозом или обструкцией мочевыводящих путей должны быть направлены к врачу-урологу. Иногда для верификации БП может потребоваться биопсия патологических участков на коже головки полового члена с последующим гистологическим исследованием.



