Нейрогенной дисфункцией нижних мочевыводящих путей страдают, по данным разных авторов, от 50 до 96% больных рассеянным склерозом (РС) [1–3]. Наиболее распространенными симптомами являются учащенное мочеиспускание (32–99%), наличие ургентных позывов (32–85%) и ургентное недержание мочи (19–80%) [3, 4]. Реже (2–20%) встречаются затрудненное мочеиспускание и хроническая задержка мочи [2–4].
В соответствии с Международными стандартами для диагностики нарушений мочеиспускания в отношении неврологических больных используется комплексное уродинамическое исследование (КУДИ). Согласно клиническим рекомендациям Европейской ассоциации урологов, пациентам с нейрогенной дисфункцией нижних мочевыводящих путей уродинамическое исследование должно выполняться 1 раз в 2 года в отсутствие гиперактивности детрузора и 1 раз в год при наличии гиперактивности или сниженной комплаентности мочевого пузыря. Учитывая инвазивность, а также малую доступность КУДИ в рутинной клинической практике, поиск биологических маркеров нейрогенного мочевого пузыря является актуальной задачей. Возможно, новые биомаркеры позволят судить о тяжести состояния и выявлять пациентов, наиболее нуждающихся в выполнении КУДИ, прогнозировать течение заболевания, оценивать эффективность лечения в динамике.

В качестве маркеров гиперактивности детрузора были изучены биологически активные вещества разных групп: простагландины мочи (простагландин E2), цитокины (моноцитарный хемотаксический фактор-1, фактор некроза опухоли CD40L), C-реактивный протеин, ATФ мочи [5, 6]. Одними из наиболее перспективных биомаркеров являются нейротрофины. Это регуляторные белки, которые синтезируются в клетках нервной и других тканей. Нейротрофины действуют локально в месте высвобождения и особенно интенсивно индуцируют ветвление дендритов и рост аксонов в направлении клеток-мишеней, обеспечивая пластичность нервной ткани и формируя механизмы, участвующие в восстановлении нарушенных неврологических функций. В ряде работ продемонстрировано повышение уровня фактора роста нервов (nerve growth factor, NGF) и нейротрофического фактора головного мозга (brain-derived neurotrophic factor, BDNF) у пациентов с идиопатической гиперактивностью детрузора [7–9] и его снижение на фоне лечения [10, 11]. Неисследованным остается вопрос клинической значимости нейротрофинов в диагностике гиперактивности детрузора у пациентов с нейрогенным мочевым пузырем при различных вариантах неврологической патологии.
Цель исследования: оценить чувствительность, специфичность и установить диагностические титры NGF и BDNF в крови и моче больных РС в качестве маркеров гиперактивности детрузора.
Материалы и методы. В исследование вошли 20 больных РС (16 женщин и 4 мужчины) в возрасте от 28 до 60 лет (средний возраст – 43,35±9,21 года), предъявивших жалобы на проблемы с мочеиспусканием. Контрольную группу составили 20 пациентов (14 женщин и 6 мужчин) в возрасте 20–72 лет (средний возраст – 38,35±17,19 года), находившихся в клинике урологии СОКБ № 1 по поводу заболеваний, не сопровождавшихся гиперактивностью детрузора мочевого пузыря. Критерии исключения из исследования для пациентов с РС: тяжесть основного заболевания, затруднявшая проведение КУДИ и цистоскопии; отказ пациента от выполнения инвазивных вмешательств, наличие гиперплазии предстательной железы или стриктуры уретры у мужчин, суммарный балл по шкале EDSS (Expanded Disability Status Scale – расширенная шкала оценки степени инвалидизации) выше 5. В контрольную группу не вошли пациенты с признаками инфравезикальной обструкции, лейкоцитурией и клиническими симптомами воспаления нижних мочевыводящих путей.
Все пациенты дали добровольное информированное согласие на проведение диагностических манипуляций, забор крови и мочи для исследования. Дизайн исследования одобрен локальным этическим комитетом ГБУЗ СО СОКБ № 1.
Пациентам основной и контрольной групп предлагалось заполнить анкеты-опросники (опросник гиперактивности мочевого пузыря, опросник качества жизни SF-36), в течение 3 суток вести дневник мочеиспускания. Всем пациентам выполнены лабораторное обследование, УЗИ мочевыводящих путей с определением объема остаточной мочи, КУДИ, уретроцистоскопия с щипковой биопсией мочевого пузыря.
Проведены общеклинические анализы крови и мочи, а также количественное определение в крови и моче методом иммуноферментного анализа NGF и BDNF.
Комплексное уродинамическое исследование выполнено с использованием уродинамической системы Triton («Laborie medical technologies») в соответствии с требованиями Международного общества по удержанию мочи и включило ретроградную водную цистометрию медленного наполнения (25 мл/мин) в положении сидя, исследование «давление–поток», профилометрию уретры, электромиографию мышц тазового дна.
Статистическую обработку данных осуществляли с помощью программного пакета SPSS 14.0 for Windows. Диагностическая значимость лабораторных тестов определялась по данным ROC-анализа. Для определения эффективности теста использовали показатель AUC (Area Under Curve).
Результаты. Из 20 больных РС 17 (85%) предъявили жалобы на учащенное мочеиспускание и наличие ургентных позывов на мочеиспускание, сопровождавшихся у 15 (75%) ургентным недержанием мочи.
У всех больных РС, имевших симптомы ургентности, наличие гиперактивности детрузора было подтверждено в ходе КУДИ. Они имели большую частоту дневных и ночных мочеиспусканий и меньший объем мочи за одно мочеиспускание. Функциональная емкость мочевого пузыря у этих пациентов была снижена до 233±30 мл. При этом спонтанное непроизвольное сокращение мочевого пузыря у некоторых пациентов начиналось уже при наполнении мочевого пузыря до 20 мл. Средний объем мочевого пузыря при возникновении эпизода гиперактивности составил 117±28 мл.

Количественная оценка содержания в крови и моче пациентов нейротрофинов показала, что уровень NGF в моче и крови пациентов с РС выше, чем в контрольной группе (табл. 1).
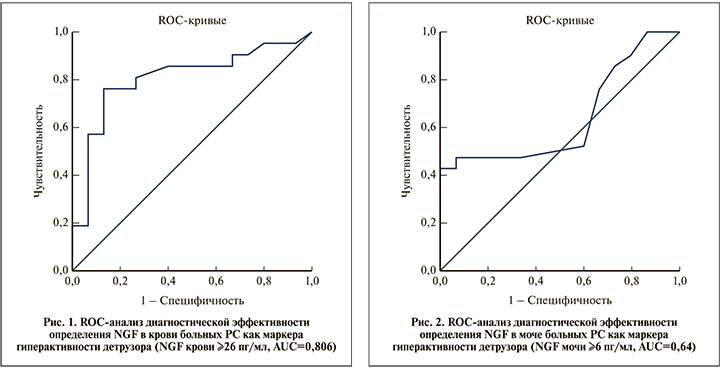
По данным ROC-анализа чувствительность определения NGF в крови в качестве маркера гиперактивности детрузора (для NGF сыворотки ≥26 пг/мл) составила 57%, специфичность – 93% (рис. 1). Качество теста по экспертной шкале для значений AUC «очень хорошее» (AUC=0,806).
Определение NGF в моче больных оказалось менее эффективным (рис. 2). Чувствительность равнялась 52%, специфичность – 40% (для NGF ≥6 пг/мл). Качество теста по экспертной шкале для значений AUC «среднее» (AUC=0,64).
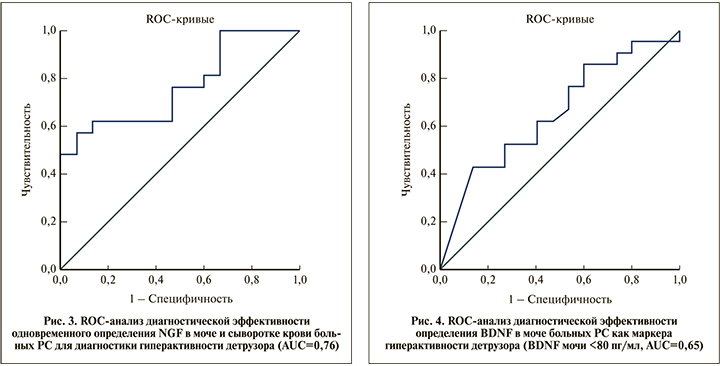
Одновременное исследование NGF в крови и моче (рис. 3) имело такую же чувствительность (57%), как и отдельное определение сывороточного NGF при более низкой специфичности, равной 86,7%. Качество теста по экспертной шкале для значений AUC «хорошее» (AUC=0,76).
Высокую чувствительность (86%) в диагностике гиперактивности детрузора продемонстрировал BDNF в моче пациентов (BDNF мочи <80 пг/мл): чем ниже уровень BDNF, тем больше вероятность наличия гиперактивности. При этом специфичность оказалась низкой – 26%. Качество теста по экспертной шкале для значений AUC «среднее», (AUC=0,65; рис. 4).
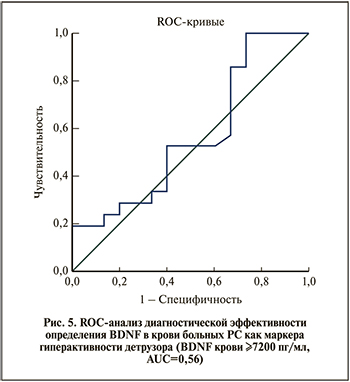 Менее эффективным оказалось определение BDNF в сыворотке крови (рис. 5): качество теста «неудовлетворительное» (AUC=0,56). Для BDNF крови ≥7200 пг/мл чувствительность достигала 90%, но специфичность составляла также всего 26%.
Менее эффективным оказалось определение BDNF в сыворотке крови (рис. 5): качество теста «неудовлетворительное» (AUC=0,56). Для BDNF крови ≥7200 пг/мл чувствительность достигала 90%, но специфичность составляла также всего 26%.
Совместное определение BDNF мочи и сыворотки крови позволяет повысить специфичность теста до 53% при сохраняющейся высокой чувствительности (81%). Качество теста по экспертной шкале для значений AUC «хорошее» (AUC=0,702).
Клиническая значимость определения NGF и BDNF в моче и крови в различных комбинациях представлена в табл. 2.
Наибольший показатель AUC (0,844) имеет ROC-кривая совместного определения всех четырех показателей.
Корреляции между уровнем нейротрофинов и выраженностью неврологических нарушений по шкале EDSS, а также тяжестью симптомов со стороны нижних мочевыводящих путей выявлено не было. Уровень биомаркеров также не коррелировал с цистометрическими параметрами – минимальным объемом мочевого пузыря, при котором возникает гиперактивность детрузора, и давлением детрузора в момент непроизвольного сокращения.
Обсуждение. Роль нейротрофинов в качестве потенциальных биомаркеров гиперактивного мочевого пузыря активно изучается в последние годы [7–11]. Повышенный уровень NGF и BDNF отмечается в моче и крови пациентов с гиперактивным мочевым пузырем и имеет тенденцию к снижению на фоне лечения антимускариновыми препаратами или ботулотоксином [10, 11]. В исследовании A. Giannantoni et al. [12] было показано, что инъекции ботулинического токсина в стенку мочевого пузыря уменьшают уровень NGF в тканях и усиливают экспрессию рецепторов к NGF.
Нами не встречено работ, посвященных исследованию нейротрофинов в качестве маркеров нейрогенного мочевого пузыря у пациентов с РС.
Рассеянный склероз – хроническое демиелинизирующее заболевание ЦНС, в основе которого лежат сложные иммунопатологические механизмы, приводящие к нейродегенеративному повреждению с гибелью аксонов. Параллельно с демиелинизацией при PC наблюдаются и процессы регенерации, в частности восстановление миелина. Предполагается, что макрофагами, микроглией или другими клетками синтезируются нейротрофины, влияющие на процесс пролиферации и дифференцировки олигодендроцитов и, следовательно, процесс ремиелинизации [13]. Наиболее изученным из семейства нейротрофинов является NGF. Он влияет на рост аксонов и поддержание синаптических связей в нейронах головного и спинного мозга, клеток спинальных ганглиев и постганглионарных вегетативных нейронов. Кроме того, NGF может быть вовлечен в нейроиммунные взаимодействия и внутритканевое воспаление при РС [14].
В литературе имеются лишь единичные сообщения об изучении уровня сывороточного NGF при PC. Исследователями показано как значительное повышение содержания NGF в спинномозговой жидкости больных PC при обострении заболевания по сравнению с заметным снижением при ремиссии, так и его отсутствие [15, 16]. Продемонстрировано образование аутоантител к NGF у пациентов с РС [16].
ROC-анализ лабораторных показателей, полученных в ходе исследования, доказал, что у пациентов с РС повышенные уровни NGF и BDNF в крови и моче служат маркерами нейрогенной детрузорной гиперактивности.
Совместное определение нескольких маркеров предпочтительно и позволяет повысить диагностическую значимость теста. Самый высокий показатель AUC (0,844) демонстрирует ROC-кривая для совместного определения всех 4 показателей (NGF и BDNF в крови и моче). Определение нейротрофинов только в крови, незначительно уменьшая AUC (0,810), повышает чувствительность теста до 86,7% и позволяет снизить затраты не исследование. Удачной комбинацией также является сочетание NGF крови и BDNF мочи, демонстрирующее высокую чувствительность (85,7%) и очень хорошее качество теста (AUC=0,824).
Выводы
- Уровень NGF в крови пациентов с РС – высокоспецифичный маркер наличия или отсутствия гиперактивности детрузора: чувствительность – 57%, специфичность – 93% (p=0,002).
- Показатель BDNF в крови и моче больных РС – высокочувствительный маркер гиперактивности детрузора: чувствительность – 86–90%, специфичность – 26% (p=0,002).
- Совместное определение нейротрофинов в сыворотке крови больных РС повышает диагностическую значимость метода и обеспечивает чувствительность 66,7% при специфичности 86,7%. Дополнительное выявление уровня NGF и BDNF в моче пациентов экономически не целесообразно, так как не приводит к существенному повышению диагностической значимости теста.



