Введение. Хронический простатит/синдром хронической тазовой боли (ХП/СХТБ) – распространенное, но недостаточно изученное, плохо поддающееся лечению социально значимое заболевание у мужчин репродуктивного и трудоспособного возраста, доля которого среди всех урологических болезней составляет 9–11% [1]. Это самый распространенный урологический диагноз для мужчин моложе 50 лет, на долю которого приходится до 2 млн визитов к урологам в год [2].
Распространенность заболевания оценивается в 9–16% в зависимости от региона [3]. Синдром хронической тазовой боли отрицательно влияет на показатели сексуальной функции и значительно снижает качество жизни пациентов [4, 5].
Значительный спектр диагностических и терапевтических проблем, связанных с хроническим воспалением мужских половых путей, до сих пор остается предметом дискуссии [6]. Публикации в основном посвящены изучению бактериальных патогенов, в то время как у большинства больных ХП/СХТБ патогены не обнаруживают [7]. Относительно хорошо изучены заболевания, ассоциированные с бактериальными инфекциями: острый и хронический бактериальный простатит (категории I и II), доля которых не превышает 10% от всех случаев ХП/СХТБ. Признаки заболеваний этих категорий четко определены по клиническим и микробиологическим показателям, и антимикробная терапия, как правило, бывает успешной [8]. Остальные 90% случаев относятся к заболеваниям неясной этиологии, так как не сопровождаются бактериальными инфекциями мочевыводящих путей и считаются «абактериальными» ХП/СХТБ, не связанными с определенными микроорганизмами [9]. Несмотря на сравнительно большое количество работ, посвященных ХП/СХТБ, этиология «абактериального» ХП/СХТБ (категория III) изучена недостаточно [11, 12]. В связи с этим в настоящее время «золотого» стандарта диагностического теста и оптимального алгоритма лечения ХП/СХТБIII не существует [10–13]. Традиционным лечением ХП/СХТБ является так называемая 3А-терапия, включающая антибиотики, α-адреноблокаторы и противовоспалительные препараты. Такое лечение является терапией ХП/СХТБ 1-й линии ввиду удобства (каждый препарат принимают лишь 1 раз в день) и относительной эффективности [14]. Однако до 46% пациентов отмечает неудовлетворительные результаты лечения [15].
В то же время в органах репродуктивной системы человека нередко обнаруживают как ДНК-геномные, так и РНК-геномные вирусы, относящиеся к разным систематическим группам: вирус иммунодефицита человека (ВИЧ), цитомегаловирус (ЦМВ), вирус Эпштейна–Барр (ВЭБ), вирус простого герпеса (ВПГ), аденовирусы, папилломавирус, вирус герпеса человека (ВГЧ) 8-го типа [16]. Особое место занимают герпесвирусы человека (ГВЧ), широко распространенные в человеческой популяции, присутствие которых в разных отделах мужского урогенитального тракта показано при различных нарушениях мужского здоровья [17–19].
В последнее время все более пристальное внимание уделяется иммунологическим механизмам ХП/СХТБ, в том числе регуляторным факторам иммунитета – цитокинам. По данным ряда исследователей, нарушение цитокиногенеза у мужчин с воспалительными процессами в половых органах приводит к хронизации заболевания и возникновению осложнений [20–22]. Несколько исследований показали, что интерлейкины (ИЛ), такие как ИЛ-6, ИЛ-8, и цитокин ФНОα играют важную роль в воспалительном процессе органов урогенитального тракта [23, 24].
Цель настоящего исследования состояла в изучении трех ГВЧ в клиническом материале от пациентов с воспалительными заболеваниями урогенитального тракта и в оценке эффективности предложенной схемы лечения абактериального ХП/СХТБ.
Материалы и методы. Проведено открытое сравнительное исследование эффективности лечения абактериального ХП/СХТБ с учетом индивидуальных особенностей пациентов. Изучен биологический материал от мужчин (n=101), поступивших для обследования в ФГБУЗ КБ № 84 ФМБА России в 2018 г. Обследованные пациенты были в возрасте от 20 до 70 лет (средний возраст – 41,6±17,4 года). Продолжительность заболевания в среднем составила 6,8±6,7 года (от 1 года до 18 лет). Длительность симптомов на момент обращения варьировалась от 3 мес. до 1,8 года. У 5 пациентов имелись сопутствующие ИППП, в том числе трихомонадная и хламидийная инфекция.
Информированное согласие на выполнение обследования получено от каждого пациента. Процедуры исследования проводили в соответствии с Хельсинкской декларацией и были одобрены местным комитетом по биомедицинской этике в ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России.
В исследование включены пациентов с ХП/СХТБ без неврологических и желудочно-кишечных заболеваний, с нормальными показателями тревоги и депрессии (не более 7 баллов). В исследование не включали пациентов с миофасциальной болью и цисталгией. Патологические находки при МРТ пояснично-крестцового отдела позвоночника также служили препятствием для включения пациента в исследование. Набор пациентов в группы исследования проходил после исключения неврологических (вертебропатии, корешковый синдром, тазовая невропатия, миофасциальная боль и т.д.), гастроэнтерологических (колит, синдром раздраженного кишечника, прокталгия и др.), психосоматических (депрессия, тревога и т. д.) состояний. При наличии соответствовавших жалоб пациентов направляли к профильным специалистам.
При первом обращении пациенту проводили клиническое обследование, забор уретрального материала на инфекции, передаваемые половым путем (ИППП), и герпесвирусы, до- и постмассажную пробу мочи, секрет предстательной железы, УЗИ почек, трансректальное УЗИ предстательной железы и определение остаточной мочи. Пациентам старше 40 лет до пальцевого ректального исследования проведен забор крови на ПСА. Забор эякулята проведен на первом приеме вслед за постмассажной пробой либо по прошествии 1–3 дней. Пациентам, от которых при пальцевом массаже не удалось получить секрет предстательной железы, процедуру забора вместе с до- и постмассажной пробами мочи повторяли после 3–7-дневного полового воздержания. Пациентам с жалобами на затрудненное мочеиспускание проводили урофлоуметрию с определением максимальной и средней скорости потока мочи. Использовали весовой урофлоуметр Urocap III («Laborie», Канада).
Все пациенты заполнили Международный вопросник, разработанный в Национальном институте здоровья США, предназначенный для оценки симптомов ХП/СХТБ до и после лечения. Диагноз ХП/СХТБ верифицировали на основе клинических (боль в промежности, паху, мошонке, внизу живота, дизурические симптомы, болезненная при пальцевом ректальном исследовании предстательная железа, зачастую неравномерной консистенции и с асимметричными долями, сглаженная срединная борозда) анамнестических (продолжительность симптомов как минимум 12 недель из предыдущих 6 месяцев) и лабораторных (содержание лейкоцитов в секрете предстательной железы более 10 в поле зрения, при том что титр микроорганизмов в постмассажной пробе мочи не превышал его значения в домассажной) данных. Для определения категории заболевания, исключения бактериального простатита проведены микроскопическое и бактериологическое исследования 10 мл до- и постмассажной пробы мочи. Диагноз ХП/СХТБ категории III устанавливали в случаях, когда микроорганизмы в постмассажной пробе выявлялись в концентрации не большей, чем в порции мочи, взятой до массажа предстательной железы. На основании клинико-лабораторных данных у всех обследованных пациентов диагностирован ХП/СХТБ категории III.
Для определения тяжести течения ХП/СХТБ использован Индекс симптомов хронического простатита по версии Национального института здоровья США (National institute of health chronic prostatitis symptom index – NIH-CPSI) [25]. При суммарном балле 10–14 говорят о легкой степени, 15–29 – о средней, более 30 – о тяжелой; по сумме баллов по доменам «боль»+«мочеиспускание» менее 19 констатируют среднюю степень тяжести, 19 и более – тяжелое заболевание. По среднему значению суммарной оценки до лечения (18–19 баллов) пациенты, включенные в настоящее исследование, страдали заболеванием средней тяжести. Тяжесть течения ХП/СХТБ IIIA с ГВЧ и без них не различалась.
Изучены образцы эякулята, соскобы из уретры и сок простаты. Образцы эякулята получены путем мастурбации после 3-дневного полового воздержания. Образцы были использованы для экстракции ДНК с последующим выявлением вирусной ДНК. Соскоб уретры получали путем вращения урогенитального зонда, введенного в уретру на глубину 3–4 см. Далее зонд извлекали и вносили в пробирку с транспортной средой. Затем пациенту предлагали помочиться с высвобождением 150–200 мл мочи, из которых 10 мл отбирали в стерильный контейнер в качестве домассажной пробы. Забор секрета простаты производили с помощью пальцевого массажа железы в течение 1 мин сразу после мочеиспускания и удаления последней капли мочи из канала сухой стерильной салфеткой. После проведения массажа в стерильный контейнер брали 10 мл мочи в качестве постмассажной пробы, согласно J. C. Nickel [26]. Превышение содержания лейкоцитов (более 10 в поле зрения) выявлено у 92 пациентов (категория IIIа), у 9 пациентов показатели соответствовали категории IIIb.
Для детекции возбудителей инфекций бактериальной этиологии, передаваемых половым путем, методом ПЦР изучены возбудители N. gonorhoae, T. vaginalis, C. trachomatis и M. genitalium. Для обнаружения ГВЧ использован количественный вариант ПЦР в режиме «реального времени». Определена ДНК ГВЧ с помощью наборов реагентов для ПЦР «АмплиСенсEBV/CMV/HHV6-cкрин-FL» (ООО «ИнтерЛабСервис», Россия). Набор позволяет одновременно выявлять три ГВЧ: вирус Эпштейна–Барр (ВЭБ), ЦМВ и вирус герпеса человека 6-го типа (ВГЧ-6). β-глобиновый ген использовали в качестве эндогенного внутреннего контроля.
При выявлении ДНК ГВЧ (n=38, 1-я группа) провели следующую терапию: Виферон® суппозитории в дозе 1 млн МЕ 1 раз в день в течение 20 дней, диклофенак 50 мг, свечи, 10 дней (при уровне боли 4 и более), тамсулозин 0,4 мкг внутрь в течение 90 дней (при оценке по домену «мочеиспускание» 2 балла и более или при снижении максимального потока мочи ниже 15 мл/с).
Шестидесяти трем пациентам (2-я группа) проведена стандартная терапия по схеме левофлоксацин 500 мг внутрь 1 раз в сутки, курс 14–28 дней, тамсулозин 0,4 мкг внутрь в течение 90 дней (при оценке по домену «мочеиспускание» 2 балла и более или при снижении максимального потока мочи ниже 15 мл/с) и свечи диклофенак 50 мг 10 дней (при уровне боли 4 и более).
Для достижения цели исследования оценивали результаты лечения неинфицированных вирусами пациентов по стандартной схеме и инфицированных пациентов по схеме без антибиотиков, но включавшей иммунорегуляторный препарат Виферон®, выбор которого обусловлен наличием в его составе противовирусного цитокина – рекомбинантного человеческого интерферона α2b (IFN-α2b), а также аскорбиновой кислоты и токоферола в качестве антиоксидантов.
Пациентам с ИППП дополнительно назначена соответствующая терапия, согласно рекомендациям РОДВиКи CDC (США) [27, 28].
Для статистической обработки результатов использован пакет прикладных компьютерных программ STATISTICA 6,0 и BIOSTAT. Статистические различия анализировали, применив критерии Стьюдента, Манна–Уитни, Пирсона и χ2. Параметрические данные выражали в виде средних значений±ошибок средних значений, непараметрические – медианных значений и минимума-максимума. Различия показателей считали статистически значимыми при р<0,05.
Результаты. На основе клинико-лабораторных данных, согласно Международной классификации, у 92 пациентов диагностирован СХТБ категории IIIа, у 9 – IIIb. В дальнейшем этих 9 пациентов динамика содержания лейкоцитов, которую оценивали через 2 нед. после начала терапии, позволила перевести в группу IIIа, так как у всех выявили воспаление предстательной железы (лейкоциты более 10 в поле зрения).
Результаты анализа 67 образцов от 38 пациентов до и после лечения представлены в табл. 1. До лечения ГВЧ встречались суммарно в 46 образцах: в 9 (19,6%) образцах эякулята, в 19 (41,3%) образцах соскобов из уретры и в 18 (39,1%) образцах сока простаты (табл. 1). Цитомегаловирус и ВЭБ обнаружены в 12 и 14 образцах соответственно, включая образцы с сочетаниями двух ГВЧ. Значительно чаще встречался ВГЧ-6, суммарно в 24 (52%) из 46 образцов (см. табл. 1).
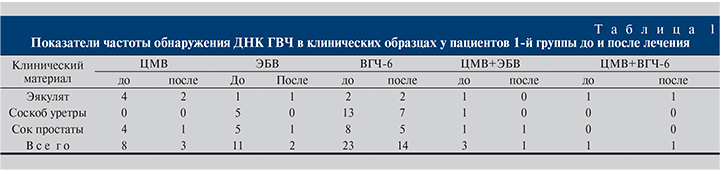
После лечения ДНК ГВЧ была обнаружена в 21 образце. Снижение количества положительных образцов отмечено в эякулятах – на 2 (22,2%) образца, в соскобе из уретры – на 7 (36,8%) образцов и в соке простаты – на 10 (55,5%) образцов. В целом количество инфицированных ГВЧ образцов после лечения снизилось на 54,3%.
Количественный анализ ДНК изученных ГВЧ выявил значительную вариабельность значений. Так, медианное значение концентрации ДНК ЦМВ составило 50 938 копий/мл, минимальное – 100 копий/мл, максимальное – 380 500 копий/мл. Для ДНК ВЭБ соответствовавшие значения составили 393,75, 100 и 1900 копий/мл, для ДНК ГВЧ-6 – 307 152, 100 и 3 703 900 копий/мл. У 8 (21%) пациентов в 22 образцах количество копий ГВЧ превышало 1000/мл. Из трех изученных материалов (эякулят, соскоб из уретры и сок простаты) максимальное значение было определено в соскобе из уретры и оказалось высоким – 3 703 900 копий/мл.
Вторую группу (сравнения) составили 63 пациента, у которых в урогенитальных образцах не обнаружена ДНК изученных герпесвирусов.
Терапевтическую эффективность оценивали с помощью шкалы NIH-CPSI, анализировали снижение индекса симптомов ХП/СХТБ.
Сравнительные результаты лечения пациентов двух групп представлены в табл. 2.

Статистическая обработка данных показала, что после лечения статистически значимо снижалась тяжесть симптомов в обеих группах по всем показателям (p<0,0001), снижение общей оценки по шкале NIH-CPSI в 1-й группе составило 9,3 балла и было больше, чем во 2-й группе, – 7,8 балла. Улучшение по всем клиническим признакам в 1-й группе произошло на 47,9% и было особенно выражено по признакам «боль+мочеиспускание» – на 52%. Важно, что положительный ответ на лечение, который характеризуется снижением общей оценки по шкале NIH-CPSI более чем на 6 баллов, отмечен у всех пациентов 1-й группы.
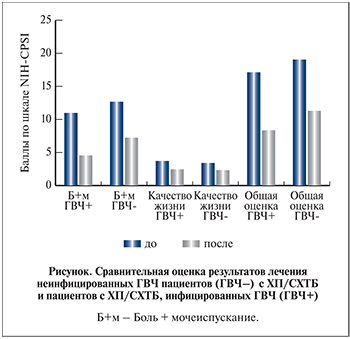 Представляли интерес результаты лечения пациентов с ХП/СХТБ, не инфицированных ГВЧ. Оценка индекса симптомов NIH-CPSI до и после лечения стандартным курсом показала (см. табл. 2 и рисунок), что общая оценка после лечения улучшилась 42,6%, что оказалось сопоставимо с результатом лечения в 1-й группе (p>0,05).
Представляли интерес результаты лечения пациентов с ХП/СХТБ, не инфицированных ГВЧ. Оценка индекса симптомов NIH-CPSI до и после лечения стандартным курсом показала (см. табл. 2 и рисунок), что общая оценка после лечения улучшилась 42,6%, что оказалось сопоставимо с результатом лечения в 1-й группе (p>0,05).
Обсуждение. В настоящем исследовании у 38 (37,6%) обследованных мужчин с ХП/СХТБ в урогенитальном тракте обнаружены ЦМВ, ВЭБ и ВГЧ-6. Представители семейства герпесвирусов широко распространены в человеческой популяции, пожизненно присутствуют в организме и у большинства иммунокомпетентных людей не вызывают клинически выраженных заболеваний. Однако большинством специалистов признается роль ГВЧ как возбудителей оппортунистических инфекций, вызывающих обострение и распространение других заболеваний человека, в том числе синдрома приобретенного иммунодефицита (ВИЧ/СПИД) [29]. При снижении показателей иммунитета реактивация ГВЧ может индуцировать тяжелые заболевания, нередко с летальным исходом. По результатам нашего исследования у пациентов с ХП/СХТБ в структуре выявленных вирусов значительно чаще, чем ЦМВ и ВЭБ, встречался ВГЧ-6, суммарно – в 24 (52%) из 46 образцов до лечения.
ВГЧ-6 впервые был выделен из мононуклеарных клеток периферической крови пациентов с лимфопролиферативными заболеваниями [30], он схож с другими ГВЧ по структуре вириона, но отличается от них по биологическим, иммунологическим свойствам, спектру чувствительных клеток, антигенной структуре, составу генома, количеству и молекулярной массе структурных вирусных белков [31]. Исследования изолятов ВГЧ-6 от людей с различной патологией показали, что они принадлежат к двум вариантам: А или В (ВГЧ-6А и ВГЧ-6В) [32]. У взрослых людей чаще выявляют ВГЧ-6B, который содержит 97 уникальных генов, что объясняет его обширный тропизм к тканям [33]. В настоящем исследовании была использована тест-си-стема для ПЦР, позволяющая обнаруживать оба варианта ВГЧ-6. ВГЧ-6 является единственным вирусом герпеса, геном которого способен интегрироваться в теломеры хромосом клеток человека [34, 35]. Условия иммуносупрессии и стресса могут реактивировать репликацию ВГЧ-6 [36]. Arbuckle и et al. [37] считают, что при реактивации латентного ВГЧ-6, интегрированного в геном инфицированной клетки, развивается воспалительный процесс [38].
В естественных условиях основным путем передачи вируса служит воздушно-капельный, однако не исключаются половой путь передачи вируса и возможность перинатального инфицирования [39]. Так, по данным различных исследователей, ВГЧ-6 обнаруживается в 1,7–66,8% образцов спермы (табл. 3) [17, 40–45].

Данные табл. 3 показывают, что распространение ВГЧ-6 в разных группах обследованных лиц сильно различается. Так, среди мужчин с бесплодием в Греции ВГЧ-6 в сперме обнаружили у 66,8% [45]. В то же время в исследовании [39] из 179 проанализированных образцов спермы всего лишь 3 были положительными на ДНК ВГЧ-6 (1,7%), но 2 образца из 3 имели высокую вирусную нагрузку: 680 232 и 2 834 075 копий на 1 млн сперматозоидов.
В нашем исследовании максимальное значение концентрации ДНК ВГЧ-6 определено в соскобе из уретры и составило 3 703 900 копий/мл, у 8 пациентов в 22 образцах вирусная нагрузка была ниже, но также относительно высокой – превышала 1000 копий/мл.
Поскольку этиологические факторы ХП/СХТБ остаются недостаточно изученными, проблема лечения заболевания по-прежнему сложная. Из-за отсутствия эффективных методов лечения ХП/СХТБ часто используется широкий спектр методов лечения этого состояния, включая антибиотики, α-адреноблокаторы и нестероидные противовоспалительные средства [12, 13]. Мета-анализ результатов лечения ХП/СХТБ, проведенный в 2011 г. Anothaisintawee et al. [15], показал, что комбинация α-адреноблокатора тамсулозина, антибиотика левофлоксацин и ибупрофена достаточно эффективна в лечении ХП/СХТБ. Таким образом, ориентированная мультимодальная терапия представляется более удачной, чем эмпирическая монотерапия.
Как показали результаты настоящего исследования, положительный результат лечения пациентов, инфицированных ГВЧ, которым назначали ректальные свечи Виферон® в дозе 1 млн МЕ 1 раз в день в течение 20 дней наряду с тамсулозином и диклофенаком, получен по всем показателям: тяжесть симптомов по сумме баллов боли и нарушения мочеиспускания, по оценке качества жизни и по общей оценке симптомов. Все изменения подтверждались субъективными и объективными данными по шкале NIH-CPSI и были статистически значимыми (р<0,0001).
При оценке влияния курса лечения на частоту встречаемости ГВЧ наблюдали уменьшение количества инфицированных образцов в изученных клинических материалах (эякулят, соскоб уретры, секрет простаты). В целом количество инфицированных ГВЧ образцов после лечения снизилось на 54,3%, а количественный анализ ДНК ГВЧ методом ПЦР установил статистически значимое снижение концентрации вирусной ДНК после лечения во всех изученных клинических материалах. Этот эффект можно объяснить влиянием препарата Виферон®, включающим компоненты с противовирусной активностью (ИФН-α2b), с антиоксидантным действием (α-токоферола ацетат) и регулятор окислительно-восстановительных процессов – аскорбиновую кислоту. Учитывая эффективность данной методики лечения, ее можно рекомендовать к применению пациентам с хроническим абактериальным простатитом. Необходимо отметить, что терапевтический комплекс, включающий Виферон®, не содержал антибиотиков, что особенно важно в настоящее время – в эру устойчивости к антибиотикам.
Заключение. Мультифакторная патофизиология ХП/СХТБIII выдвигает требование индивидуального подхода к каждому пациенту. Результаты нашей работы показали возможность участия вирусных инфекций в этиологии ХП/СХТБ и эффективность мультимодальной терапии, включающей противовирусные, иммуномодулирующие и антиоксидантные компоненты. Основным ограничением настоящего исследования является относительно небольшое количество пациентов в сравниваемых группах. Для выяснения роли герпесвирусных инфекций в патогенезе ХП/СХТБ и разработки эффективных схем терапии этого заболевания необходимы дальнейшие исследования.



