Актуальность. Результаты эпидемиологических исследований свидетельствуют о высокой частоте инфекций мочевыводящих путей (ИМП), входящих в тройку наиболее распространенных заболеваний, при этом подавляющее большинство (до 84%) обращений связано с острым неосложненным циститом (ОНЦ) [1–3]. Ежегодно около 15% сексуально активных женщин репродуктивного возраста переносят по крайней мере один эпизод острого бактериального цистита и не менее 60% женщин хотя бы раз в жизни страдали этим заболеванием [4].
Особенностью ИМП является склонность к рецидивированию. По данным В. В. Рафальского и соавт. [5], примерно у четверти женщин с ИМП в течение года возникают три и более рецидивов. Чаще всего ОНЦ встречается у женщин репродуктивного возраста. К основным клиническим проявлениям неосложненной ИМП относятся боль в надлобковой области, учащенное и болезненное мочеиспускание, существенно ухудшающие качество жизни больных [6, 7].
Основные задачи при планировании лечения больных ОНЦ: эрадикация возбудителя, купирование симптомов, профилактика рецидивов, а также как можно более существенное улучшение качества жизни и восстановление трудоспособности. Антибактериальная терапия остается ведущим направлением лечения неосложненных ИМП [8, 9]. В случае ОНЦ антибактериальная терапия, как правило, носит эмпирический характер, при этом предпочтение следует отдавать коротким курсам антибактериальной терапии. В соответствии с этими принципами с характером чувствительности основных уропатогенов препаратами первой линии лечения ОНЦ в России оказались фосфомицина трометамол (однократно 3,0 г) и препарат нитрофуранового ряда фуразидин (100 мг 3 раза в сутки, 5 сут.) [10]. Минимальная подавляющая концентрация фосфомицина в моче для большинства возбудителей ИМП сохраняется на протяжении 24–48 ч после приема (для E. coli – по меньшей мере в течение 80 ч), что объясняет однократный прием препарата. При этом воспалительный процесс в стенке мочевого пузыря продолжается и как следствие – симптомы сохраняются до нескольких дней. Только у 30% пациентов клинические симптомы исчезают в течение 1 сут., у 50% – только в течение следующих 2 сут. [11]. Для более быстрого купирования симптоматики заболевания используют нестероидные противовоспалительные препараты (НПВП), спазмолитики, фитопрепараты [8, 12]. Комбинированное лечение ОНЦ антибактериальными препаратами и НПВП широко используется в клинической практике. Основным преимуществом такого подхода считается более быстрое начало лечебного действия, в первую очередь уменьшение болевого синдрома по сравнению с монотерапией антибактериальными препаратами [13]. В то же время использование НПВП может сопровождаться развитием ряда побочных явлений вследствие неблагоприятного влияния на функцию почек, сердечно-сосудистую систему и негативного действия на слизистые оболочки [14]. В связи с этим актуален поиск новых возможностей симптоматического лечения больных ОНЦ. Одним из таких терапевтических направлений является использование препаратов, обладающих быстрым и выраженным обезболивающим действием, влияющими преимущественно на нижние мочевыводящие пути. К таким препаратам относится феназопиридин.
Феназопиридин представляет собой гетероциклическое ароматическое азосоединение, плохо растворимое в холодной воде, но легко растворимое в горячей воде, спирте, уксусной кислоте и глицерине. По химическому составу это фенилазопиридин-2,6-диилдиамин. Препарат окрашивает мочу в красновато-оранжевый цвет. Феназопиридин и его метаболиты быстро выводятся из организма почками. При приеме 600 мг препарата его 90% элиминируются в течение 1 сут., причем 41% в неизмененном виде и 49% в виде метаболита [15].
Феназопиридин был синтезирован в 1914 г., а уже к 1934 г. были опубликованы материалы о значительном клиническом опыте применения препарата при инфекциях урогенитального тракта (более 3000 пациентов) [16]. Интерес к препарату значительно возрос после того, как в 2012 г. была предложена концепция использования уроанальгетиков – препаратов, оказывающих местное анальгетическое действие на нижние мочевыводящие пути [17]. Феназопиридин при выделении с мочой воздействует на слизистую оболочку нижних мочевыводящих путей, где оказывает выраженный местный анальгетический эффект. В экспериментальных работах выявлено прямое ингибирующее действие феназопиридина на интрамуральные афферентные Aδ-волокна, обеспечивающие чувствительность мочевого пузыря, что также может объяснить клинический эффект препарата [18]. Именно селективное действие на нижние мочевыводящие пути отличает феназопиридин от других лекарственных средств (спазмолитиков, анальгетиков, НПВП), которые используются для купирования дизурии.Результаты проведенных исследований свидетельствуют об эффективности и безопасности применения феназопиридина больными ИМП [19–22].
Целью исследования стала оценка эффективности и безопасности феназопиридина в лечении пациентов с неосложненной инфекцией нижних мочевыводящих путей, сопровождающейся болевым синдромом.
Материалы и методы. Проведено многоцентровое двойное слепое рандомизированное плацебо-контролируемое в параллельных группах исследование эффективности и безопасности феназопиридина для больных ОНЦ. В исследование были включены 60 женщин в возрасте от 18 до 55 лет с диагнозом ОНЦ. До проведения процедур исследования и начала лечения все больные подписали информированное согласие на участие в нем. Диагноз ОНЦ установлен на основании жалоб и клинической картины заболевания, а также результатов общего анализа мочи (выявление более 10 лейкоцитов в 1 мм при микроскопии осадка мочи).
Критерии невключения:
- повышенная чувствительность к феназопиридину и любым компонентам препарата;
- любые заболевания почек и мочевыводящих путей, за исключением неосложненной ИМП;
- почечная недостаточность;
- заболевания с повреждением поперечно-полосатой мускулатуры, в том числе сердечно-сосудистых и нейромышечных;
- любые заболевания печени;
- гемолитическая анемия, обусловленная недостаточностью глюкозо-6-фосфат дегидрогеназы;
- анатомические аномалии мочеполовых органов, хирургические операции на мочеполовых органах в течение 6 мес. до включения в настоящее исследование;
- использование любых антибактериальных препаратов в течение 7 дней до исследования.
Процедуры исследования провели на четырех визитах, три из которых состоялись в течение суток: визит 1 (скрининговый), визит 2 (рандомизационный), визит 3 (финальная оценка). В течение этих трех визитов пациентки находились в дневном стационаре. На последний, четвертый, визит пациентки приходили через 3 сут. после рандомизации.
На визите 1 (скрининговом визите включения в исследование) осуществлены сбор анамнеза и жалоб заболевания, оценка критериев включения/исключения; выполнены физикальный осмотр, лабораторные исследования (общий анализ мочи, клинический и биохимический анализы крови). Интенсивность симптоматики ОНЦ оценена с помощью специального опросника, включившего три 10-балльные визуальные шкалы (ВАШ-10) для описания выраженности общего дискомфорта, боли и учащения мочеиспускания. После получения инструкции по заполнению ВАШ-10 пациенты ставили отметку на шкале от 0 до 10 баллов в соответствии с субъективной оценкой выраженности оцениваемого симптома.
Критерий включения в исследование: выраженность основных симптомов ОНЦ по ВАШ-10:
- не менее 3 баллов в отношении общего дискомфорта;
- не менее 2 баллов в отношении учащения мочеиспускания;
- не менее 2 баллов в отношении боли при мочеиспускании;
- не менее 7 баллов суммарно для указанных выше симптомов ИМП.
Выраженность поллакиурии также оценивали по данным дневников мочеиспускания с расчетом среднего количества мочеиспусканий в час.
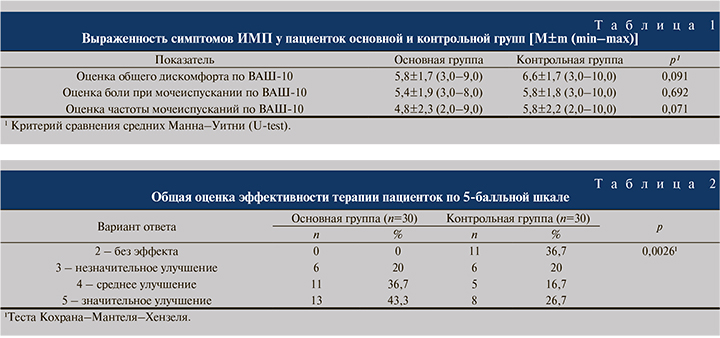
Не позднее 6 ч после визита 1 на визите 2 проходила процедура рандомизации, при которой методом случайного выбора больных разделили на две группы по 30 человек: основную и контрольную. Средний возраст пациенток основной группы составил 32,6±7,4, контрольной – 35,5±8,8 года. Пациентки обеих групп соответствовали критериям включения и были сопоставимыми по исходным параметрам заболевания. Выраженность клинических проявлений ИМП также была одинаковой (табл. 1).
Пациенткам основной группы однократно назначали феназопиридин в дозе 200 мг (2 таблетки, покрытые оболочкой, по 100 мг) перорально. Больные контрольной группы также однократно получали 2 таблетки плацебо. Препараты пациентки обеих групп принимали в присутствии медперсонала.
В состав таблетки феназопиридина помимо активного ингредиента входят вспомогательные вещества: карбоксиметилкрахмал, целлюлоза микрокристаллическая, кремния диоксид коллоидный, тальк и магния стеарат. В состав плацебо вошли только указанные выше вспомогательные вещества. Оболочки таблеток феназопиридина и плацебо были одинакового состава и состояли из гипромеллозы, железа оксида (черного), железа оксида (желтого) и ряда других веществ. Таким образом, таблетки феназопиридина и плацебо, использованные в данном исследовании, были полностью идентичными: одинаковой массы по 100 мг, коричневого цвета, круглой формы с двояковыпуклой поверхностью. Перед приемом основного препарата и плацебо получали стандартизированное питание. Также пациенткам рекомендовано опорожнять мочевой пузырь непосредственно перед приемом таблеток.
Во время рандомизационного визита проведено повторное физикальное обследование, больные заполняли опросники ВАШ-10. Им рекомендовано заполнять дневник мочеиспускания.
Оценка эффективности и переносимости лечения выполнена на визите 3 через 6 ч после приема исследуемого препарата/плацебо. Проведено физикальное обследование, опрошены больные относительно побочных эффектов терапии. Больные заполняли опросники ВАШ-10. Для общей оценки эффективности лечения использовали анкету с 5 вариантами ответов, каждый из которых соответствовал баллам от 1 до 5: ухудшение (1), без эффекта (2), незначительное улучшение (3), среднее улучшение (4) и значительное улучшение (5). Данная шкала считается одним из вариантов широко распространенного опросника Overall assesment of treatment response, используемого для субъективной оценки пациентками эффективности проводимой терапии.
По окончании процедур визита 3 все пациентки получили антибактериальную терапию: фосфомицина трометамол 3,0 г однократно.
Первичным критерием эффективности лечения в данном исследовании была динамика выраженности трех симптомов ИМП: общего дискомфорта, боли при мочеиспускании и частоты мочеиспускания через 6 ч после начала терапии.
Оценку безопасности лечения проводили на основании жалоб больных, результатов объективного осмотра и оценки лабораторных показателей.
Для научной систематизации, обобщения, обработки и анализа материалов исследования были использованы общеупотребительные методы параметрической и непараметрической статистики. Статистические сравнения до и после терапии проводились с помощью методов непараметрического теста знаковых рангов Уилкоксона внутри групп, а сравнение полученных данных между терапевтическими группами – с помощью непараметрического критерия Уилкоксона–Манна–Уитни. Анализ по отдельным пунктам 5-балльной шкалы проводился по критерию Кохрана–Мантеля–Хензеля.
Результаты и обсуждение. Результаты субъективной оценки динамики клинических проявлений ОНЦ в группах наблюдения представлены в табл. 2. Установлено, что в основной группе пациентки оценили эффект терапии достоверно выше, чем в контрольной группе. Средний балл по 5-балльной шкале составил 3,3±1,2 и 4,2±0,8 соответственно (p=0,0042, тест Уилкоксона–Манна–Уитни для независимых выборок). Все 30 человек, принимавших феназопиридин, через 6 ч после начала лечения указали на улучшение симптоматики, причем самым частым ответом было «значительное улучшение»: 13 (43,3%) человек. Ответы пациенток основной группы достоверно отличались от таковых женщин контрольной группы.
При оценке динамики интенсивности отдельных симптомов у больных ИМП через 6 ч после приема феназопиридина/плацебо отмечена аналогичная тенденция. Выраженность всех показателей, оцененных по ВАШ: степени общего дискомфорта, боли при мочеиспускании и учащения мочеиспускания, в основной группе снизилась более выраженно, чем у пациенток контрольной группы (табл. 3). При этом необходимо отметить, что пациентки, принимавшие плацебо, также указали на клиническое улучшение. Так, средняя оценка общего дискомфорта в основной группе снизилась на 53,4%, в контрольной – на 28,8%, выраженность боли при мочеиспускании – соответственно на 57,4 и 35,9%; частота мочеиспускания – соответственно на 39,6 и 27,6%. При оценке частоты мочеиспускания (среднее количество мочеиспусканий в час) и оценке частоты мочеиспускания по ВАШ пациентом в качестве базового уровня бралась оценка за день до приема исследуемого препарата/плацебо (полученная на скрининге) в сравнении со средней оценкой по данному показателю после приема исследуемого препарата/плацебо в течение 6-ч периода терапии (Визит 3). Сравнение проводилось с помощью методов непараметрического теста знаковых рангов Уилкоксона внутри групп. Проведенный анализ выявил статистически значимое улучшение (снижение частоты мочеиспускания и баллов по шкале ВАШ) после приема исследуемых препаратов как в группе Феназопиридин, так и в группе Плацебо. При этом, при сравнении полученных изменений между терапевтическими группами на Визите 3 с помощью непараметрического критерия Уилкоксона-Манна-Уитни показано, что частота мочеиспусканий после терапии исследуемым препаратом феназопиридин статистически значимо ниже чем после приема плацебо.

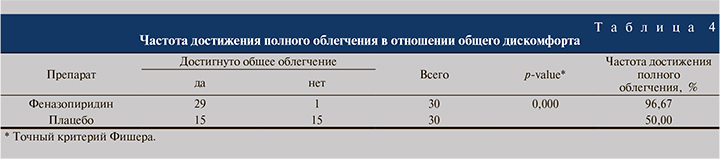
На визите 3 был проведен анализ времени до полного исчезновения общего дискомфорта. Оказалось, что время до полного облегчения в отношении общего дискомфорта после терапии препаратом феназопиридин было статистически значимо меньше, чем в группе Плацебо (р<0,05) (табл. 4).
Переносимость лечения наблюдаемыми больными была хорошей. Нежелательные явления на визите 3 (через 6 ч приема феназопиридина/плацебо) были выявлены только у 4 больных – по 2 из каждой группы. В основной группе в одном случае зарегистрирована боль в эпигастрии, во втором – чувство жара в области груди, в контрольной – соответственно диарея и головокружение. Степень выраженности нежелательных явлений была расценена во всех случаях как легкая, а связь их возникновения с исследуемым препаратом – как возможная. Дополнительного лечения ни в одном случае не потребовалось. Серьезных нежелательных явлений не было. Через 3 дня после приема препаратов отмечены клинически незначимые отклонения лабораторных показателей (разнонаправленное изменение количества лейкоцитов, эритроцитов, лимфоцитов, моноцитов крови, относительной плотности мочи), связать которые с назначенным лечением мы не смогли. Таким образом, переносимость однократного приема феназопиридина в дозе 200 мг вполне удовлетворительная и сопоставима с переносимостью плацебо.
Проведенное исследование показало клиническую эффективность применения феназопиридина как симптоматического средства при лечении больных ОНЦ. При приеме препарата отмечено уменьшение общего дискомфорта, боли при мочеиспускании и уменьшение степени поллакиурии, которое превосходило таковое у плацебо. Полученные нами результаты согласуются с данными проведенных ранее клинических исследований феназопиридина [19–22].
P. C. Trickett et al. в рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании изучали эффективность применения феназопиридина для уменьшения выраженности боли и дизурии у 98 больных ИМП [19]. Интенсивность снижения клинических проявлений ИМП при приеме феназопиридина была достоверно больше, чем при приеме плацебо. Переносимость феназопиридина была хорошей – ни у одного больного, принимавшего препарат, не отмечено нежелательных явлений. Сходные результаты получены в ряде других исследований со сходным дизайном, в которых показано, что феназопиридин достоверно эффективнее плацебо купирует симптомы ИМП – боль, дизурию и общий дискомфорт [20, 21].
С. Deepalatha et al. [22] изучали эффективность применения феназопиридина в сочетании с антибактериальными средствами. Разделенным на три группы лечения больным неосложненной ИМП назначали соответственно феназопиридин в виде монотерапии, комбинированную терапию феназопиридином и антибактериальным препаратом (доксициклином или ципрофлоксацином) и лечение фитопрепаратом цистоном. Наибольшую эффективность в отношении выраженности и быстроты наступления эффекта продемонстрировала комбинированная терапия, следом за ней – монотерапия феназопиридином, оказавшаяся эффективнее назначения цистона. Таким образом, при неосложненных ИМП назначать феназопиридин целесообразно вместе с антибактериальными препаратами с целью облегчения боли и уменьшения дискомфорта. Необходимо отметить, что рекомендуемая продолжительность назначения феназопиридина не должна превышать 2 дней. Такое ограничение связано с отсутствием клинических данных, подтверждающих увеличение эффективности при более продолжительном лечении ОНЦ, поскольку при правильно подобранной антибиотикотерапии через 2 сут. должна исчезнуть потребность в дальнейшем приеме феназопиридина [23].
Полученные в настоящем исследовании результаты подтвердили данные других авторов относительно быстроты развития эффекта феназопиридина [24]: снижение интенсивности боли пациенты ощущали уже через 20 мин после приема препарата. Эффективная доза феназопиридина составила 200 мг (2 таблетки по 100 мг) однократно; через 6 ч после ее приема боль при мочеиспускании уменьшилась на 57,4% от исходного значения, улучшая качество жизни больных ОНЦ на фоне ожидания эффекта от этиотропной терапии.
Переносимость феназопиридина хорошая, что также подтверждает данные, полученные другими исследователями [21, 22].
Важным направлением клинического применения феназопиридина помимо ИМП стало его назначение при дизурии неинфекционного генеза, а также перед медицинскими манипуляциями, когда есть риск травмирования слизистых оболочек нижних мочевыводящих путей [25]. В первую очередь речь идет о катетеризации мочевого пузыря, цистоскопии, уретроскопии. Кроме того, возможно назначение феназопиридина в послеоперационном периоде пациентам после установки уретрального слинга [26] и мочеточникового стента [27]. Способность препарата к окрашиванию мочи в красно-оранжевый цвет также используют для визуализации устьев мочеточников при цистоскопии. По шкале возможных рисков для плода из-за применения лекарств при беременности феназопиридин классифицируется как препарат категории В. Он может применяться в тех случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода.
Феназопиридин – препарат для симптоматического лечения. Он не воздействует на причину заболевания и предназначен для того, что в течение короткого периода времени купировать наиболее значимые для пациента болевые ощущения и другие дизурические проявления. Применение феназопиридина в качестве средства симптоматического лечения не должно задерживать постановку диагноза и начало патогенетического лечения. Препарат следует использовать исключительно для облегчения боли и дискомфорта, а не для замены специфической антибактериальной терапии.
Заключение. Результаты исследования показали, что феназопиридин – эффективный и хорошо переносимый препарат для симптоматической терапии пациенток с ОНЦ и может быть рекомендован в дополнение к этиотропной терапии.



