Введение. Постконтрастное повреждение почек (или ранее контраст-индуцированная нефропатия) представляет собой осложнение, развивающееся после введения рентген-контрастных средств и характеризующееся ухудшением функциональных возможностей почек. Ключевыми патогенетическими звеньями острого повреждения почек (ОПП), согласно современным представлениям, являются оксидативный стресс, спазм почечных сосудов и прямое повреждающее действие на клетки канальцев [1].
На настоящий момент существует лишь один вид вмешательства, который с точки зрения доказательной медицины позволяет снижать риск развития ОПП у пациентов групп риска, – гидратация, которая может быть как пероральной, так и внутривенной или внутриартериальной [2].
Уже длительное время в качестве нефропротективных агентов рассматривается гликопептидный гормон – эритропоэтин. Он продемонстрировал свои защитные эффекты не только при ишемических и реперфузионных повреждениях, но и при постконтрастном остром повреждении почек [3]. Однако ряд работ указывает на то, что, во-первых, эритропоэтин может способствовать развитию нежелательных реакций, включающих тромбозы, которые могут негативно сказываться на течении острого повреждения почек, а во-вторых, в крупных рандомизированных исследованиях эритропоэтин не продемонстрировал сопоставимой с доклиническими исследованиями эффективности [4]. В связи с этим были созданы различные производные эритропоэтина, включая асиалированные и карбамилированные [4, 5], а также пептид, имитирующий пространственную структуру α-цепи B эритропоэтина (pHBSP) [6]. В отличие от рекомбинантного эритропоэтина указанный пептид лишен гематопоэтической активности, а значит, обладает более благоприятным профилем безопасности. Кроме того, он обладает высоким сродством к гетеродимерному комплексу – EPOR/CD131, отвечающему за реализацию цитопротективных эффектов [6, 7].
Цель: изучить эффективность предварительного введения пептида, имитирующего пространственную структуру α-цепи B эритропоэтина при моделировании экспериментального постконтрастного острого повреждения почек.
Материалы и методы. Исследование выполнено на 48 половозрелых самцах мышей массой 28–32 г. Этические нормы обращения с лабораторными животными соответствовали «Directive 2010/63/EU of the European Parliament and of the Council of 22 Sep 2010 on the protection of animals used for scientific purposes».
Все животные были разделены на следующие экспериментальные группы:
1. Интактные животные, n=12;
2. Группа с моделированием постконтрастного острого повреждения почек, n=12;
3. Группа с предварительной пероральной гидратацией и моделированием постконтрастного острого повреждения почек, n=12;
4. Группа с предварительным введением пептида, имитирующего пространственную структуру α-цепи B эритропоэтина, в дозе 100 мкг/кг и моделированием постконтрастного острого повреждения почек (ПК-ОПП), n=12.
Моделирование ПК-ОПП производилось по общепризнанной методике путем последовательного введения диклофенака в дозе 10 мг/кг (внутрибрюшинно), N-нитро-L-аргинин метилового эфира (L-NG-Nitro arginine methyl ester (L-NAME)) в дозе 10 мг/кг внутрибрюшинно и рентгенконтрастного средства йопромида в дозе 3 г йода/кг (внутривенно) [8]. За 12 ч до введения указанных веществ животные лишались свободного доступа к воде.
Через 24 ч мышей помещали в метаболические клетки по 3 особи в каждую и осуществляли сбор суточных образцов мочи для последующей оценки уровня протеинурии и концентрации интерлейкина-6. Через 48 ч производили оценку массы животных и под наркозом осуществляли забор крови из сердца для последующего измерения концентрации креатинина, мочевины и альбумина по общепризнанной методике. Расчет скорости клубочковой фильтрации осуществляли на основании клиренса эндогенного креатинина.
Статистический анализ проводили с использованием программы GraphPad Prism 9. Тип распределения случайных величин определяли с помощью критерия Шапиро–Уилка. При нормальном распределении данные представляли в виде среднее±стандартная ошибка среднего, а в случаях ненормального распределения в виде медиана, 25%-й и 75%-й квартилей. Межгрупповые различия определяли с использованием параметрического параметра – t-критерия Стьюдента (в случае нормального распределения данных) или непараметрического параметра – U-критерия Манна–Уитни (в случае ненормального типа распределения данных). Статистически значимыми считали различия при уровне значимости p<0,05.
Результаты. На фоне введения диклофенака, L-NAME и йопромида развивалось острое повреждение почек, о котором свидетельствовало повышение концентрации как креатинина, так и мочевины с 23,1±1,4 мкмоль/л и 8,3±0,7 ммоль/л до 84,1±3,2 мкмоль/л и 42,1±2,4 ммоль/л соответственно (рис. 1). С другой стороны, скорость клубочковой фильтрации статистически достоверно снижалась с 229,6±16,3 мкл/мин до 29,4±3 мкл/мин (рис. 2). Помимо биохимических и функциональных показателей об адекватности используемой модели свидетельствовал существенный рост летальности (20%). Также о повреждении почечной ткани свидетельствовал рост уровня протеинурии до 0,7±0,07 г/л и концентрации интерлейкина-6 в моче до 104,5±5 пг/мл.
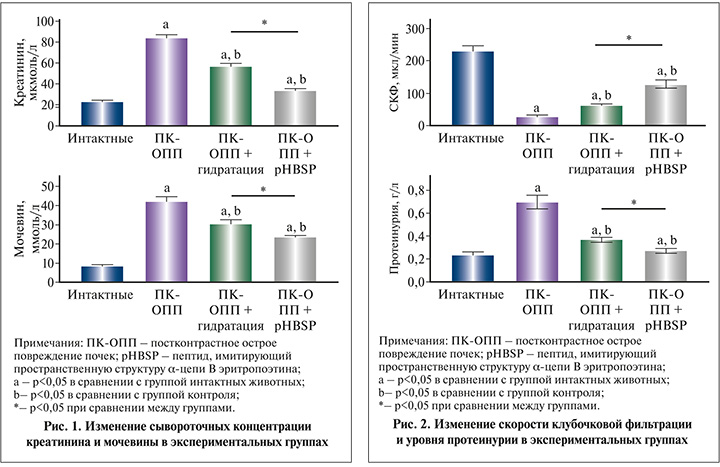
Предварительное введение пептида, имитирующего пространственную структуру α-цепи B эритропоэтина, в дозе 100 мкг/кг за 30 мин до моделирования постконтрастного острого повреждения почек приводило к статистически достоверному снижению, во-первых, биохимических показателей: сывороточной концентрации креатинина до 33,7±1,8 мкмоль/л, мочевины до 23,6±0,9 ммоль/л к 48 ч эксперимента (рис. 1).
Также о защитных эффектах указанного производного эритропоэтина указывает статистически достоверный рост скорости клубочковой фильтрации (рис. 2), а также снижение соотношения мочевина/альбумин до 1,2±0,06 ммоль/г.
О сохранении функциональной способности клубочкового и канальцевого аппарата на фоне введения пептида, имитирующего пространственную структуру α-цепи B эритропоэтина, в дозе 100 мкг/кг также косвенно свидетельствует снижение уровня протеинурии более чем в 2,5 раза – до 0,27±0,02 г/л и концентрации провоспалительного интерлейкина (ИЛ-6) в моче в 1,4 раза – до 72,9±6,2 пг/мл.
По совокупности показателей указанный способ коррекции функциональных и биохимических нарушений в почках при моделировании постконтрастного острого повреждения почек превосходит статистически достоверно эффективность пероральной гидратации, также проводимой предварительно.
Обсуждение. Результаты исследования демонстрируют, что использование экспериментальной модели с последовательным введением нестероидного противовоспалительного средства, ингибитора синтаз оксида азота и неионного низкоосмолярного рентгенконтрастного средства лабораторным животным позволяет воспроизводить комплекс патогенетических звеньев и нарушений, встречающихся при постконтрастном остром повреждении почек у людей. Указанная модель также позволяет отражать комплекс нарушений, которые сопровождают заболевания, являющиеся факторами риска ПК-ОПП, – сердечно-сосудистые заболевания, сахарный диабет, сепсис и ряд других [1].
Как и в клинической практике, несмотря на достижения в области лабораторной диагностики, ключевыми параметрами оценки и критериями диагностики ОПП и функционального состояния функции почек служат сывороточная концентрация креатинина и скорость клубочковой фильтрации [1, 2, 9]. В данном исследовании у лабораторных животных при моделировании патологического процесса отмечается статистически достоверный (p<0,05) рост концентрации креатинина более чем в 3,6 раза и падение СКФ в 7,8 раза. Также в данном исследовании нами был использован еще один параметр – концентрация провоспалительного цитокина – ИЛ-6 в моче, которая нарастала в среднем в 4,8 раза через 48 ч эксперимента при моделировании постконтрастного острого повреждения почек у мышей. Интерлейкин-6 в почках при остром их повреждении может повышаться благодаря нескольким факторам: повышенной продукции стимулированными макрофагами и снижению клиренса цитокинов за счет повреждения канальцевого и клубочкового аппаратов [10].
Одним из фармакологических агентов, обладающих нефропротективными свойствами при остром повреждении почек, является гормон – эритропоэтин, который, однако, в клинической практике не нашел применения, несмотря на весомые доказательства в доклинических исследованиях. В связи с этим на его основе были созданы различные производные [4, 5], в том числе пептиды, имитирующие пространственную структуру его цепей [6].
Исследуемое соединение при моделировании постконтрастного острого повреждения почек оказывало защитные эффекты при внутрибрюшинном предварительном введении в дозе 100 мкг/кг, о чем свидетельствовало статистически достоверное снижение концентрации креатинина и мочевины, рост скорости клубочковой фильтрации. О благоприятном влиянии пептида, имитирующего пространственную структуру α-цепи B эритропоэтина на функциональное состояние клубочкового аппарата почек также свидетельствовало статистически достоверное снижение уровня протеинурии. По совокупности показателей пептид, имитирующий пространственную структуру α-цепи
B эритропоэтина, превосходил эффективность пероральной гидратации.
Выявленное статистически достоверное снижение концентрации ИЛ-6 в моче не только свидетельствует о нефропротективных свойствах pHBSP, но и косвенно подтверждает возможность реализации защитных эффектов через противовоспалительное действие.
Однако настоящее исследование имеет ряд ограничений: во-первых, изучена лишь одна доза пептида, имитирующего пространственную структуру α-цепи B эритропоэтина, не произведена оценка дозозависимости его действия; во-вторых, не исследованы возможности использования указанного пептида после развития эпизода постконтрастного острого повреждения почек; в-третьих, сведения о возможной реализации защитных эффектов через противовоспалительные свойства косвенные и базируются на исследовании концентрации одного провоспалительного цитокина в моче, а также данных литературы и предшествующих работах.
Заключение. Предварительное введение пептида, имитирующего пространственную структуру α-цепи B эритропоэтина, способствует уменьшению тяжести постконтрастного острого повреждения почек в эксперименте, в том числе через противовоспалительные свойства.
Следует отметить, что результаты данного исследования формируют научный задел для дальнейшего поиска нефропротективных агентов – производных эритропоэтина и их клинической апробации в соответствии с существующими нормативно-правовыми актами. Вероятно, следует изучить в более масштабных доклинических исследованиях и клинической практике значимость оценки концентрации ИЛ-6 в качестве диагностического критерия постконтрастного острого повреждения почек.



