Ведение. Наиболее частым выбором в лечении врожденных поражений уретеровезикального соустья (рефлюкс или стеноз), а также стриктур в пределах дистальной трети мочеточника остается уретероцистоанастомоз (УЦА) [1–5].
И если дилятация мочеточников невелика, т.е. около 7–8 мм, предпочтительны антирефлюксные техники Politano-Leadbetter, Cohen, Lich-Grégoire [6–11], не требующие реконструкции мочеточника и обеспечивающие успешный результат более чем в 85–90% операций. Однако при выраженном расширении мочеточников, когда их диаметр превышает 1 см, а порой достигает и 4–5 см, требуется резекция по ширине, а иногда и по длине в границах дистальной трети [12–13] или безрезекционное моделирование мочеточника [14–15].
Большинство публикаций последнего десятилетия не заостряют внимания на технике как реконструкции мочеточника, так и уретероцистоанастомоза [1] и даже не придают внимания важности создания антирефлюксного механизма [16–19]. Как правило, освещаются вопросы особенностей лапароскопического и робот-ассистированного подходов к хирургии, сравнивая их между собой, а также с открытой техникой оперативного лечения [1, 17, 18, 20, 21]. Однако, на наш взгляд, представляется крайне важной позиция прецизионности хирургической техники независимо от подхода (открытого лапароскопического робот-ассистированного) по созданию антирефлюксного УЦА, имеющего не только успешный анатомический прогноз, но и высокую функциональность для защиты от прогрессирования хронической болезни почек (ХБП), которая в значительной части случаев уже имеется к моменту реконструкции мочеточника и создания УЦА. С этой точки зрения представляется целесообразным обобщить опыт одного хирургического центра последнего десятилетия выполнения УЦА при выраженном расширении мочеточников по технике Bradić [22], что и служит целью настоящей публикации.
Материалы и методы. В ретроспективное исследование включены 12 пациентов (6 мужчин и 6 женщин), подвергшихся уретероцистоанастомозу с января 2010 по декабрь 2019 г. по поводу врожденных и приобретенных поражений мочеточника с высокой степенью их дилятации. Врожденные поражения включили два случая пузырно-мочеточникового рефлюкса (ПМР) и пять – обструктивного мегауретера. А приобретенные состояния стали осложнениями гинекологической (три операции) и урологической хирургии (две операции уретероскопии). Пациенты после радиационной терапии, предшествовавших реконструктивных операций на мочевых путях были исключены из исследования. Все операции произведены открытым методом. Пациенты после ятрогенных повреждений мочеточников подверглись отсроченной хирургии, т.е. позднее 5–6 нед. после травмы.
Дооперационное обследование включило мультиспиральную компьютерную томографию (МСКТ) почек и живота и/или магнитно-резонансную томографию (МРТ) забрюшинного пространства, цистоскопию, ретро- и/или антеградную уретерографию, определение скорости клубочковой фильтрации (СКФ), состояние микробиоты мочи, в части случаев радионуклидное исследование почек с MAG3. Послеоперационный мониторинг включил ультразвуковое исследование (УЗИ) почек и определение СКФ через 3 мес., МСКТ почек и микционную цистографию через 6 мес., СКФ и УЗИ почек через 9 и 12 мес., цистографию по показаниям.
Статистическую обработку данных проводили с использованием статистического пакета STATISTICA 10 (StatSoft Inc., США). Анализ соответствия вида распределения признака закону нормального распределения проводили с применением критерия Шапиро–Уилка. Качественные данные представляли как абсолютные и относительные частоты (проценты). Описательную статистику количественных признаков представляли в виде центральной тенденции медианы (Me) и межквартильного размаха (25 и 75 процентилей), в тексте представлено как Ме [LQ; UQ], отмечали полярные значения признаков в виде интервала от минимального до максимального значений). Сравнение независимых переменных в группах проводили с помощью дисперсионного анализа методом Краскел–Уоллиса и медианного теста; оценку динамических изменений при наличии ≥3 величин производили ранговым дисперсионным анализом и конкордацией Кендалла (модуль ANOVA). Статистическую взаимосвязь двух признаков искали расчетом коэффициента ранговой корреляции Спирмена.
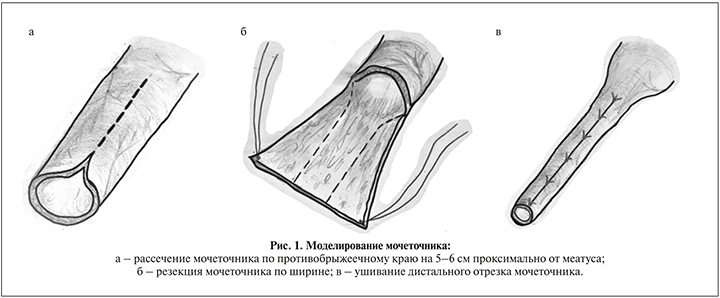
 Техника операции Bradić. Положение больного на спине со сведенными нижними конечностями:
Техника операции Bradić. Положение больного на спине со сведенными нижними конечностями:
- хирургический доступ в виде косого разреза в подвздошно-надлонной области;
- визуализация мочеточника в зоне перекреста с подвздошными сосудами и выделение его либо до мочевого пузыря в случае ПМР, либо до сужения с сохранением сосудистой ножки;
- пересечение мочеточника и его моделирование путем продольного рассечения от меатуса проксимально на 5–6 см строго по противобрыжеечному краю (рис. 1а), резекция мочеточника по ширине (рис. 1б) таким образом, чтобы после ушивания дистальный отрезок мочеточника имел внутренний диаметр 5–6 мм (рис. 1в);
- ушивание мочеточника двухрядно: первый шов абсорбируемой нитью 4/0 непрерывно с захватом слизистой и мышечного слоя, второй – отдельные швы на адвентицию монолитной нитью 5/0 с интервалом 3–4 мм и формирование меатуса диаметром 5 мм;
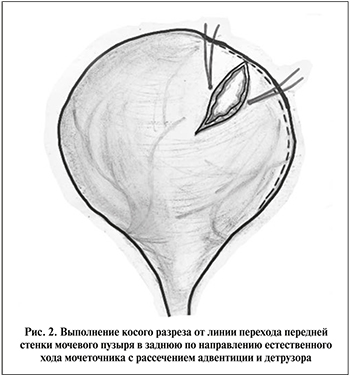
- визуализация передне-верхушечной области мочевого пузыря с ипсилатеральной стороны и выполнение косого разреза, начиная от линии перехода передней стенки в заднюю, кпереди на 4–5 см по направлению естественного хода мочеточника с рассечением адвентиции и детрузора вплоть до слизистой пузыря (рис. 2);
- отделение детрузора от слизистой острым и тупым путем в обе стороны от разреза настолько, чтобы в рану был свободно уложен реконструированный мочеточник;
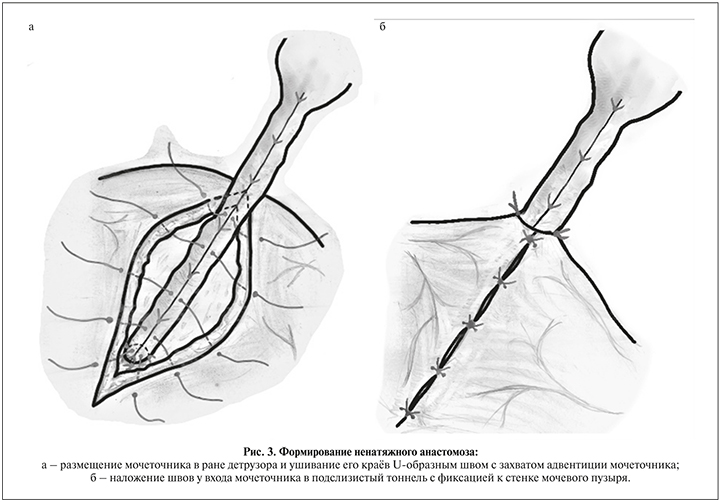
- рассечение слизистой у дистального угла раны размером 5–6 мм и формирование анастомоза между слизистой и мочеточником по задней полуокружности, установка JJ-стента и завершение формирования анастомоза отдельными швами с абсорбируемой нитью 4–5/0;
- размещение мочеточника в ране детрузора и ушивание его краев U-образным швом с захватом адвентиции мочеточника отдельными швами абсорбируемой нитью 3/0 с интервалом 4–5 мм, наложение 2–3 швов у входа мочеточника в подслизистый тоннель с фиксацией к стенке мочевого пузыря. Таким образом формируется ненатяжной анастомоз (рис. 3);
- установка уретрального катетера, дренирование таза в околопузырном пространстве, ушивание раны передней брюшной стенки.
Дренаж удаляется из таза через 24–48 ч, уретральный катетер – через 7–8 дней, JJ-стент – через 6 нед.
Результаты. Предоперационные характеристики больных представлены в таблице.

В двух случаях имел место ПМР III–IV степеней у мужчин 20 и 22 лет, а в 10 – обструкция интрамурального и/или юкставезикального отделов мочеточника. Во всех наблюдениях имела место дилятация мочеточника >1 см, более всего выраженная при ПМР и обструктивном мегауретере. За 5–12 нед. до УЦА у 50% пациентов была выполнена чрескожная пункционная нефростомия, тем не менее ни в одном из этих случаев дилятация не уменьшилась до 15 мм. Только у трех больных СКФ была не нарушена, но при аномалиях мочеточника была снижена во всех случаях. Протяженность поражения мочеточника в виде сужения была наименьшей при обструктивном мегауретере (≤25 мм), но имела бо́льшую длину после ятрогенных повреждений органа. Во всех случаях сужение мочеточника располагалось в дистальной трети мочеточника, поэтому УЦА по методике Bradić оказался ненатяжным и не потребовал техники psoas hitch.
Интраоперационных осложнений отмечено не было. Кровопотеря в силу открытого хирургического доступа не превышала 100 мл. Длительность операции с учетом необходимости реконструкции мочеточника составила 157,5 [150; 172] (100–235) мин.
Послеоперационное осложнение имело место в одном случае – острая задержка мочеиспускания с развитием острого пиелонефрита со стороны оперированного мочеточника у мужчины 52 лет с объемом простаты 85 см3, разрешившаяся консервативно в течение 3 сут.
После удаления мочеточниковых стентов (через 5–8 нед. после операции) не отмечено воспалительных или обструктивных симптомов с оперированной стороны. Через 6 мес. после операции, по данным МСКТ, во всех случаях имело место уменьшение в объеме дилятированного мочеточника и чашечно-лоханочной системы. У двоих пациентов зафиксирован низкий активный ПМР. Через 12 мес. анатомическое состояние верхних мочевых путей оставалось стабильным. Однако у двух мужчин с исходным ПМР и троих больных с врожденным мегауретером в динамике определено достоверное снижение СКФ, связанное с прогрессированием нефросклероза. Однако ни один из наблюдавшихся пациентов в сроки от 1 до 10 лет не имел симптомов почечной инфекции и признаков стеноза уретеро-везикального соустья.
Обсуждение. Первое сообщение I. Bradić et al. [22] об антирефлюксной уретероцистостомии в верхушку мочевого пузыря содержало опыт 106 операций 90 детям с первичным ПМР II–IV степеней с минимальными уровнями послеоперационных осложнений: рецидив рефлюкса – 2,1% и стеноз – 0%. Последующие публикации 1988 и 2004 гг. [23, 24] были основаны уже на более крупных сериях пациентов: 618 и 803 соответственно, и также характеризовались низкими уровнями рецидива рефлюкса (5,0%) и стеноза неосоустья (1,5%). Все три публикации исходили из одной Загребской клиники.
Нами в текущем клиническом исследовании были применены основные технические приемы, разработанные I. Bradić, в отношении иной группы больных: во-первых, у взрослых пациентов, во-вторых, в 10 случаях из 12 при обструктивных состояниях мочеточников врожденного и приобретенного генеза. В отличие от техники Bradić нами производится косой разрез детрузора, соответствующий нормальному ходу мочеточника, а не продольный, и в передне-верхней области мочевого пузыря в проекции перехода передней стенки пузыря в заднюю, а не на чисто передней стенке. Наше предположение относительно зоны разреза детрузора в большей мере будет конфигурировать ангуляцию мочеточника при естественном наполнении мочевого пузыря. Кроме того, с целью обеспечения ненатяжного анастомозирования нами производится фиксация мочеточника к детрузору не только в субмукозном тоннеле, но и в точке входа мочеточника в тоннель.
Особенностью отбора больных в исследуемую группу стали тяжелые дилятации мочеточника, т.е. такие, когда медиана диаметра мочеточника составляла в среднем 19,5 мм с диапазоном диаметра 10–50 мм. Естественно, такая дилятация требовала моделирования, т.е. реконструкции дистального мочеточника. В литературе описаны безрезекционные методики, цель которых поперечное гофрирование мочеточника, т.е. сохранение всей мышечной массы органа [14, 15]. Однако после гофрирования наружный диаметр мочеточника остается существенно бо́льшим, чем 10 мм, и это не позволяет выполнять качественный антирефлюксный анастомоз. Поэтому нами, как и рядом других исследователей [13], был применен резекционный подход к моделированию мочеточника. Такой вид реконструкции позволяет учитывать качество мочеточника на момент его имплантации, толщину его стенки, степень фиброзирования и эластичности, что дает возможность хирургу индивидуализировать объемы резекции тканей по ширине. Обуживание мочеточника по длине 4–5 см со стороны контрлатеральной брыжейки позволяет анатомично уложить его на слизистую мочевого пузыря и свободно укрывать сведением краев детрузора. Таким образом, в описанной технике мы соединили принципы антирефлюксной реимплантации мочеточника по Bradić с техникой коррекции диаметра мочеточника по Hodgson.
Отдаленные результаты мониторинга пациентов показали успешный результат во всех случаях, не потребовавший повторных операций, в том числе и нефрэктомии.
Заключение. Комбинация техники Bradić по антирефлюксной реимплантации выраженно расширенного мочеточника и техники Hodgson по коррекции диаметра мочеточника обеспечивает превосходные результаты как в краткосрочном, так и при долговременном мониторировании поражений мочеточниково-мочепузырных соустий.



