Введение. В настоящее время препараты антикоагуляционного типа действия являются обязательной частью медикаментозной терапии пациентов, перенесших то или иное хирургическое вмешательство, в т.ч. лапароскопическое, в случаях развития или угрозы развития венозных тромбоэмболических осложнений (ВТЭО) – послеоперационных флеботромбозов и тромбофлебитов нижних конечностей и малого таза, а также тромбоэмболии легочной артерии (ТЭЛА) – важнейшего прямого следствия тромбозов глубоких вен нижних конечностей (ТГВНК) [1]. Как отмечают практически все авторы, в рассматриваемых ситуациях развитию ВТЭО весьма успешно препятствует использование антикоагуляционных лекарственных средств (АКЛС). Этот тезис подтверждается результатами сравнительного анализа частоты ТГВНК и ТЭЛА после операций на органах брюшной полости, забрюшинного пространства и малого таза пациентов, защищенных АКЛС, и лиц, не получавших препаратов данной группы. У первых значения изучаемых показателей равнялись примерно 5,3–7,7% и 0,1–0,2%, у вторых – 11,0–40,0% и 0,3–1,0% соответственно [2, 3].
Любые структурные, метаболические и/или функциональные расстройства со стороны тканей, органов или си-стем органов, способные инициировать и/или поддерживать уменьшение линейной скорости кровотока, рост коагуляционного потенциала крови, острое или хроническое повреждение эндотелиального слоя сосудистых стенок, становятся факторами риска развития послеоперационных ВТЭО. Среди причин расстройств такого рода – возраст старше 40 лет, плановое оперативное вмешательство, постоянная гормонозаместительная терапия (ГЗТ), злокачественные новообразования (ЗНО), хроническая сердечная недостаточность (ХСН), дыхательная недостаточность (ДН), хроническая обструктивная болезнь легких (ХОБЛ), варикозная болезнь нижних конечностей (ВБНК), повышенный уровень антикардиолипиновых антител (АКЛА) и др. [4–9]. Если при хирургическом лечении используются лапароскопические технологии, то к уже отмеченным факторам риска присоединяются повышенное внутрибрюшное давление (следствие наложения карбокиперитонеума) и положение больного на столе с приподнятым головным концом [10].
В Российской Федерации содержание мероприятий по профилактике послеоперационных ВТЭО регламентировано отраслевым стандартом (ОСТ) «Протокол ведения больных. Профилактика тромбоэмболии легочной артерии при хирургических и иных инвазивных вмешательствах», введенным в действие Приказом Министерства здравоохранения № 233 от 09.06.2003. Согласно ОСТ 91500.11.0007-2003, препаратами выбора для антикоагуляционной профилактики послеоперационных ВТЭО являются нефракционированный (высокомолекулярный, стандартный) гепарин натрия (НФГ, или ВМГ, или просто гепарин натрия) и низкомолекуярные гепарины (НМГ) – дальтепарин натрия (фрагмин), надропарин кальция (фраксипарин) и эноксапарин натрия (клексан) [11].
Низкомолекулярные гепарины представляют собой фрагменты НФГ, для них характерна ме́ньшая, чем у НФГ, тропность к белкам крови, ее форменным элементам и эндотелиальному слою сосудистой стенки, более продолжительное существование в крови и более высокий уровень корректности при вмешательстве в функционирование системы свертывания крови [12–15]. По данным И. Н. Бокарева и соавт. (2009), на фоне действия НФГ вероятность послеоперационных венозных тромбоэмболических осложнений составляет 7,5%, НМГ – 6,5%, степень риска формирования ВТЭО уменьшается на 76% [16].
Целью настоящего исследования стала оценка эффективности эноксапарина натрия при использовании его для профилактики послеоперационных ВТЭО у пациентов урологического профиля.
Материалы и методы. Для достижения поставленной цели на базе Санкт-Петербургского государственного бюджетного учреждения здравоохранения (СПб ГБУЗ) «Клиническая больница Святителя Луки» в апреле 2021 г. было выполнено ретроспективное исследование результативности применения эноксапарина натрия у пациентов с различной степенью риска послеоперационных венозных тромбоэмболических осложнений. В исследовании участвовали 110 мужчин и 41 женщина в возрасте 22–92 лет (М=59,2; σ=15,6; Ме=62,5; Мо=69,0). Все эти больные в апреле 2021 г. находились на плановом хирургическом лечении в урологическом отделении СПб ГБУЗ «Клиническая больница Святителя Луки». Критериев исключения не было. Заболевания (МКБ-10), послужившие причиной госпитализации и планового хирургического лечения, применявшиеся методы лечения показаны в табл. 1. В зависимости от результатов балльной оценки риска развития ВТЭО у пациентов хирургического профиля по шкале Caprini [17–19] было сформировано шесть исследовательских групп. В группы 1 (n=18), 2 (n=14) и 3 (n=34) включили пациентов с очень низкой (0–1 балл по шкале Caprini), низкой (1–2 балла) и умеренной (3–4 балла) степенями риска ВТЭО. Группы 4 (n=63), 5 (n=18) и 6 (n=4) были составлены из больных с высоким (5–8 баллов), очень высоким (9–11 баллов) и чрезвычайно высоким (12–15 баллов) риском развития ВТЭО соответственно. Характеристика исследовательских групп представлена в табл. 2.

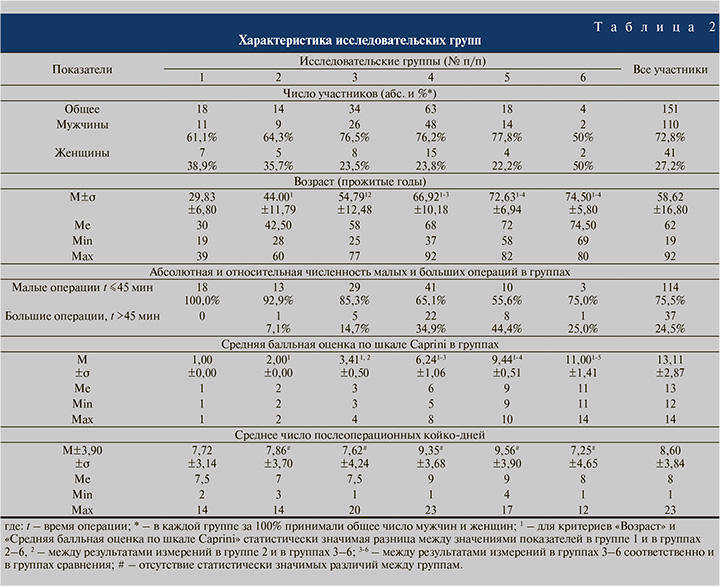
В соответствии с требованиями ОСТ 91500.11.0007-2003 пациентам не старше 45 лет с предполагаемой длительностью вмешательства менее 45 мин и очень низким риском развития ВТЭО (группа 1, 0–1 баллов по шкале Caprini) с целью снижения вероятности послеоперационных ВТЭО после вмешательства и до выписки из стационара предписывалось ношение на нижних конечностях компрессионного трикотажа. У пациентов с более высоким риском ВТЭО (группы 2–6, 2–14 баллов по шкале Caprini), также согласно ОСТ 91500.11.0007-2003, кроме эластической компрессии нижних конечностей использовали алгоритм профилактики прямыми антикоагулянтами, а именно введением 1 раз в сутки под кожу живота 0,4 мл (4000 анти-Ха МЕ) эноксапарина натрия как доступного препарата группы низкомолекулярных гепаринов. Профилактическую гепаринизацию начинали за сутки до операции, после нее продолжали до полной активизации пациента (подъема и активной ходьбы).
Применение эноксапарина натрия считали эффективным в отсутствие состоявшихся тромботических событий в сосудах системы нижней полой вены (НПВ).
Для выявления состоявшихся послеоперационных ВТЭО проводили ультразвуковое ангиосканирование (УЗАС) си-стемы НПВ до операции, на следующий день после нее и далее не реже 1 раза за 3 сут. послеоперационного пребывания больного в стационаре.
Активность свертывающей системы крови в контексте риска развития ВТЭО изучали путем анализа в динамике времени инициации свертывания (Lag time, мин), пикового количества тромбина в образце (Peak thrombin, нмоль), времени достижения пика тромбина в образце (Time to peak/tt Peak – время, за которое в образце генерируется максимальное количество тромбина, мин) и эндогенного тромбинового потенциала (ЕТР, нмоль*мин) – количественных показателей интегральной оценки систем гемостаза, получаемых во время проведения теста генерации тромбина (ТГТ). Образцы крови забирали у пациентов за 24 ч до начала операции, через 1 ч после нее, далее в конце 1-й и 2-й послеоперационных недель, затем перед выпиской. Контрольные измерения показателей проводили в образцах плазмы крови здоровых добровольцев (группа контроля, n=30). Для постановки ТГТ использовали автоматизированный анализатор коагуляции Ceveron® alpha TGA и набор реагентов Ceveron® TGA (производитель – «Technoclone Herstellung von Diagnostika und Arzneimitteln GmbH», Австрия).
Статистическую обработку полученных данных выполняли с помощью программы «IBM® SPSS® Statistics» (версия 23 русскоязычная) и программы «Microsoft® Excel® 2010».
Результаты. Согласно данным ультразвукового сканирования сосудов системы нижней полой вены, у всех участников исследования ультразвуковые признаки тромботических осложнений в венозных сосудах системы НВП отсутствовали.
В группе 1 (очень низкий риск ВТЭО, 0–1 балл по шкале Caprini, n=18) при определении степени риска развития послеоперационных венозных тромбоэмболических осложнений у всех пациентов регистрировался только один фактор риска – «малая» операция, проведенная в рамках планового хирургического лечения и длившаяся не более 45 мин (показано в табл. 3).

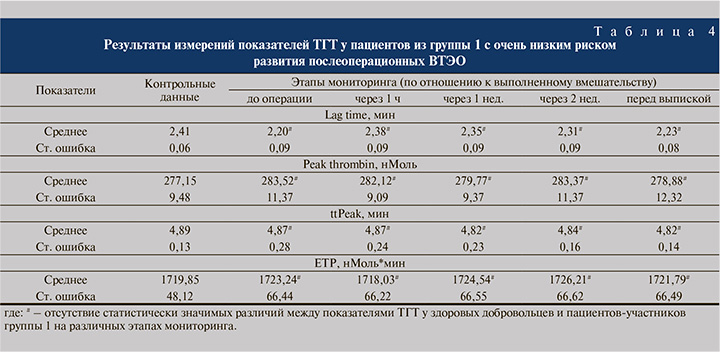
Данные о послеоперационных изменениях показателей ТГТ у мужчин и женщин группы 1 представлены в табл. 4. Как видно из этой таблицы, на всех этапах периода наблюдения значения рассматриваемых показателей ТГТ статистически значимо не отличались от контрольных величин и результатов измерений до операции.
В группе 2 (низкий уровень риска ВТЭО, 1–2 балла по шкале Caprini, n=14), как показано в табл. 5, факторами риска ВТЭО послужили возраст старше 40 лет, продолжительная гормон-заместительная терапия (ГЗТ) и операция сама по себе.

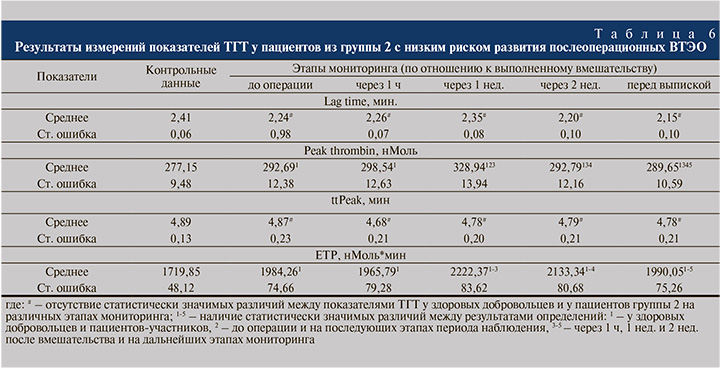
Как представлено в табл. 6, у мужчин и женщин группы 2 регистрировались следующие отклонения от физиологически оптимальных результатов ТГТ: 1) статистически значимое повышение Peak thrombin перед операцией на 5,3% до 292,69±12,38 нМоль, через 1 ч и через 1 нед. после вмешательства – до 298,54±12,63 и 328,94±13,94 нМоль соответственно; 2) статистически незначимое уменьшение ttPeak через 1 ч после операции на 3,9%; 3) увеличенный уровень ETP на 13,3% до 1984,26±74,66 нМоль*Мин (р<0,05) перед вмешательством и до 2222,22±83,62 нМоль*Мин через 1 нед. после него (р<0,05).
Риск развития ВТЭО у больных группы 3 (умеренный уровень риска ВТЭО, 3–4 балла по шкале Caprini, n=34) был связан с возрастом старше 40 лет (88,2%), ГЗТ (38,2%), хронической сердечной недостаточностью (ХСН, 26,5%), злокачественными новообразованиями (ЗНО, 26,5%), ожирением (5,9%). Факторами риска стали также хирургические вмешательства как таковые: «малые» (длительностью не более 45 мин) или «большие» (более 45 мин) (табл. 7).

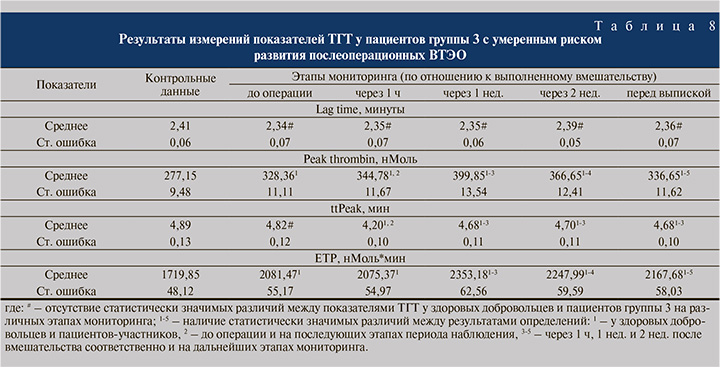
У пациентов группы 3 с умеренным риском ВТЭО, как видно из табл. 8, во-первых, были выявлены статистически значимо повышенные уровни Peak thrombin перед операцией, через 1 ч и через 1 нед. после нее, а также в конце наблюдения до 328,36±11,11 нМоль*Мин (на 15,6% против контрольного значения), до 344,78±11,67 нМоль*Мин, до 399,85±13,54 нМоль*Мин и до 336,65±11,62 нМоль*Мин соответственно; во-вторых, отмечено статистически значимое снижение ttPeak через 1 ч после операции и далее, в конце 1-й, 2-й и 3-й недель до 4,20±0,10 мин (на 14,1 и на 12,9% по отношению к контрольному и дооперационному уровням) и до 4,68±0,10–4,70±0,11 мин соответственно; в-третьих, выявлено увеличение ETP перед вмешательством и до конца периода наблюдения на 20,7–26,9% (р<0,05) с максимальным значением показателя в конце 1-й послеоперационной недели.
Факторами, способствующими развитию послеоперационных ВТЭО в группе 4 (высокий уровень риска ВТЭО, 5–8 баллов по шкале Caprini, n=34), стали возраст старше 40 лет (98,4% пациентов), ГЗТ (17,5%), ХСН (54,0%), дыхательная недостаточность (ДН, 1,6%), хронические обструктивные болезни легких (ХОБЛ, 1,6%), (ЗНО, 84,1%), варикозная болезнь нижних конечностей (ВБНК, 4,8%), ожирение (9,5%), воспалительные заболевания толстой кишки (ВЗТК, 3,2%), повышенный уровень антител к кардиолипину (1,6%), а также проведенные урологические операции (табл. 9), как «большие», так и «малые».

Как показано в табл. 10, у больных группы 4 с высоким риском развития ВТЭО наблюдали: 1) через 1 ч после операции снижение Lag time на 12,6% до 2,02±0,06 мин (р<0,05); 2) повышение уровня Peak thrombin на 23,3% до 361,22±8,37 нМоль перед вмешательством, до 392,84±9,19 нМоль (р<0,05) через 1 ч после него, до 474,98±11,17 нМоль (р<0,05) спустя еще 7 сут., до 394,38±9,28 нМоль (р<0,05) перед выпиской; 3) уменьшение ttPeak через 1 ч после операции на 13,7% до 4,15±0,07 мин и дальнейший рост показателя до 4,66±0,06 мин в конце наблюдения; 4) увеличенные уровни ЕТР перед вмешательством (на 17,7% до 2091,92±41,98 нМоль*Мин, р<0,05), через 1 ч и через 1 нед. после него (на 15,3% до 2468,59±47,23 нМоль*Мин; р<0,05), а также при завершающем определении (2318,25±65,51 нМоль*Мин; р<0,05).
У мужчин и женщин группы 5 (очень высокий уровень риска ВТЭО, 9–11 баллов по шкале Caprini, n=18) факторами риска ВТЭО (представлены в табл. 11) стали возраст старше 55 лет (100% больных), ХСН (72,2%), ХОБЛ (27,8%), ЗНО (88,9%), ВБНК (27,8%), ВЗТК (11,1%), ожирение (n=7; 38,9%), наличие в личном анамнезе тромбоза или ВТЭО (n=6; 33,3%), а также «малые» и «большие» оперативные пособия, выполненные участникам исследования.
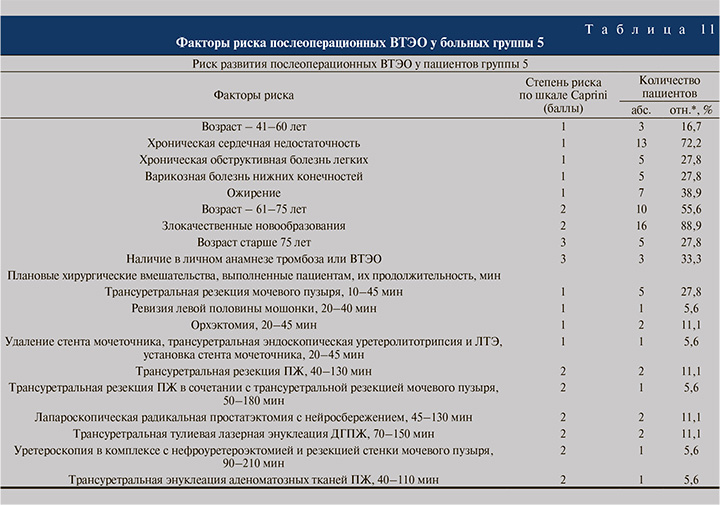
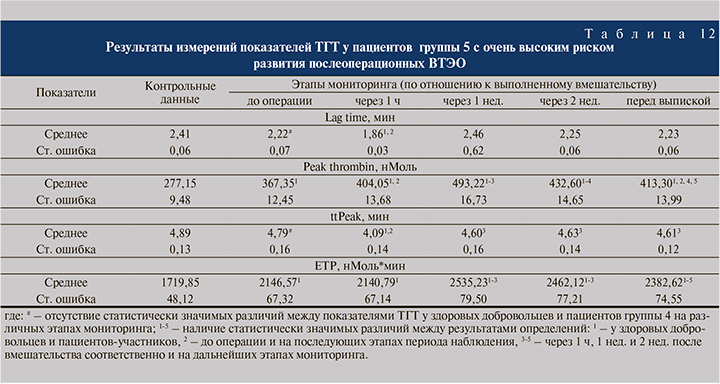
Как видно из табл. 12, в условиях очень высокого риска развития послеоперационных ВТЭО (группа 5) показатель Lag time до операции равнялся 2,22±0,07 мин (на 7,9% меньше, чем в группе контроля, р<0,05), спустя 1 ч после вмешательства снизился до 1,86±0,03 мин (р<0,05), в конце 1 нед. был полностью восстановлен; Peak thrombin был статистически значимо повышен перед оперативным лечением, через 1 ч после него, спустя еще 1 нед. и перед выпиской до 367,35±12,45, до 404,05±13,68 нМоль соответственно; величина ttPeak через 1 ч после вмешательства уменьшилась на 14,6% до 4,09±0,15 мин (р<0,05), в конце 1 нед. поднялась до 4,60±0,16 мин (р<0,05) и затем оставалась на этом уровне до конца наблюдения; показатель ETP был существенно и статистически значимо увеличен как перед вмешательством, так и после него.
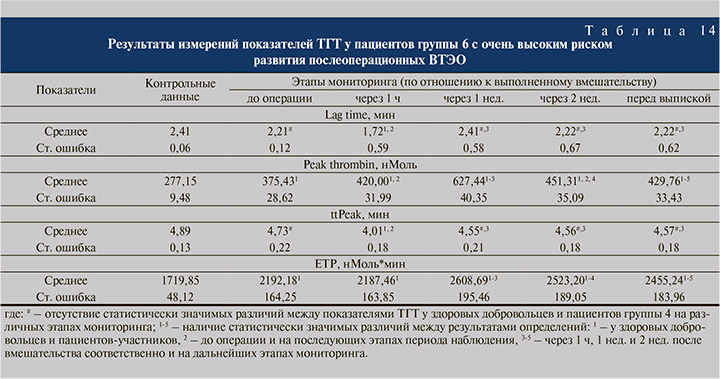
Факторами риска ВТЭО в группе 6 (чрезвычайно высокий уровень риска ВТЭО, 12-15 баллов по шкале Caprini, n=4) послужили возраст старше 68 лет (100% участников), ХСН (25,0%), ДН (25,0%), наличие ЗНО (50,0%), ожирение (n=2, 50,0%), ВБНК (n=1, 25,0%), ГЗТ (25,0%), недавние события, случившиеся за последний месяц: острое нарушение мозгового кровообращения (ОНМК, 25,0%) и эндопротезирование тазобедренного сустава (75,0%), а также проводимые хирургические вмешательства, (отображено в табл. 13).

У пациентов группы 6 (чрезвычайно высокий риск ВТЭО) наблюдались (показано в табл. 14): весьма выраженное снижение Lag time до 1,72±0,59 мин (на 28,6 и на 22,2% по отношению к контрольному и предоперационному уровням, р<0,05) через 1 ч после вмешательства; повышенные на 26,2–55,8% (р<0,05) уровни Peak thrombin до вмешательства и после него до конца периода наблюдения с максимально высоким значением показателя (627,44±40,35 нМоль) в конце 1-й послеоперационной недели; уменьшение ttPeak через 1 ч после хирургического лечения до 4,01±0,18 мин (на 18,0 и на 15,2% по отношению к контролю и результату измерений перед операцией, р<0,05); статистически значимое увеличение ЕТР перед вмешательством до 2192,18±164,25 нМоль*Мин (на 21,5% больше контрольного значения), а также через 1–3 нед. после операции (2608,69±195,46 нМоль*Мин, 2523,20±183,05 нМоль*Мин и 2455,24±183,96 нМоль*Мин соответственно).
Таким образом, у пациентов урологического профиля, находившихся на плановом хирургическом лечении, дополненном профилактическим курсом эноксапарина натрия, были выявлены вполне определенные ТГТ-признаки увеличенной активности свертывающей системы, отмеченные не только в послеоперационный период, но и до вмешательства. Выраженность изменений находилась в прямой зависимости от степени риска ВТЭО, т.е. от суммы баллов по шкале Caprini.
У участников исследования, только готовившихся к операции, регистрировался статистически значимый подъем на 5–26% максимально высокого количества тромбина, образующегося в процессе его генерации в образце плазмы (показатель Peak thrombin) и статистически значимое увеличение на 13,5–21,5% количества тромбина, образующегося в плазме крови за 1 мин (показатель ETP). В послеоперационном периоде наблюдали, во-первых, через 1 ч после вмешательства статистически значимое (на 9–28,6%) сокращение времени, необходимого для накопления количества тромбина, достаточного для образования первых нитей фибрина (показатель Lag time); во-вторых, статистически значимое увеличение пикового количества тромбина, образующегося в процессе его генерации в образце плазмы (показатель Peak thrombin), на 4,8–10,6% через 1 ч после вмешательства и на 11–40,2% в конце первой послеоперационной недели; в-третьих, сокращение времени генерации в образце максимального количества тромбина (показатель ttPeak) на 13–15%; в-четверты, рост количества тромбина, образующегося в плазме за 1 мин (показатель ETP). Также при анализе данных было отмечено, что все изменения показателей Lag time и ttPeak, пусть даже статистически значимые, совершались только в пределах соответствующих референсных интервалов. Напротив, уровни Peak thrombin и ETP до и после операции всегда и статистически значимо превышали соответствующие максимальные референсные значения.
Обсуждение. При всем разнообразии урологических операций, проведенных участникам исследования, различной степени их сложности, различном уровне риска ВТЭО (от очень низкого, обусловленного влиянием только одного фактора, до различных градаций высокого, имеющего мультифакторное происхождение), до- и послеоперационном смещении гемостатического баланса в сторону повышенной активности свертывающей системы по данным ТГТ, единых дозе и ритме введения эноксапарина натрия, от всех пациентов на фоне действия изучаемого препарата был получен один и тот же результат – отсутствие у каждого из участников исследования ультразвуковых признаков тромботических событий в сосудах системы нижней полой вены. Все это свидетельствовало о весьма высокой эффективности фармакологической профилактики послеоперационных ВТЭО в условиях применения эноксапарина натрия в разовой дозе, равной 0,4 мл, или 4000 анти-Ха МЕ, и вводимой 1 раз в сутки под кожу живота за 24 ч до операции и далее после нее вплоть до полной активизации больных.
В настоящее время специализированная медицинская периодика содержит только единичные публикации, посвященные анализу уровня активности свертывающей системы крови методом ТГТ до и после хирургического лечения пациентов урологического профиля, проведенного в условиях медикаментозной тромбопрофилактики препаратами группы низкомолекулярных гепаринов, в частности эноксапарина натрия, и в условиях постоянного ультразвукового ангиосканирования сосудов системы нижней полой вены [20]. Результаты наших исследований сопоставимы с данными, представленными в этих немногочисленных публикациях.
Требуют продолжения изучения вопросы изменений показаний ТГТ у оперированных больных без использования медикаментозной тромбопрофилактики и возможного влияния применения эноксапарина натрия на результаты теста.
Заключение. У пациентов урологического профиля, нуждающихся в хирургическом лечении, до операции и после нее практически всегда имеет место смещение гемостатического баланса в сторону преобладающей активности свертывающей системы крови. В таких условиях для профилактики развития послеоперационных ВТЭО целесообразно и патогенетически оправдано применение эноксапарина натрия в разовой дозе, равной 0,4 мл или 4000 анти-Ха МЕ, вводимой 1 раз в сутки под кожу живота за 24 часа до операции и далее после нее вплоть до полной активизации больных.



