Введение. Рак предстательной железы (РПЖ) занимает второе место по встречаемости среди онкологических заболеваний у мужчин. По данным на 2018 г., по всему миру зарегистрировано около 1,276 млн новых случаев заболевания, что составляет 7,1% от всех впервые диагностированных злокачественных эпителиальных образований в странах Запада [1]. В России РПЖ занимает второе место в структуре причин смертности от злокачественных новообразований [2].
Вследствие того, что используемый во всем мире анализ крови на ПСА в большей степени специфичен для определения самого факта наличия заболевания в простате, а не конкретно РПЖ, поиск новых маркеров РПЖ остается одним из приоритетных направлений развития урологии. Повышение уровня ПСА обнаруживается при доброкачественной гиперплазии предстательной железы (ДГПЖ), остром простатите [3] и даже при стандартном урологическом обследовании пациентов, включающем пальцевое ректальное исследование и трансректальное УЗИ [4]. Определение альтернативных маркеров, таких как proPSA или PCA3, основано на других принципах идентификации и имеет большую диагностическую точность, но из-за высокой стоимости и низкой доступности выполняется лишь небольшим количеством лабораторий [5]. Скрининг и ранняя диагностика РПЖ, контроль прогрессирования опухоли и ее рецидива нуждаются в более точных, чем ПСА, онкомаркерах.
Одним из белков, экспрессируемых клетками предстательной железы, который может быть использован в диагностике РПЖ, является ангиотензинпревращающий фермент (АПФ).
Ангиотензинпревращающий фермент (пептидил-дипептидаза А, КФ 3. 4. 15. 1) – гликопротеин, расположенный на мембране клеток, выявляемый во многих тканях и жидкостях человеческого организма. К основным функциям АПФ относится контроль артериального давления, почечной гемодинамики и водно-электролитного гомеостаза. Соматическая (сАПФ) и тестикулярная (тАПФ) изоформы АПФ кодируются одним и тем же геном. Высокие уровни экспрессии сАПФ были обнаружены в эндотелии сосудов легких, а также эпителии кишечника, почек, придатков яичка, простаты и уретры [6]. Использование ингибиторов АПФ коррелировало с лучшими результатами лечения пациентов с различными опухолями, включая РПЖ [7].
Железистые эпителиальные клетки предстательной железы экспрессируют значительное количество АПФ. В семенной жидкости концентрация АПФ в 50 раз выше, чем в плазме [8]. Установлено, что при появлении в предстательной железе опухолевых клеток в ткани простаты снижается активность АПФ [9], поэтому фенотипирование АПФ в биоптате простаты может иметь клиническое (или диагностическое) значение.
Ранее проведенные исследования с моноклональными антителами (мАТ) к многочисленным конформационным эпитопам на поверхности человеческого АПФ показали, что паттерн связывания мАТ с АПФ – «конформационный отпечаток АПФ» – специфичен для каждой ткани [10, 11]. Более того, конформационный отпечаток АПФ простаты довольно сильно отличается от такового для АПФ легкого [10], что предполагает теоретическую возможность использования простатспецифического АПФ в качестве дополнительного раннего маркера РПЖ. Разница в концентрациях АПФ в семенной жидкости и плазме составляет всего 50 раз [8, 12], в отличие от ПСА, концентрация которого в крови и семенной жидкости может различаться до 1 млн раз [13], следовательно, можно ожидать, что частота ложноположительных результатов при определении АПФ простаты в крови пациентов с РПЖ будет значительно ниже, чем при количественном определении ПСА в крови.
Цель исследования: оценка возможности использования АПФ простаты в качестве нового маркера рака предстательной железы.
Материалы и методы. Пилотное исследование проведено на базах кафедры урологии и андрологии ФФМ МГУ им. М. В. Ломоносова, в урологической клинике и отделе лабораторной диагностики Медицинского центра МГУ им. М. В. Ломоносова, а также в ГБУЗ ГКБ № 31 и НИИ урологии и интервенционной радиологии им. Лопаткина. Исследование было одобрено локальными этическими комитетами. Все пациенты подписывали добровольное информированное согласие на участие в исследовании.
Ткань простаты для исследования получали от неродственных мужчин в ходе трансректальной биопсии простаты, а также из макропрепаратов после аденомэктомии при ДГПЖ и простатэктомии в случаях ранее верифицированного РПЖ. В первой из пяти изученных групп пациентов (описаны далее) были использованы образцы ткани ДГПЖ, полученные в ходе трансуретральной резекции (ТУР) простаты. Однако от этого способа получения ткани в ходе данного исследования было решено отказаться, так как АПФ в этих образцах денатурировал из-за тепловой коагуляции. Для сравнения использовали аутопсированную ткань предстательной железы от неродственных мужчин не старше 40 лет без ранее установленного урологического заболевания, погибших в результате несчастного случая (не позднее 12 ч после гибели).
В полученных образцах ткани простаты измеряли активность АПФ и проводили иммунохимическое фенотипирование. Трансректальная биопсия выполнялась пациентам по показаниям в соответствии с рекомендациями Европейского общества урологов [14].
У части пациентов (в клинике МНОЦ МГУ им. М. В. Ломоносова) трансректальную биопсию проводили с использованием сдвиговой эластографии (SWE) для выявления наиболее подозрительных участков, у другой части (в ГКБ № 31 ДЗМ) – под контролем гистосканирования [15]. Из наиболее подозрительных участков простаты осуществляли пункцию дополнительных 2–3 столбиков ткани. Эти образцы использовали для последующих измерений ферментативной активности и иммунохимической характеристики АПФ в этой области ткани предстательной железы.
У пациентов с ранее подтвержденным диагнозом РПЖ или ДГПЖ ткань простаты получали интраоперационно.
В случаях РПЖ образцы получали после извлечения макропрепарата. Также ткань ДГПЖ была получена от нескольких пациентов в ходе чреспузырной аденомэктомии после извлечения макропрепарата, данная ткань не подвергалась коагуляции в ходе операции. В дальнейшем проводили сравнение результатов патоморфологического исследования с иммуногистохимическим окрашиванием и данных фенотипирования АПФ в ткани простаты.
В целом в ходе исследования проведено фенотипирование АПФ в ткани простаты от 29 пациентов с патоморфологически верифицированной ДГПЖ, 17 пациентов с РПЖ, а также в 17 образцах аутопсированной ткани простаты молодых мужчин, погибших в результате несчастного случая, у которых ранее урологический анамнез не был отягощен. Из-за особенностей методики фенотипирования АПФ исследуемые пациенты группировались в соответствии с серией экспериментов, в которых использовался их биологический материал. В каждую серию экспериментов входили образцы от пациентов с РПЖ, ДГПЖ и здоровых мужчин, погибших от несчастного случая. Было сформировано 5 групп, причем в 4-й и 5-й группах анализ характеристик АПФ проводился до гистологического заключения по материалам биоптата для выдвижения гипотезы о предиктивной силе методик, основанных на АПФ, в отношении РПЖ и ДГПЖ. Поэтому в 4-й и 5-й группах количество пациентов с РПЖ и ДГПЖ не было уравнено.
В 1-й группе было изучено 4 образца от пациентов с РПЖ, 6 – с ДГПЖ, 2 – от здоровых мужчин, погибших в результате ДТП; во 2-й – 7, 7 и 4, в 3-й – 2, 7 и 2, в 4-й – 1, 5 и 6, в 5-й – 3, 6 и 3 образца соответственно.
Анализ активности АПФ. Активность АПФ в гомогенатах ткани простаты измеряли с помощью флуориметрического анализа с двумя субстратами АПФ: 2 мМ Z-Phe-His-Leu и 5 мМ Hip-His-Leu при рН 8,3 [16]. Аликвоты 20–40 мкл образцов добавляли к 200 мкл субстрата и инкубировали при 37ºC. Количественное определение продукта His-Leu проводили на основе его комплексообразования с о-фтальдиальдегидом.
Иммунологическая характеристика АПФ (иммуноферментная преципитация). 96-луночные планшеты покрывали различными антителами против АПФ, предварительно использовав внесенный козий IgG против мышиного IgG в качестве мостика, а затем инкубировали гомогенизированную ткань простаты. Активность оАПФ, преципитированного разными антителами, измеряли с помощью субстрата Z-Phe-His-Leu непосредственно в тех же лунках [17]. Локальные изменения структуры АПФ определяли как отношение активности АПФ, осажденного шестью различными мАТ к эпитопам N- и C-доменов, к активности АПФ, осажденного наиболее эффективным мАТ, – 9B9.
Статистическая обработка данных. Статистический анализ выполнялся в программах Statistica Biostat v. 6.3. Все данные представлены в виде среднего±стандартного отклонения. Значимость различий рассчитывалась с помощью критерия Манна–Уитни в STATISTICA.6 (StatSoft, Inc.). Статистически значимыми считались различия при вероятности ошибки выдвигаемой гипотезы менее 5% (p<0,05).
Результаты и обсуждение. Активность АПФ в ткани простаты при ДГПЖ и РПЖ. Данное исследование проводили в два этапа. Сначала свойства АПФ в ткани простаты оценивали в образцах от пациентов с ранее верифицированным диагнозом РПЖ или ДГПЖ.
Активность АПФ в гомогенатах из ткани РПЖ (в субстратах ZPHL и HHL) была существенно ниже, чем в нормальной такни простаты (рис. 1), что соответствует ранее опубликованным исследованиям [9, 18]. Однако активность АПФ в гомогенатах от пациентов с ДГПЖ не возрастала в отличие от данных, опубликованных другими авторами. Было выдвинуто предположение, будто при выполнении ТУР-простаты электрокоагуляция приводила к частичной денатурации АПФ и занижала реальную активность АПФ у пациентов с ДГПЖ. Так как активность АПФ оценивали с использованием двух субстратов (ZPHL и HHL), мы имели возможность подсчитать отношение скоростей гидролиза в каждом из них, т.е. отношение ZPHL/HHL. Молекула АПФ состоит из N- и С-доменов с разными активными центрами и различной эффективностью гидролиза натуральных и синтетических субстратов [19, 20]. Использованные субстраты ZPHL и HHL гидролизуются в этих активных центрах с разной скоростью: HHL быстрее гидролизуется С-доменом (в 9 раз), а ZPHL – с одинаковой скоростью обоими доменами [16]. Отношение скоростей гидролиза двух субстратов (ZPHL/HHL) служит характеристикой двух различных форм АПФ. Для соматического двухдоменного АПФ ZPHL/HHL составляет 1–1,5, для N-домена – 5–7, для С-домена – 0,6–0,8 [21]. Ранее отношение ZPHL/HHL использовалось для определения наличия ингибиторов АПФ в крови пациентов [21]. Однако этот параметр также может помочь обнаружить и инактивацию отдельного домена: увеличение ZPHL/HHL может указывать на инактивацию С-домена, уменьшение – на инактивацию N-домена, что непосредственно служит характеристикой фенотипа АПФ исследуемой ткани [21].
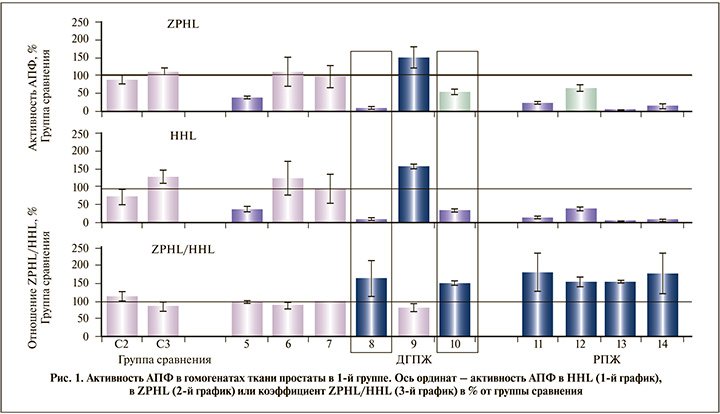
Соотношение ZPHL/HHL – достаточно однородный параметр для нативного АПФ в плазме крови или гомогенатах ткани и характеризуется очень низкой индивидуальной вариабельностью. Активность АПФ, определяемая одним субстратом в нормальной популяции, изменяется в 3–4 раза со стандартным отклонением около 30% [17, 22]. Однако стандартное отклонение для соотношения ZPHL/HHL составляет всего 3–5% [23].
В 1-й группе во всех образцах ткани РПЖ обнаружено достоверное (p=0,04) увеличение ZPHL/HHL, у большинства пациентов с ДГПЖ такие изменения фенотипа АПФ в образцах ткани не наблюдались (рис. 1). Однако было выявлено два образца от пациентов с ДГПЖ, которые характеризовались достоверным повышением соотношения ZPHL/HHL и снижением активности АПФ (в красной рамке на рис. 1).
Можно предположить, что снижение активности АПФ и увеличение ZPHL/HHL в 1-й группе служат ранним показателем генетической «поломки» клеток простаты при их малигнизации, предшествовавшей патоморфологически выявляемым изменениям. Такие специфические характеристики простатического АПФ могут быть использованы в качестве раннего маркера РПЖ. К сожалению, в дальнейшем пациенты 1-й группы с характеристиками АПФ, схожими с таковыми при РПЖ, отказались от дальнейшего участия по не зависимым от нас причинам.
Также в ходе исследования было высказано предположение, будто снижение активности АПФ в двух образцах ДГПЖ, полученных в ходе ТУР-простаты, могло быть обусловлено частичной денатурацией белка при термическом воздействии. В связи с этим в дальнейшем АПФ исследовался в образцах ткани простаты, полученных в ходе тонкоигольной биопсии или оперативно без применения коагуляции.
Во 2-й группе было исследовано по 7 образцов от пациентов с ДГПЖ и РПЖ. Были получены схожие результаты. Активность АПФ достоверно снижалась только в гомогенате ткани простаты с РПЖ (p=0,04). Соотношение ZPHL/HHL также достоверно увеличивалось только в образцах с РПЖ (p=0,031). Активность АПФ в тканях предстательной железы больных ДГПЖ была выше, чем в группе сравнения, соответствуя ранее полученным данным [9, 24]. Это могло подтверждать ранее выдвинутое предположение, будто при коагуляции во время ТУР-простаты происходила денатурация АПФ.

В серии экспериментов с образцами ткани пациентов 3-й группы получены сходные результаты: значительное снижение активности АПФ и значительное увеличение соотношения ZPHL/HHL для АПФ в ткани РПЖ. В этой группе был выявлен пациент (№ 3–8; рис. 2), чей фенотип АПФ соответствовал РПЖ, однако патоморфологически рак верифицирован не был. Мы продолжили за ним наблюдение после исследования, о чем будет сказано ниже.
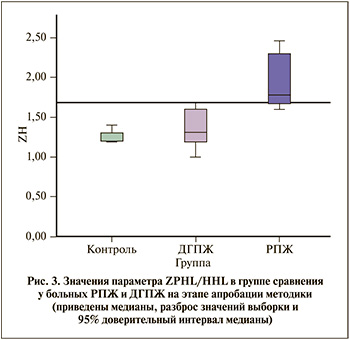 Проверка методики определения РПЖ на основании активности АПФ. Для подтверждения диагностической ценности исследования активности АПФ в дифференциальной диагностике РПЖ и ДГПЖ проведено фенотипирование АПФ на биоптатах еще двух групп пациентов. После обобщения всех ранее полученных данных активности АПФ простаты принято пороговое значение критерия ZPHL/HHL для постановки диагноза РПЖ >1,6 (рис. 3). Патоморфологическое исследование проводили одновременно с фенотипированием АПФ, таким образом, первоначальное количество образцов с РПЖ и ДГПЖ во время проведения экспериментов известно не было. Предварительный диагноз ставили на основании исследования АПФ, затем сравнивали с результатами патоморфологического исследования с иммуногистохимическим окрашиванием.
Проверка методики определения РПЖ на основании активности АПФ. Для подтверждения диагностической ценности исследования активности АПФ в дифференциальной диагностике РПЖ и ДГПЖ проведено фенотипирование АПФ на биоптатах еще двух групп пациентов. После обобщения всех ранее полученных данных активности АПФ простаты принято пороговое значение критерия ZPHL/HHL для постановки диагноза РПЖ >1,6 (рис. 3). Патоморфологическое исследование проводили одновременно с фенотипированием АПФ, таким образом, первоначальное количество образцов с РПЖ и ДГПЖ во время проведения экспериментов известно не было. Предварительный диагноз ставили на основании исследования АПФ, затем сравнивали с результатами патоморфологического исследования с иммуногистохимическим окрашиванием.
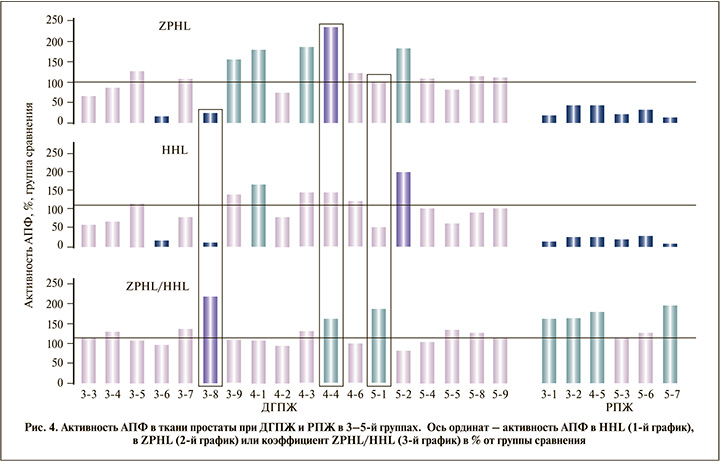
В ходе этой серии экспериментов снова было показано, что в случае РПЖ активность АПФ значительно снижается, в то время как соотношение ZPHL/HHL значительно увеличивается (рис. 4).
В образцах одного пациента 4-й группы (№ 4–4) и одного – 5-й (№ 5–1) была гистологически установлена ДГПЖ, однако отношение ZPHL/HHL было увеличено (как у пациентов с РПЖ). За этими пациентами велось тщательное наблюдение для выявления причин несоответствия биохимического и гистологического диагнозов. Данные этих пациентов будут представлены ниже.
Конформационный фингерпринтинг АПФ в ткани простаты. Ранее показано, что характер осаждения АПФ с моноклональными антителами – высокочувствительный инструмент для выявления локальных изменений на поверхности молекулы АПФ, связанных с денатурацией, ингибированием, мутацией или тканевой принадлежностью [25]. Чтобы оценить изменение структуры АПФ при патологических изменениях в простате, проведен конформационный фингерпринтинг АПФ с помощью панели мАт против различных участков на N- и С-доменах АПФ [25].
Доля АПФ, связанного антителами 3A5, i2H5, 5F1, 4E3, достоверно не отличалась от таковой группы сравнения. Однако доля АПФ, связанного мАТ 3F10, достоверно повышалась в образцах с РПЖ, особенно – ДГПЖ (рис. 5). Повышение соотношения 3F10/9B9 сохранялось в 4-й и 5-й группах.
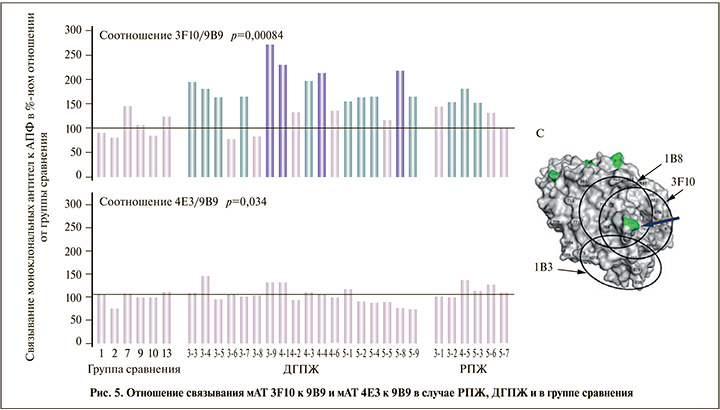
В 3–5-й группах соотношение 4E3/9B9 не отличалось от группы сравнения для АПФ из тканей ДГПЖ и РПЖ, однако соотношение 3F10/9B9 достоверно возрастало относительно группы сравнения в большинстве образцов ДГПЖ и РПЖ (169%, p=0,0084 и 144%, p=0,0034 соответственно). Это может свидетельствовать о возможности использования соотношения 3F10/9B9 в качестве нового маркера развития тканевой гиперплазии независимо от ее характера. Эпитоп для мАТ 3F10 включает потенциальный участок сиалирования Asn 731 на С-домене [10, 26], изменения в котором могут объяснить увеличение отношения 3F10/9B9. Повышенное сиалирование при опухолевой трансформации, препятствующее апоптозу опухолевых клеток, связывают с повышенной экспрессией сиалотрансфераз [27, 28]. Клеточная и тканевая специфичность этих ферментов предполагает наличие уникального «сиалома» (вероятно, и у злокачественных клеток), который можно использовать при идентификации клеток [29].
Выдвинутое предположение, будто наблюдаемые изменения в связывании мАТ 3F10 с АПФ в ткани простаты при ДГПЖ и РПЖ (рис. 5) вызваны гиперсиалированием АПФ, может подтверждаться лучшим связыванием этого мАТ с более сиалированным АПФ плазмы крови [11].
Наблюдение за пациентами. В ходе исследования выявлены 5 пациентов с гистологическим диагнозом ДГПЖ и характеристиками АПФ, соответствовавшими РПЖ. По независимым причинам двое пациентов отказались от дальнейшего наблюдения. За оставшимися тремя пациентами с повышенным показателем ZPHL/HHL было продолжено наблюдение. У двух из них (№ 3–8 и № 5–1) присутствовали выраженные симптомы нижних мочевых путей и обструктивный тип мочеиспускания. В связи с этим пациентам было выполнено оперативное лечение: ТУР-простаты – для пациента 3–8 и чреспузырная аденомэктомия ввиду большого объема железы и высокого анестезиологического риска – для пациента 5–1. При гистологическом исследовании операционного материала этих пациентов РПЖ выявлен не был. За третьим пациентом (№ 4–4), у которого отсутствовали выраженные симптомы со стороны нижних мочевыводящих путей и которому не требовалось проведения операции, было продолжено наблюдение. Через год после первичной трансректальной биопсии предстательной железы в связи с повышением уровня общего ПСА и высокой вероятностью РПЖ по характеристикам АПФ простаты пациенту № 4–4 выполнена сатурационная биопсия предстательной железы, выявившая РПЖ pT1cN0M0, сумма баллов по Глисону – 3+3=6. Пациенту была выполнена робот-ассистированная простатэктомия. При изучении удаленного макропрепарата патоморфологический диагноз был подтвержден. Таким образом, благодаря результатам исследования АПФ у пациента № 4–4 был своевременно выявлен РПЖ на ранней стадии. Прогноз продолжительности жизни данного пациента наиболее благоприятный.
С учетом вышеизложенных особенностей пациентов с выявленными несовпадениями патоморфологического диагноза и фенотипа АПФ становится понятной необходимость их дальнейшего наблюдения. Так как исследование фенотипа простатического АПФ в имеющейся выборке соответствовало диагнозу РПЖ, а пациенты со спорными показателями, а именно несовпадением показателей АПФ и результатов биопсии, требуют к себе повышенного внимания ввиду возможного наличия изменений, предшествовавших малигнизации клеток простаты. Клинический случай пациента 4–4 подтверждает целесообразность пристального наблюдения за урологическими пациентами в случае несовпадения результатов оценки АПФ и патоморфологического исследования. Такие пациенты заслуживают пристального внимания и дальнейшего более подробного обследования урологом, что может обеспечить максимально раннее выявление РПЖ.
Заключение. Определение активности АПФ и его конформации в биоптатах простаты имеет потенциал раннего диагностического маркера РПЖ или дифференциально-диагностического критерия РПЖ. При РПЖ активность АПФ предстательной железы достоверно снижается. При этом выраженно повышается уровень отношения ZPHL/HHL, который при ДГПЖ и в группе сравнения не менялся. При возникновении гиперпластических заболеваний в предстательной железе (ДГПЖ, РПЖ) происходит изменение сиалирования АПФ, что отражается в связывании с мАТ 3F10. Данные изменения не наблюдаются в ткани простаты без ДГПЖ или РПЖ. При выявлении у пациента свойств АПФ простаты, характерных для РПЖ, при отрицательном результате патоморфологического исследования требуется более пристальное и подробное наблюдение за ним. Таким образом, пациенты, у которых при первичной биопсии простаты не был выявлен РПЖ, однако исследование фенотипа АПФ в простате говорит об обратном, могут быть отнесены к группе повышенного риска развития онкологического заболевания в предстательной железе. Однако ввиду малой выборки пациентов диагностический потенциал параметров АПФ простаты в отношении РПЖ и ДГПЖ требует подтверждения на большем числе пациентов в рамках дальнейших исследований для определения истинной предсказательной силы методик.



