Введение. Около 8% супружеских пар в России не имеют детей из-за нарушения репродуктивной функции мужчины. С учетом неблагоприятной демографической ситуации в стране проблема бесплодия требует особого внимания. Одной из причин нарушения мужской фертильности служит избыточная продукция активных форм кислорода (АФК), встречающаяся среди 30–80% мужчин из супружеских пар с бесплодием [1]. Наиболее значимыми причинами окислительного стресса в семенной жидкости считаются инфекционно-воспалительные заболевания половых органов у мужчины, в частности хронический бактериальный простатит, а также варикоцеле, аутоиммунные реакции против сперматозоидов, действие неблагоприятных экологических факторов репротоксикантов [2]. Для обеспечения нормального функционирования сперматозоидов важен баланс АФК [3]. В низких (физиологических) концентрациях они регулируют такие ключевые процессы, как подвижность и гиперактивация сперматозоидов, капацитация, акросомная реакция, слияние мембраны сперматозоида с оолеммой. Через АФК-зависимые сигнальные пути регулируется экспрессия генов и активация белков, необходимые для пролиферации и дифференцировки незрелых мужских половых клеток, для созревания сперматозоидов [4]. В случаях когда возможностей антиоксидантной системы недостаточно для нейтрализации негативного влияния повышенного уровня АФК, возникает окислительный стресс, приводящий к нарушению работы редокс-сигнальных систем, к прямому повреждению белков, липидов и ДНК, а также к инициации апоптоза [5].
В семенной жидкости основным источником АФК служат лейкоциты и незрелые сперматозоиды, продукция супероксида которыми осуществляется либо системой НАДФН-оксидазы, либо в результате утечки из дыхательной цепи митохондрий [6, 7]. В норме концентрация лейкоцитов в семенной жидкости в среднем варьируется от 0,1 до 0,5 млн/мл (референсное значение, согласно ВОЗ (2010), до 1 млн/мл). Лейкоциты примерно в равной степени представлены нейтрофилами и макрофагами, и оба типа клеток активно продуцируют свободные радикалы. Наличие данных клеток в эякуляте необходимо для элиминации неполноценных форм сперматозоидов и незрелых половых клеток, а также для противомикробной защиты. Повышенная продукция АФК лейкоцитами стимулирует продукцию супероксидного анион-радикала самими сперматозоидами, таким образом, лейкоцитарные свободные радикалы действуют не только напрямую, но и опосредованно, а также через продукцию провоспалительных цитокинов, причем важен не показатель концентрации лейкоцитов, а именно количество АФК, который ими продуцируется.
Существует ряд методик, позволяющих оценивать кислородный метаболизм нейтрофилов. Наиболее широко используемым ввиду простоты исполнения и отсутствия необходимости применения дорогостоящего оборудования стал НСТ-тест в различных вариациях, однако имеющий ряд недостатков: он не позволяет зарегистрировать выработку АФК в динамике, регистрация результатов посредством визуальной микроскопии увеличивает количество субъективных ошибок и не позволяет проводить много исследований [8].
Для оценки функциональной активности лейкоцитов более перспективен метод хемилюминесценции в присутствии хемилюминесцентных активаторов, таких как люминол или люцигенин. Хемилюминесцентный протокол оценки уровня АФК лейкоцитов спермы рекомендован лабораторным Руководством ВОЗ по исследованию семенной жидкости [9] и основан на исследованиях АФК в эякуляте, выполненных ранее [10, 11]. Суть его заключается в измерении интенсивности хемилюминесценции в присутствии люминола, стимула нейтрофилов (форбол-12-миристат-ацетат, опсонизированный зимозан или N-формилметионил-лейцил-фенилаланин) и пероксидазы из корня хрена. В итоге регистрируется сигнал, пропорциональный концентрации пероксида водорода. Финальным результатом служит условное количество нейтрофилов в семенной жидкости, генерирующее определенный аналитический сигнал. По мнению авторов, эти протоколы имеют ряд существенных недостатков – как методических, так и принципиальных. Главным недостатком является представление функциональной активности (количества продуцированных лейкоцитами АФК) в единицах числа лейкоцитов. Кроме того, хемилюминесцентная система с пероксидазой из корня хрена позволяет оценивать только продукцию пероксида водорода без учета еще одного очень важного кислородного метаболита – гипохлорита.
Цель исследования – оценка активности лейкоцитов как основного источника АФК в семенной жидкости пациентов с нормо- и пато(зоо)спермией при помощи оригинальной методики, разработанной для оценки радикалпродуцирующей функции нейтрофилов крови [11] и адаптированной для анализа семенной жидкости.
Материалы и методы. В исследовании приняли участие 95 мужчин репродуктивного возраста, обратившихся в ФГБНУ «Медико-генетический научный центр им. академика Н. П. Бочкова» (Москва) с целью спермиологического обследования. Материалом для исследования стали образцы нативного эякулята, полученные путем мастурбации после половой абстиненции в течение 3–6 дней. Стандартное спермиологическое исследование проводили согласно рекомендациям Руководства ВОЗ (2010) [9]. Хемилюминесцентные измерения проводили на 12-канальном хемилюминометре Lum-1200 (ООО «ДИСофт», Россия).
Пробоподготовка спермы включала отделение клеточных компонентов от спермоплазмы. Образец эякулята центрифугировали при 1000 g в течение 10 мин с последующим двукратным центрифугированием клеточного осадка с 0,9%-ным раствором NaCl в объемном соотношении 1:2 по 10 мин. Все манипуляции – от взятия материала до анализа активности нейтрофилов – занимали не более 120 мин.
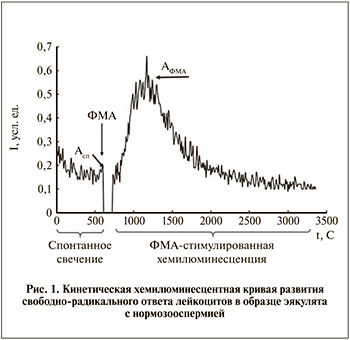 Оценка радикал-продуцирующей активности лейкоцитов. В кювету, содержавшую раствор Хенкса (рН 7,4), стабилизированный HEPES (все реагенты здесь и далее Sigma-Aldrich, США) и люминол, помещали аликвоту дважды отмытых клеток и регистрировали спонтанную хемилюминесценцию в течение 10 мин, затем вносили стимул – (форбол-12-миристат-13-ацетат [ФМА]) и регистрировали ответ в течение не менее 60 мин. Пример кинетической кривой для практически здорового пациента с нормозооспермией приведен на рис. 1. Из кривой определяли нормированные (деленные на количество лейкоцитов) уровни базальной А*сп и стимулированной хемилюминесценции А*ФМА.
Оценка радикал-продуцирующей активности лейкоцитов. В кювету, содержавшую раствор Хенкса (рН 7,4), стабилизированный HEPES (все реагенты здесь и далее Sigma-Aldrich, США) и люминол, помещали аликвоту дважды отмытых клеток и регистрировали спонтанную хемилюминесценцию в течение 10 мин, затем вносили стимул – (форбол-12-миристат-13-ацетат [ФМА]) и регистрировали ответ в течение не менее 60 мин. Пример кинетической кривой для практически здорового пациента с нормозооспермией приведен на рис. 1. Из кривой определяли нормированные (деленные на количество лейкоцитов) уровни базальной А*сп и стимулированной хемилюминесценции А*ФМА.
На кривой, приведенной на рис. 1, имеются две фазы: спонтанное (базальное) свечение, уровень которого определяли на 10-й минуте начала регистрации; ФМА-стимулированное свечение, амплитуду которого определяли в максимуме.
Статистическую обработку данных проводили, используя программный пакет STATISTICA v.10 («StatSoft», США). Результаты представлены в виде медианы и межквартильного размаха. Наличие статистически значимых различий между группами определяли с помощью непараметрического критерия Манна–Уитни. Различия признавали статистически значимыми при уровне вероятности p<0,05.
 Результаты. Радикал-продуцирующая активность лейкоцитов в семенной жидкости. По результатам спермиологического исследования пациенты разделены на следующие группы: 1) нормозооспермия (n=12), 2) астенозооспермия (n=17), 3) астенозооспермия+лейкоспермия (n=11), 4) астенотератозооспермия (n=28), 5) астенотератозооспермия+лейкоспермия (n=15). Из исследования исключены пациенты с нормозооспермией, имевшие лейкоспермию, и пациенты с тератозооспермией или олигоастенотератозооспермией, поскольку они представляли собой малочисленные группы (по 4 человека в каждой). В группе нормо- и патозооспермии содержание лейкоцитов составило от 0,3 до 1,0 млн/мл, в группе с лейкоспермией – от 1,5 до 8 млн/мл.
Результаты. Радикал-продуцирующая активность лейкоцитов в семенной жидкости. По результатам спермиологического исследования пациенты разделены на следующие группы: 1) нормозооспермия (n=12), 2) астенозооспермия (n=17), 3) астенозооспермия+лейкоспермия (n=11), 4) астенотератозооспермия (n=28), 5) астенотератозооспермия+лейкоспермия (n=15). Из исследования исключены пациенты с нормозооспермией, имевшие лейкоспермию, и пациенты с тератозооспермией или олигоастенотератозооспермией, поскольку они представляли собой малочисленные группы (по 4 человека в каждой). В группе нормо- и патозооспермии содержание лейкоцитов составило от 0,3 до 1,0 млн/мл, в группе с лейкоспермией – от 1,5 до 8 млн/мл.
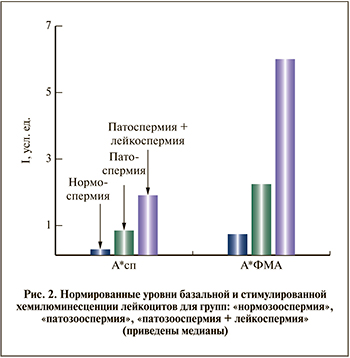
Между группами «астенозооспермия» и «астенотератозооспермия» и группами «астенозооспермия+лейкоспермия» и «астенотератозооспермия+лейкоспермия» статистически значимых различий по обоим показателям найдено не было, поэтому при дальнейшем анализе их объединяли в группы «патозооспермия» и «патозооспермия+лейкоспермия» соответственно. Для объединенных групп значимые различия выявлены по уровню как базальной, так и стимулированной хемилюминесценции (см. таблицу, рис. 2).
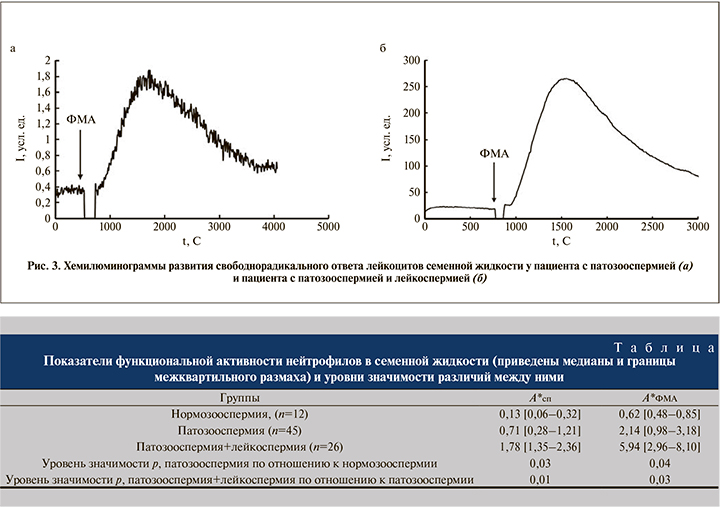
Примеры хемилюминограмм пациентов с патозооспермией, патозооспермией и лейкоспермией приведены на рис. 3. Видно, что во втором случае интенсивность базального и стимулированного свечения выше на два порядка величины.
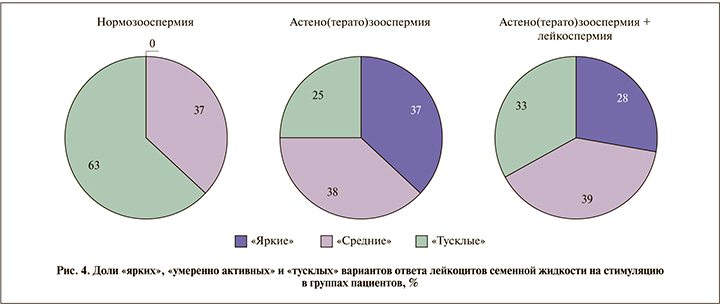
По уровню стимулированного ответа выделено три варианта хемилюминограмм: 1) «тусклый» ответ с АФМА <0,5 усл. ед., 2) «яркий» ответ с АФМА >2,0 усл. ед., 3) «умеренно активный» ответ с 0,5> АФМА >2,0 усл. ед. В группе «нормозооспермия» «ярких» хемилюминограмм не обнаружено, в группах «патозооспермия» и «патозооспермия+лейкоспермия» выявлено три варианта примерно в равном соотношении, относительно или близком к 1:1:1 (рис. 4).
Обсуждение. С целью исследования радикал-продуцирующей активности лейкоцитов в семенной жидкости нами адаптирована методика, ранее разработанная для исследования АФК, продуцируемыми нейтрофилами крови. Для всех исследованных образцах (содержание лейкоцитов 0,3 млн/мл и более) аналитической чувствительности было достаточно для надежной регистрации хемилюминограммы. В отличие от протокола, рекомендованного ВОЗ, предлагаемая методика позволяет определять суммарную продукцию АФК с учетом вклада не только пероксида водорода, но и гипохлорита. Аналитическими параметрами являются базальная и стимулированная активность лейкоцитов.
Базальная и стимулированная активность лейкоцитов между группами образцов с астенотерато- и астенозооспермией значимо не различалась, что позволило объединить данные группы для анализа. Лейкоциты в образцах с нормозооспермией в целом менее активны, чем в группе пациентов с патозооспермией, еще более активны лейкоциты при патозооспермии и лейкоспермии. Повышенная продукция АФК в образцах с лейкоспермией была ожидаемой, однако даже при нормальном содержании лейкоцитов продукция АФК в группе патозооспермии превышала таковую в группе нормоспермии примерно в 5 раз, что демонстрирует важность определения не только количества лейкоцитов, но и их активности. Вероятно, при патозооспермии имеется фактор, поддерживающий лейкоциты в активированном состоянии: цитокины, факторы роста и др., выяснение природы которого представляет собой отдельную задачу.
По амплитуде стимулированного ответа группы не являлись однородными. Можно выделить три варианта отклика лейкоцитов на стимул: «яркие», «умеренно активные» и «тусклые» хемилюминограммы. Для группы нормозооспермии получены хемилюминограммы только «тусклого» и «умеренно активного» ответа, что соответствует имеющимся данным, согласно которым избыточная продукция АФК лейкоцитами не сопутствует нормозооспермии. Однако в группах «патозооспермия» и «патозооспермия+лейкоспермия» наблюдали все три варианта отклика в примерно или относительно равной пропорции в каждой группе. Поскольку источником АФК в семенной жидкости служат не только лейкоциты, но и сперматозоиды [13], полученные данные свидетельствуют в пользу того, что не только свободнорадикальная активность лейкоцитов вносит вклад в патозооспермию: примерно в 60–65% случаев патозооспермии сопутствовала относительно невысокая активность лейкоцитов. По-видимому, исследование радикал-продуцирующей активности сперматозоидов в сочетании с оценкой антиоксидантного резерва спермоплазмы будет иметь не меньшее, а возможно и большее, значение для анализа роли окислительного повреждения в патоспермии.
Выводы
- Для анализа суммарного уровня АФК, продуцируемого лейкоцитами семенной жидкости, адаптирован протокол, ранее разработанный для анализа продукции АФК нейтрофилами крови. Аналитическое значение имеют нормированные уровни базальной и стимулированной хемилюминесценции.
- В группах «патозооспермия», «патозооспермия+лейкоспермия» уровень базальной продукции АФК лейкоцитами выше уровня в группе «нормозооспермия» примерно в 5 и 15, а уровень стимулированной продукции АФК в 3,5 и 9,5 раз соответственно; это свидетельствует о развитии окислительного стресса при патозооспермии за счет их повышенной активности лейкоцитов даже при нормальном их числе.
- Не только свободнорадикальная активность лейкоцитов может служить патогенным фактором снижения фертильности при пато(зоо-)спермии. Для оценки уровня окислительного повреждения немаловажной может оказаться информация о радикал-продуцирующей активности сперматозоидов.



