Введение. Неизбежным следствием растущей продолжительности жизни населения планеты является увеличение доли геронтологических заболеваний в общей структуре болезней современного человека [1, 2]. Большинство исследователей сегодня указывают на то, что в связи со старением имеется тенденция к увеличению распространенности различных расстройств мочеиспускания, в основе которых лежит анатомо-функциональная перестройка мочевого пузыря, степень которой прямо коррелирует с возрастом [3–6]. Данная трансформация проявляется снижением скорости потока мочи, увеличением объема остаточной мочи и развитием гиперактивности детрузора. Эта симптоматика универсальна, не зависит от пола и является едва ли не основной причиной снижения качества жизни людей пожилого и старческого возраста [7, 8].
Между тем этиология и морфогенез структурной реорганизации мочевого пузыря в связи с возрастом изучены недостаточно, а имеющаяся информация часто выглядит противоречиво [9, 10]. Так, нет четкого сущностного понимания этого процесса, а именно: считать ли его результатом биологического старения, выражающегося в истощении тканевых ресурсов мочевого пузыря, или рассматривать как следствие имеющихся «фоновых» нозоологий [11, 12]? В настоящее время с позиций патоморфологических изменений все исследователи единодушны лишь в неизбежности двух патологических процессов: прогрессирующей атрофии мышечных волокон и фиброза детрузора [13–15]. Детали же, касающиеся наличия и вектора структурной перестройки органного сосудистого русла, практически не освещены в литературе.
У мужчин дополнительным структурным преобразованиям, ассоциированным с возрастом, нижние мочевыводящие пути подвержены также вследствие инфравезикальной обструкции, обусловленной гиперплазией предстательной железы [16]. Несмотря на длительную историю изучения патогенеза ГПЖ, до сих пор не полностью раскрыты механизмы расстройств мочеиспускания, обусловленные этой нозоологией, а также морфологические детерминанты эволюции заболевания, а именно перехода от компенсации к декомпенсации нижних мочевых путей [17–19]. При этом важно отметить, что структурная перестройка мышечного слоя стенки мочевого пузыря при ГПЖ формируется на фоне прогрессирующих возрастных изменений как самого детрузора, так и его сосудистой системы, уровень компенсации кровотока в которой не может не отражаться на динамике структурных преобразований мочевого пузыря в ходе эволюции заболевания. Однако роль указанной сосудистой перестройки в поддержании компенсации детрузора при ГПЖ и «триггеры», способствующие ее срыву, мало обсуждаются в литературе [20–22]. Между тем полученные данные имели бы не только теоретическое, но и большое практическое значение, направляя вектор консервативной терапии ГПЖ в сторону ангиопротекции.
Цель исследования заключается в изучении структурных изменений детрузора и его сосудистого русла, ассоциированных с возрастом, и установлении роли выявленных закономерностей в клиническом течении ГПЖ.
Материалы и методы исследования. Материалом послужили фрагменты стенки мочевого пузыря, полученные при проведении аутопсий в патологоанатомическом отделении ГБУЗ ЯО ОКБ от 35 мужчин в возрасте 60–80 лет (группа «сенильный мочевой пузырь» – СМП), умерших от заболеваний, не относящихся к урологической и сердечнососудистой патологии, и не участвовавших в танатогенезе. Кроме того, участки этого органа были взяты у 35 мужчин той же возрастной категории, имевших ГПЖ без признаков декомпенсации мочевого пузыря (группа «компенсированная ГПЖ» – ГПЖк). В данных случаях ГПЖ не служила основной причиной смерти и выступала в качестве сопутствовавшего заболевания. Наряду с этим фрагменты мочевого пузыря были получены в результате интраоперационной биопсии у 25 мужчин того же возраста, оперированных по поводу хронической задержки мочи (объем остаточной мочи более 300 мл), двустороннего уретерогидронефроза как осложнений ГПЖ (группа «декомпенсированная ГПЖ» – ГПЖд). Во всех подобных случаях ГПЖ являлась основным заболеванием. В качестве контроля использовали материал из танатологического отделения ГУЗ ЯО ЯОБСМЭ, полученный от 20 лиц мужского пола в возрасте 20–30 лет, погибших в результате причин насильственного характера (группа «контроль»).
Материал для гистологического исследования получали путем вырезки участков органа из различных отделов мочевого пузыря (дно, верхушка, боковые стенки) на всю толщину стенки, включая паравезикальную клетчатку. Материал фиксировали в 10%-ном нейтральном формалине и заливали в парафин. Гистологические срезы толщиной не более 5 мкм окрашивали гематоксилин-эозином по Масону (для выявления коллагеновых волокон) с использованием бриллиантового зеленого, фукселином по Харту (для выявления эластических волокон), а также проводили ШИК-реакцию (реакция с Шифф-йодной кислотой) в модификации Мак Мануса. Иммуногистохимическое исследование (ИГХ) полученных при вырезке участков мочевого пузыря выполняли на парафиновых срезах с использованием мышиных моноклональных антител CD 34 (Cell Marque, USA), S100 (Cell Marque, USA), α-SMA (DAKO, USA). Оценку ИГХ препаратов проводили полуколичественным методом с учетом степени окрашивания в 10 полях зрения (×200). При морфометрическом исследовании сосудистого русла в артериях производили измерение толщины средней оболочки стенки (tunica media), в венах – толщины всей стенки. В обоих случаях толщину измеряли в мкм, кроме того, в крупных артериях измеряли толщину внутренней оболочки (интимы) в мкм. Для определения удельной площади структурных компонентов детрузора (мышечные волокна, межмышечная строма и сосуды) использовали стереометрическое исследование, применив специальную окулярную вставку с нанесенными на нее 100 равноудаленными точками. Цифровой материал обрабатывали с помощью программы STATISTICA с использованием t-критерия Стьюдента. Распределение полученных цифровых данных соответствовало нормальному. Полученные данные считали достоверными, если вероятность ошибки не превышала 5% (р<0,05).
Результаты. У мужчин пожилого и старческого возраста в сериях СМП и ГПЖк просвет внеорганных артерий был сужен атеросклеротическими бляшками на 30%. В крупных и средних внутриорганных артериях выявлялась гипертрофия гладкой мускулатуры средней оболочки (медии) с выраженной экспрессией в ней гладкомышечного актина α-SMA (рис. 1), а их внутренняя эластическая мембрана подвергалась расщеплению на несколько листков, т.е. гиперэластозу, что является морфологическим маркером артериальной гипертензии. В интиме некоторых артерий определялся «функциональный» слой косопродольной гладкой мускулатуры. Такие сосуды (артерии замыкающего типа) способны при необходимости за счет сокращения гладких миоцитов резко уменьшать приток крови. Однако данный слой нередко подвергался склерозу, вследствие этого толщина интимы возрастала в 5 раз (р<0,001) по сравнению с контролем. Просвет мелких артерий и артериол в обеих сериях суживался, их стенки утолщались, становились бесструктурными и замещались гиалином со снижением экспрессии α-SMA. В крупных внеорганных венах определялось неравномерное утолщение стенок вследствие гиперплазии и гипертрофии гладких миоцитов и повышением экспрессии в них α-SMA (рис. 2).
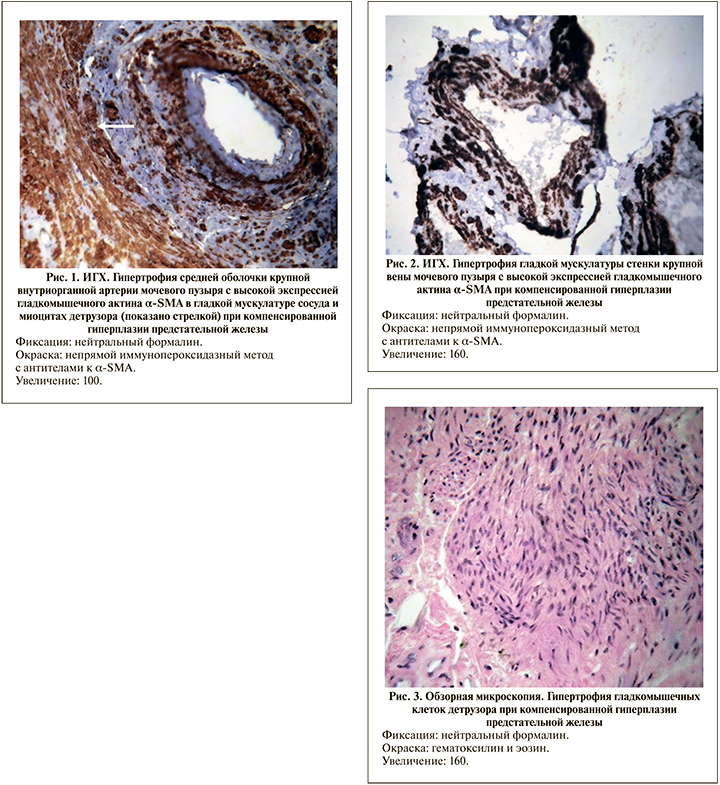
Морфометрическое исследование в сериях СМП и ГПЖк показало, что толщина медии крупных артерий увеличивалась в 5,2 раза (р<0,001), средних – в 2 (р<0,001), мелких артерий – в 1,4 (р<0,05), артериол в – 1,8 раза (р<0,05) по сравнению с контролем. В крупных венах толщина стенки возрастала в 4,6 раза, средних – в 2 (р<0,001), в мелких – в 1,8 (р<0,001), в венулах – в 1,6 раза (р<0,05) по сравнении с группой контроля.
У мужчин пожилого и старческого возраста при СМП в детрузоре фиксировались атрофические, склеротические изменения и разрушение эластического каркаса. Первые выражались в истончении гладкой мускулатуры, что отражалось на уменьшении ее удельной площади в 2 раза (р<0,001), вторые – в разрастании грубоволокнистой соединительной ткани в межмышечной строме с увеличением удельной площади в 1,5 раза (р<0,05), а третьи – в деструкции эластических волокон на отдельные фрагменты.
В серии ГПЖк на фоне атрофически-склеротических изменений определялись участки детрузора, характеризующиеся крупными размерами гладкомышечных клеток, имеющими большие гиперхромные ядра (рис. 3). В них отмечается высокая экспрессия α-SMA (рис. 1) по сравнению не только с СМП, но и с группой контроля. В таких группах мышечных клеток обнаруживалась хорошо развитая сеть эластических волокон. Кроме того, в межмышечной строме выявлялось увеличение численности капилляров с высокой экспрессией в них CD34. Заметные качественные изменения в детрузоре отражались на его количественных параметрах. Так, удельная площадь мышечных волокон детрузора увеличивалась в 1,3 (р<0,001) раза, сосудов – в 1,2 (р<0,05), а стромы уменьшалась в 1,1 (р<0,05) раза по сравнению с группой контроля. Наряду с этим в стенке мочевого пузыря отмечалась слабая экспрессия белка S100 в нервных волокнах (рис. 4) по сравнению с группой контроля, что отражает их повреждение и снижение нервной трофики.
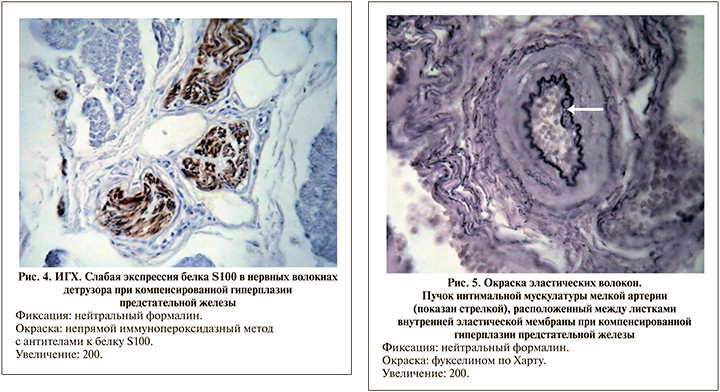
Во внутриорганных артериях мочевого пузыря при ГПЖк в отличие от контроля и СМП выявлялись особые миогенные, регуляторные структуры в виде интимальной мускулатуры, мышечно-эластических сфинктеров и полиповидных подушек Конти. Все они появляются в условиях нарушенного кровообращения в детрузоре и способствуют перераспределению крови в пользу гипертрофированных его участков. Интимальная мускулатура артерий состояла из гладких миоцитов, имевших вид пучков различной формы и размеров, покрытых листками из внутренней эластической мембраны (рис. 5). Мышечно-эластические сфинктеры представляли собой один или два гладкомышечных лепестка, располагавшихся в боковых ветвях артерий (рис. 6). Полиповидные подушки имели тонкую ножку или широкое основание, сформированные в результате выпячивания различных слоев стенки сосуда в просвет.
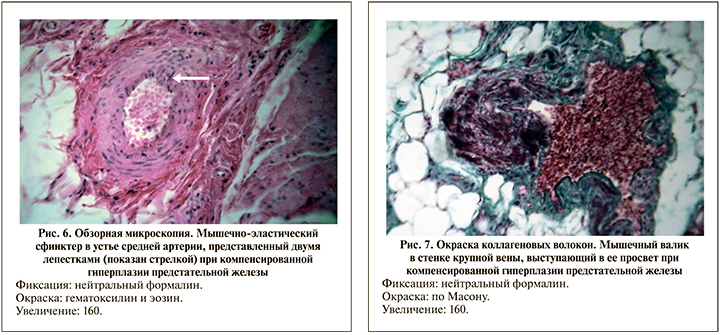
В венозном русле мочевого пузыря в серии ГПЖк также определялись мышечные, регуляторные образования, не встречавшиеся ни в контрольной серии, ни в серии СМП. Они были представлены мышечными «муфтами» внеорганных вен, мышечными валиками и клапанами внутриорганных вен. Венозные «муфты» представляли собой мощные гладкомышечные пласты с прослойками коллагеновых и эластических волокон, располагавшихся по всей окружности наружной оболочки крупных внеорганных вен, охватив их через определенные участки сосуда. Гладкомышечные валики в крупных и средних внутриорганных венах имели широкое основание и значительно выступали в просвет (рис. 7). Венозные клапаны представляли собой удлиненные полиповидные структуры, где в их основании обнаруживались скопления гладких миоцитов, а ножка и тело состояли из фиброзной ткани.
Мышечная оболочка мочевого пузыря в серии ГПЖд подвергалась грубым структурным изменениям, которые выражались в развитии атрофически-склеротических процессов. При этом атрофия и склероз имели не очаговый, как при СМП и ГПЖк, а диффузный характер. Довольно часто рубцовые поля занимали большие площади детрузора с замещением или выраженной атрофией мышечных волокон (рис. 8). Как показывают данные стереометрического исследования, удельная площадь мышечных волокон детрузора уменьшалась в 2,3 (р<0,001), а стромы увеличивалась в 1,3 (р<0,05) раза по сравнению с ГПЖк. Удельная площадь сосудов достоверно не изменялась. Экспрессия S100 в нервных волокнах детрузора оставалась слабой.
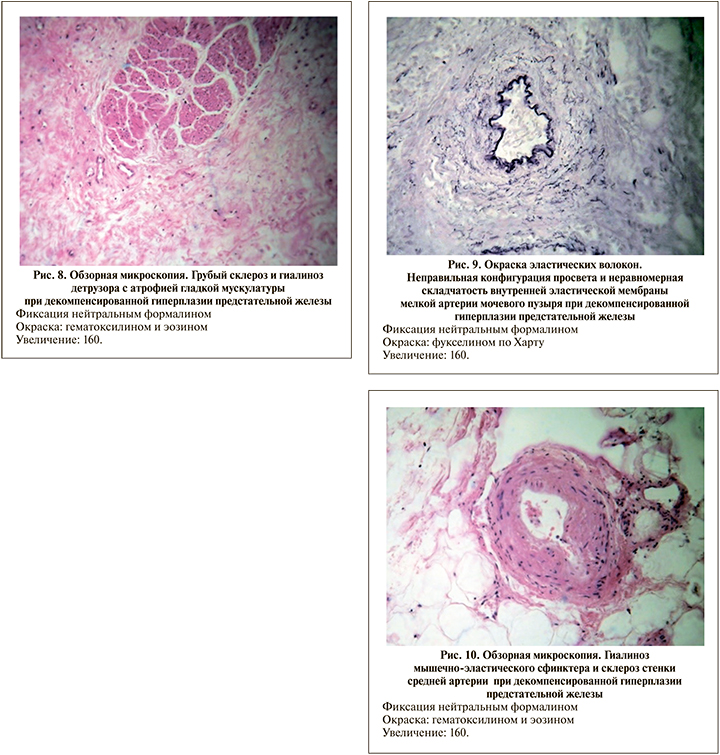
Структурные изменения сосудистого русла в данной серии имели общие морфологические черты с сериями СМП и ГПЖк: стенозирующий атеросклероз внеорганных артерий, гипертрофия и гиперэластоз крупных и средних внутриорганных артерий, гиалиноз мелких артерий и артериол. В то же время косопродольный функциональный слой гладкой мускулатуры, характерный для «замыкающих артерий», вообще не обнаруживался. Внутренняя эластическая мембрана артерий не только расщеплялась на несколько отдельных листков, но и имела неравномерную складчатость и извилистость (рис. 9). Это указывало на наличие ангиодистонических, паретических изменений сосудистой стенки.
Морфометрическое исследование в серии ГПЖд показало, что толщина медии крупных артерий увеличивалась в 5,1 раза (р<0,001), средних – в 2,2 (р<0,001), мелких артерий – в 1,5 (р<0,05), артериол в – 1,7 раза (р<0,05) по сравнению с контролем. В крупных венах толщина стенки возрастала в 4,4 раза, средних – в 2,1 (р<0,001), в мелких – в 1,9 (р<0,001), в венулах – в 1,5 раза (р=0,05) по сравнению с контролем, практически не отличаясь от цифровых показателей серий СМП и ГПЖк.
Регуляторные миогенные структуры, которые хорошо представлены в артериях и венах мочевого пузыря при ГПЖк, в случае ГПЖд подвергались регрессивным структурным изменениям. Так, среди артерий численность сосудов с данными образованиями снижалась. В сохранившихся образованиях определялись грубые склеротические изменения, существовавшие наряду с имевшимся склерозом и гиалинозом медии (рис. 10).
В венах различного уровня ветвления наблюдалось выраженное полнокровие, в мелких венах и венулах – морфологическая картина стаза. Кроме того, в просвете вен выявлялись обтурирующие тромбы, состоявшие из фибрина и эритроцитов. В некоторых венозных коллекторах встречались организованные тромбы, плотно сращенные со стенкой сосуда, не подвергшиеся асептическому аутолизу. Стенки вен различного калибра утолщались в результате замещения мощной гладкой мускулатуры грубоволокнистой соединительной тканью. Наряду с флебосклерозом склеротические изменения выявлены в описанных ранее регуляторных мышечных образованиях вен.
Обсуждение. Результаты наших исследований показали, что у мужчин пожилого и старческого возраста возникают выраженные морфологические изменения в сосудистом бассейне мочевого пузыря, «закладывающие фундамент» последующим его трансформациям в ходе эволюции гиперплазии предстательной железы. Так, при морфологическом исследовании выявляется структурная перестройка всего артериального русла начиная от внеорганных артерий с развитием атеросклероза и заканчивая перестройкой внутриорганных артерий, являющейся следствием артериальной гипертензии. Макрои микроангиопатия приводит к развитию хронической ишемии детрузора, инициирующей формирование очаговой атрофии гладкой мускулатуры, деструктивных изменений эластического каркаса, нарушений нервной трофики и склероза стромы [23, 24]. Патологические изменения ангиои гистоархитектоники сочетаются с включением сосудистых компенсаторно-приспособительных реакций, к одной из которых относится появление «замыкающих артерий», способствующих адаптации к расстройствам кровообращения в мышечном слое стенки пузыря [25, 26]. Присоединяющаяся ИВО на фоне ГПЖ приводит к рабочей гипертрофии ранее неизмененных мышечных волокон, в межмышечной строме которых возрастает степень капилляризации, необходимая для обеспечения активно функционирующей ткани. Таким образом, атрофически-склеротические изменения гладкой мускулатуры, инициированные хронической ишемией, сочетаются с гипертрофированными участками, что не противоречит принципу функциональной гетерогенности в работе одноименных структур [27], согласно которому любой орган, с одной стороны, в покое не использует для выполнения функции все структуры одновременно, с другой, при повышении функциональной нагрузки подключает в работу все имеющиеся структурные резервы. Для поддержания адекватного кровоснабжения гипертрофированных участков детрузора в артериальном русле мочевого пузыря формируется комплекс миогенных структур, способных регулировать нарушенную гемодинамику. К таким образованиям относятся пучки интимальной мускулатуры, мышечно-эластические сфинктеры и полиповидные подушки Конти. Повышение тонуса интимальной мускулатуры в сочетании с сокращением гладких мышц медии приводит к укорочению, скручиванию и гофрированию сосуда, что сопровождается уменьшением или полной блокадой кровотока как по ним, так и по дистально расположенным боковым ветвям. Функциональная роль сфинктеров сводится к регуляции потоков крови, поступающих из магистральной артерии в боковую ветвь. Полиповидная подушка приводит к полному прекращению кровотока по магистральному стволу и отходящим от него боковым ветвям сосуда. В основе появления данных образований лежит процесс миграции гладких миоцитов в интиму через «окна» во внутренней эластической мембране, стимулом которой являются гемодинамические расстройства. Таким образом, вследствие активной работы регуляторных структур при гиперплазии предстательной железы на фоне нарушения гемоциркуляции происходит нормализация транспорта крови по внутриорганным артериям мочевого пузыря в зависимости от функциональной потребности детрузора. Такое активное «переключение», осуществляемое данными структурами, обеспечивает нормальное кровообращение в пользу гипертрофированных участков детрузора в ущерб участкам, подвергшимся в ходе возрастной инволюции необратимым атрофически-склеротическим процессам. Наряду с артериальными структурами и в венозном русле мочевого пузыря появляются миогенные структуры, способные регулировать нарушенную гемодинамику и обеспечивать работу гипертрофированного детрузора. Мышечные «муфты», охватывающие сосуд сегментарно и циркулярно, и валики, формирующиеся во внутренней оболочке, в результате сокращения препятствуют венозному застою и развитию гипоксии, а при необходимости при расслаблении депонируют кровь. Аналогичная функциональная роль отводится и клапанному аппарату вен: предотвращение регургитации венозной крови и продвижение ее к сердцу или, наоборот, депонирование.
Однако прогрессирующие возрастные изменения в артериях в виде атеросклероза крупных артерий, а также гиалиноза мелких артерий и артериол, наблюдаемые при артериальной гипертензии, со временем приводят к нарастанию хронической гипоксии, которая способствует нарушению нервной регуляции сосудов и парезу артерий, усилению ангиосклероза и гиалиноза, а также появлению флеботромбоза. В результате склероза регуляторных структур артерий и вен наблюдается утрата их сократительной способности и регулирующей роли. Вследствие этого наблюдается грубый диффузный склероз детрузора с атрофией мышечных волокон.
Заключение. В ходе старения мужчины сосудистая система его мочевого пузыря и вторично детрузор подвергаются структурной перестройке, основным вектором которой следует считать атеросклеротические, ангиотонические и склеротические изменения сосудов разного уровня ветвления, включая склероз стенки венозных коллекторов и функционального слоя артерий «замыкающего» типа, а также атрофически-склеротическую трансформацию мышечной оболочки самого органа. При ИВО, обусловленной ГПЖ, детрузор и его сосудистое русло структурно перестраиваются уже на фоне имеющихся возрастных морфофункциональных трансформаций. Поэтому при компенсированной форме ГПЖ мышечный слой стенки мочевого пузыря подвергается очаговой гипертрофии в тех участках, которые ранее не подвергались атрофии и склерозу. Развитие локальной гипертрофии в условиях ишемии мочевого пузыря обеспечивается функционированием целого комплекса особых регуляторных миогенных образований в артериях и венах этого органа. При сохраняющейся ИВО детрузор подвергается уже выраженной атрофии и диффузному склерозу с образованием рубцовых полей, что является не только следствием хронической ишемии, но и результатом склероза регуляторных сосудистых структур, которые не только теряют способность к коррекции гемодинамики в детрузоре, но и, выступая в просвет, сами становятся механическим препятствием, усугубляя расстройства гемодинамики. Таким образом, срыв компенсаторных возможностей сосудистого русла детрузора, приводящий к атрофически-склеротической трансформации мышечного слоя мочевого пузыря, предопределяет нарушение его эвакуаторной функции и прогрессирование ГПЖ.



