Мочекаменная болезнь (МКБ) остается одним из наиболее распространенных урологических заболеваний, частота которого в мире достигает 10% [1, 2]. За последние десятилетия также отмечается рост заболеваемости МКБ [1, 3]. В настоящее время основным способом хирургического лечения больных с крупными, множественными и коралловидными камнями почек считается перкутанная нефролитотрипсия (ПНЛ) с эффективностью до 86–100% [4]. Однако, несмотря на высокую эффективность данной операции, для нее характерны различные интра- и послеоперационные осложнения [5–9], среди которых превалируют лихорадка (10,8%), кровотечение с необходимостью гемотрансфузии (7%) и селективной эмболизации (0,4%), повреждение плевральной полости (1,5%), сепсис (0,5%), травма внутренних органов (0,4%), мочевой затек (0,4%). Наличие сопутствующей патологии – почечной недостаточности, сахарного диабета, ожирения, заболеваний сердечно-сосудистой и дыхательной системы – повышает риск развития различных осложнений [10].
Одним из наиболее тяжелых осложнений ПНЛ является присоединение инфекции (от лихорадки до тяжелого сепсиса), что значительно отягощает течение послеоперационного периода, а иногда приводит к летальному исходу [11]. По данным литературы, смертность после оперативного вмешательства в течение первого месяца достигает 0,3%, а причиной в большинстве случаев является септицемия [5, 8]. Частота послеоперационной лихорадки, согласно широкому Европейскому исследованию, колеблется от 2,8 до 32,1% [5]. Столь широкий диапазон можно объяснить несколькими факторами. Во-первых, критерий определения лихорадки в опубликованных работах значительно различается. Так, T. Yang et al. [12] определили послеоперационную лихорадку как температуру тела более 38,5˚С в течение нахождения пациента в стационаре, тогда как в работах [13, 14] под ней подразумевали температуру выше 38,0˚С. Во-вторых, время между ПНЛ и определением температуры тела может влиять на выявляемость этого осложнения. R.O. Draga et al. [14] установили, что 39,8% пациентов имели лихорадку в течение первых 24 часов после ПНЛ, число которых спустя день после операции снизилось до 13,0%.
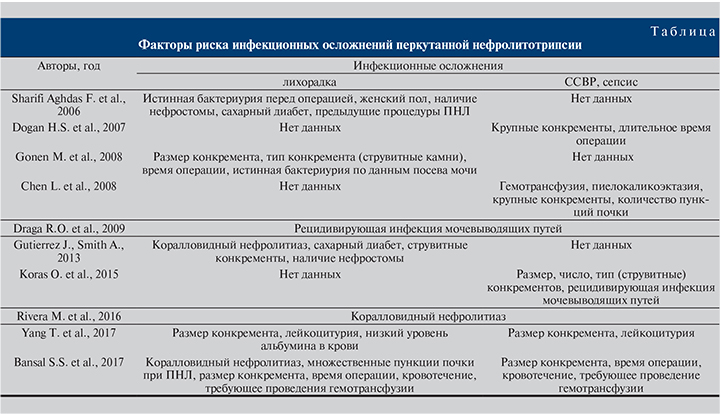
К настоящему времени проведен ряд исследований, посвященных анализу предоперационных факторов развития после операции лихорадки, синдрома системной воспалительной реакции (ССВР) и/или сепсиса. Установлено, что на развитие этих осложнений могут оказывать такие факторы, как исходная бактериурия, женский пол, наличие нефростомы или эпицистостомы, крупные и коралловидные камни, сахарный диабет, пожилой возраст и параплегия [14–20]. В исследовании [21] факторами риска лихорадки были определены время операции и количество использованной во время ПНЛ ирригационной жидкости. S. Sharifi Aghdas et al. [13] обнаружили, что женский пол, наличие нефростомы, а также положительные результаты посева мочи перед операцией сопряжены с высоким риском лихорадки после ПНЛ. Последующие исследования показали, что наличие в анамнезе ПНЛ, с другой стороны – сахарного диабета, положительных результатов посева мочи и выявление инфицированных камней также выступали факторами риска лихорадки [13–15, 19].
Много исследований сфокусировано на ССВР как истинном индикаторе послеоперационной инфекции. Его диагностируют при наличии двух из четырех симптомов: температура тела ниже 36 °С или выше 38 °С, ЧСС более 90 в 1 мин, ЧДД более или pCO2 менее 32 мм рт.ст., лейкоцитоз более 12×106/л или лейкопения менее 4×106/л.
H. S. Dogan et al. [21], подобно другим исследователям причин лихорадки, обнаружили, что более длительное оперативное вмешательство и крупные камни ассоциированы с риском развития ССВР. В исследованиях [14, 17, 22–27] отмечены дополнительные факторы, включая число доступов, интраоперационное переливание крови, женский пол и наличие гидронефроза. M. Gonen et al. [19] проспективно изучили результаты ПНЛ у 61 больного с целью определить факторы риска послеоперационной лихорадки. Из них у 10 (16,4%) развилась лихорадка, у 1 (1,6%) пациента был сепсис. Было установлено, что размер конкремента, длительность операции, инфицированные камни и бактериурия являются факторами риска развития послеоперационной лихорадки. В более крупном исследовании причин лихорадки после ПНЛ [28] с использованием данных мирового общества эндоурологов выявили, что у 10,4% из оперированных 5313 больных наблюдалось данное осложнение (выше 38,5˚С). Логистический регрессионный анализ показал, что развитие послеоперационной лихорадки связано с инфицированием камня, диабетом, наличием коралловидного камня, а также наличием нефростомы в предоперационном периоде [28]. Изучая причины возникновения ССВР после ПНЛ, L. Chen et al. [29] ретроспективно проанализировали результаты 209 операций и констатировали ССВР у 23,4% пациентов, сепсис – у 3 (1,4%). Они установили связь возникновения ССВР с переливанием компонентов крови, пиелокаликоэктазией и крупными камнями [29]. В исследовании [17] изучали пре- и интраоперационные факторы риска инфекционных осложнений ПНЛ. У 83 из 303 пациентов диагностирован ССВР и у 7,6% – сепсис. Анализ путем логистического регресса показал, что причиной развития ССВР и сепсиса были размер и число камней, наличие рецидивирующей инфекции мочевых путей и инфицированных камней. Работа [30] была посвящена изучению влияния числа лейкоцитов крови на вероятность развития лихорадки. Из наблюдаемых ими 303 пациентов у 133 (43,9%) после операции имео место повышение уровня лейкоцитов, который до ПНЛ в среднем составлял 7,73±2,01×106/л, после нее – 11,9 ±3,31×106/л, наблюдаемая разница – 4,2±2,99×106/л. По данным авторов, лейкоцитоз более 14,05×106/л и абсолютная разница с предоперационными показателями 5,25×106/л достоверно указали на возможность развития пост-ПНЛ-сепсиса.
M. Rivera et al. [31] опубликовали результаты изучения факторов риска развития инфекционных осложнений у 227 пациентов после ПНЛ. Из них 114 (50,4%) получали нитрофурантоин, 31 (13,7%) – триметоприм/сульфаметоксазол и 42 (18,6%) – фторхинолон. Средние сроки пред- и послеоперационной антибактериальной терапии составили 7 сут. У 64 (31,2%) пациентов перед операцией была выявлена бактериурия по результатам посева мочи. У 37 (16,3%) больных после ПНЛ диагностированы инфекционные осложнения: у 11 (5%) – пиелонефрит, у 21 (9%) – ССВР, у 2 (0,9%) – сепсис, у 2 (0,9%) – лихорадка, у 1 (0,4%) – инфицированная киста. На формирование инфекционных осложнений не оказывали влияния возраст, пол, размер камня, наличие диабета и длительность операции. У 67 пациентов имел место рост микроорганизмов на фоне камня. Из них у 15 (22%) развились инфекционные осложнения, которые наблюдались у пациентов с инфицированными (струвитными), коралловидными и с множественными камнями. В ходе многофакторного анализа выявлено, что исключительно наличие коралловидного нефролитиаза сопряжено с повышенным риском развития лихорадки (ССВР), сепсиса и иных инфекционных осложнений после ПНЛ.
В 2017 г. Y. Yang et al. [12] оценили результаты ПНЛ у 110 (67,1%) мужчин и 54 (32,9%) женщин. После оперативного лечения у 45 (27,4%) больных выявлен ССВР, у 20 (12,2%) – лихорадка. Мультифакторный анализ показал, что на развитие ССВР влияли размер камня и лейкоцитурия, которые наряду с уровнем альбуминов были факторами риска лихорадки. Авторы сделали вывод, согласно которому у пациентов с крупными камнями, инфекцией мочевыводящих путей, выявленной перед операцией, риск развития ССВР и лихорадки после ПНЛ выше, в то время как низкий уровень альбуминов крови являлся предиктором развития лихорадки после операции. По мнению авторов, низкое содержание альбумина может быть причиной недостаточного синтеза иммуноглобулина, а значит, неполноценного иммунного ответа, что в свою очередь повышает вероятность инфицирования бактериями или вирусами, обусловливающими развитие лихорадки или ССВР. S. S. Bansal et al. [32] опубликовали результаты проспективного исследования 580 пациентов, которым выполнялась ПНЛ. Три фактора достоверно коррелировали с развитием тяжелого сепсиса после ПНЛ: размер камня более 25 мм, время операции более 120 мин, кровотечение, требовавшее проведения гемотрансфузии. Факторы риска лихорадки, которая не осложнялась развитием сепсиса, помимо вышеперечисленных включали коралловидный нефролитиаз и наличие множественных пункций полостной системы почки.
J. Fan et al. [33] наблюдали 156 пациентов с инфекционными осложнениями после ПНЛ, у 135 из которых был диагностирован ССВР и у 21 – сепсис. Предрасполагающими факторами к их развитию были предоперационный позитивный анализ мочи (р<0,001), размер камня (р=0,025) и длительное время операции (р<0,001). Мультивариантный анализ показал, что первые два параметра и послеоперационная лейкопения (р<0,001) были независимо связаны с уросепсисом. В связи с этим у пациентов с высоким риском развития сепсиса авторы рекомендуют выполнять клинический анализ крови через 3 ч после ПНЛ. Исследователи [34] оценивали причины развития ССВР после ПНЛ. Они установили, что наличие инфекции в моче из МП до операции и из лоханки при ее пункции и позитивная культура камня коррелировали с развитием ССВР и выявлены у 33,9; 22,5 и 28,6% пациентов соответственно. В то же время эти анализы были позитивными только в 9,8; 3,3 и 4,2% случаев в группе без ССВР. C. Liu et al. [35] наблюдали сепсис у 20 (2,4%) из 834 оперированных больных, перенесших ПНЛ. Семнадцать пациентов выздоровели, трое умерли от полиорганной недостаточности. Мультивариантный анализ показал, что независимыми факторами развития сепсиса были женский пол (р<0,001) и диабет (р=0,001).
Согласно данным [36], изучившим результаты эндоурологических операций при нефролитиазе, позитивная культура камня ассоциировалась с высокой частотой развития сепсиса. Он наблюдался у 11 (3%) из 328 пациентов, подвергнутых уретероскопии (274) и ПНЛ (54). Из них 73% (8/11) имели позитивную культуру камня, а дооперационный посев мочи у всех был отрицательным. Послеоперационный сепсис развился у 8 (8%) из 96 больных с позитивной культурой камня и 3 (1%) из 328 пациентов с негативным анализом конкремента. Как утверждают авторы, результаты определения культуры камня более информативны для определения стратегии лечения послеоперационного сепсиса, чем данные дооперационного анализа мочи.
В работе [37] изучали предикторы развития сепсиса после ПНЛ. Из 206 оперированных пациентов они идентифицировали 45 человек с позитивной культурой камня (группа А) и сравнивали их с больными со стерильными камнями (группа В). Послеоперационный сепсис развился у 31,1% больных группы А и у 5,9% – группы В. Руководствуясь этими данными, авторы рассматривают наличие инфицированного камня независимым предиктором послеоперационного сепсиса при ПНЛ. По их мнению, определение инфекции в камне и резистентности к антибиотикам поможет в селекции эмпирической антибактериальной терапии больных высокого риска. A. Roushani et al. [38] также оценивали влияние позитивной культуры мочи и камня на развитие ССВР, который наблюдался у 13 (25,5%) пациентов. При этом ССВР чаще развивался у женщин, чем у мужчин: 45,5% против 10,3 (р=0,008). Позитивная культура камня определялась достоверно чаще при наличии инфекции мочи, чем в случае ее отсутствия (р=0,023). Синдром системной воспалительной реакции чаще наблюдался при позитивной культуре камня (р=0,001), поэтому авторы считают ее значимым предиктором послеоперационных инфекционных осложнений. В стремлении избежать использования ошибочной эмпирической антибактериальной терапии и снизить риск последующей резистентности микроорганизмов рекомендуется выбирать подходящее антибактериальное лечение, основываясь на результатах определения интраоперационной культуры камня.
Сведения различных авторов об установленных ими факторах риска развития лихорадки приведены в таблице.
Послеоперационный сепсис служит наиболее частой причиной летальности после ПНЛ. Он наблюдается в 0,3–7,6% случаев [5, 17, 39], а летальность достигает до 66% [11, 39]. С целью предотвращения данных инфекционных осложнений ПНЛ Американской ассоциацией урологов рекомендовано проведение антибактериальной профилактики пациентам перед операцией [40]. При ПНЛ она впервые стала использоваться при повышенном инфекционном риске – в условиях иммунодефицита или при положительных результатах посева мочи перед операцией. Однако M. Charton et al. [41] показали, что у пациентов с отрицательными посевами мочи, которые относились к группе низкого риска, в 35% случаев также были признаки послеоперационной инфекции. Несколько исследований, проведенных за последние 25 лет, выявили, что антибактериальная терапия пациентов с отрицательными показателями посевов мочи снижает риск послеоперационных осложнений. Первые работы в этой области в основном выполнялись в Европе. В одной из них, проведенной в 1989 г. [42], описывалось использование цефотиама в день операции и в течение двух дней после операции, которое снизило частоту послеоперационной инфекции после ПНЛ. В другой работе отмечено снижение частоты развития инфекции мочевых путей в послеоперационном периоде ПНЛ при профилактическом использовании аминогликозидов или цефалоспоринов [43]. В одном из ранних проспективных когортных исследований, проведенных А. Ф. Даренковым и соавт. в 1994 г. [44], изучено применение ципрофлоксацина в перкутанной и эндоскопической урологии в трех группах: внутривенное введение ципрофлоксацина (в день операции – первая группа), пероральное использование ципрофлоксацина (3–5 дней перед операцией; вторая группа) и без использования ципрофлоксацина (контроль). Пациенты, которые получали антибиотики, затем продолжили курс после операции в течение одной недели перорально. В первой группе случаев инфекции мочевых путей зарегистрировано не было, при использовании перорального ципрофлоксацина ее диагностировали в 17% наблюдений, в группе контроля – в 40%.
Т. С. Перепанова и соавт. [45] изучали режим антибиотикотерапии 30 больных, которые были разделены на две группы. В основной группе 1000 мг ципрофлоксацина вводили внутривенно капельно в течение всей операции, в контрольной группе ту же дозу антибиотика вводили болюсно в течение 5 мин. Уропатогены были выявлены в моче и в удаленном камне, но они чаще обнаруживались в конкрементах (60 против 40%). В основной группе у 2 больных было краткосрочное повышение температуры тела до 38,0°С без озноба, которая нормализовалась на 2-е стуки, ССВР не было. В контрольной группе также у 2 пациентов имела место гипертермия до 37,7–38,5°С, которая сохранялась в течение 4 дней. M. Seyrek [46] сравнили результаты использования сульбактам-ампициллина (n=95) и цефуроксима (n=96) при ПНЛ. Синдром системной воспалительной реакции наблюдался у 13 (43,3%) пациентов первой группы, у 17 (56,7%) – второй. Уросепсис имел место у 2 пациентов, один из которых умер. По мнению авторов, эти препараты могут безопасно использоваться для профилактики при ПНЛ. E. Tuzel et al. [47] наблюдали 73 пациента с отрицательными результатами дооперационного посева мочи. У 36 из них во время операции использовали однократное введение цефтриаксона, у 37 прооперированных после операции до удаления нефростомы использовали цефалоспорин III поколения. Лихорадка с температурой выше 38°С развилась у 4 (11,1%) пациентов первой группы и у 6 (16,2%) – второй. В послеоперационном периоде анализ мочи был позитивным для 9 пациентов: у 3 (8,3%) и 5 (13,5%) первой и второй групп соответственно.
Проспективное исследование [48] продемонстрировало, что частота появления ССВР снижалась у пациентов с отрицательными результатами посевов мочи в предоперационном периоде, которые получали ципрофлоксацин за неделю до ПНЛ. В проспективном рандомизированном исследовании пациенты с отрицательными результатами посевов мочи в предоперационном периоде принимали нитрофурантоин в течение 1 нед. до ПНЛ; частота ССВР на этом фоне была существенно ниже [49]. По данным [50], частота лихорадки и иных послеоперационных инфекционных осложнений у пациентов с отрицательными посевами мочи до операции, получавших профилактическую антибактериальную терапию, снижалась.
Однако вопрос о необходимости применения антибиотиков в периоперационном периоде у пациентов с отрицательными посевами мочи остается открытым. В рандомизированном двойном слепом проспективном исследовании [51] пациенты не получали антибиотики или принимали их только однократно перед ПНЛ. Установлено, что антибактериальная терапия не снижала частоты инфекционных осложнений.
Для профилактики инфекционных осложнений предложено несколько антибиотиков. Американское общество урологов в качестве терапии первой линии предлагает использовать второе поколение цефалоспоринов или аминогликозиды в сочетании с метронидазолом или клиндамицином. В качества альтернативы – ампициллин/сульбактам или фторхинолоны. Европейское общество урологов в качестве клинических рекомендаций предлагает использовать II или III поколение цефалоспоринов, триметоприм/сульфаметаксазол, фторхинолоны или защищенный аминопенициллин (с ингибитором бета-лактамаз) [52]. Как и в других урологических профилактических схемах лечения, применение антибиотиков, рекомендованных в данном случае, основано на результатах выявления микроорганизмов, которые высеиваются из мочевых путей. Оптимальные сроки, дозировка, продолжительность профилактической антибактериальной терапии при ПНЛ также остаются темой активной дискуссии. Американское общество урологов утверждает, что достаточно одной дозы антибиотика в день операции [40]. Рекомендации Европейского общества урологов менее четкие и говорят следующее: короткий курс может оказаться адекватным, однако продолжительность его все же должна быть конкретно определена в каждом отдельном случае [52].
В недавно опубликованной работе Т. С. Перепанова и соавт. [53] провели анализ результатов лечения 190 пациентов с коралловидными камнями почек после ПНЛ. Определяли влияние режимов послеоперационной антибактериальной терапии и профилактики, основываясь на результатах бактериологического исследования камня или мочи, взятых из лоханки при проведении ПНЛ, на частоту рецидивов инфекционных камней почек. Пациенты были разделены на три группы: в первой группе (n=58) больные получали профилактическую антимикробную терапию, назначенную после выписки на основании результатов микробиологического анализа камня, изъятого во время операции; во второй группе (n=59) при назначении лечения учитывали результаты посева мочи из лоханки; в третьей группе (n=73) больным со стерильными камнями и мочой профилактической антибактериальной терапии проведено не было. Антибиотики в послеоперационном периоде назначали в течение 6 мес.: первые 3 мес. – исходя из данных бактериологического исследования камня или мочи из лоханки, а именно в течение первых 10 дней каждого месяца. Последующие 3 мес. терапию назначали, основываясь на результатах посева мочи. В основном пациенты принимали фосфомицина трометамол 5,631 г (эквивалент 3,0 г фосфомицина), к которому в большинстве случаев уропатогены были чувствительными. При бактериологическом исследовании камня микроорганизмы выявлялись чаще, чем при исследовании мочи из лоханки: 102 (53,6%) против 88 (46,4%). Виды микроорганизмов в камне и моче из лоханки в основном не различались. Авторы установили, что бактериурия в послеоперационном периоде служит фактором, способствующим развитию как истинных, так и «ложных» рецидивов конкрементов (p<0,001). После ПНЛ при стерильной моче у 83,8% пациентов не было рецидива нефролитиаза. При наличии мочевой инфекции отсутствие и наличие рецидива отмечены в 54,8 и 45,2% наблюдений соответственно (p<0,001). При проведении послеоперационной антибактериальной терапии авторы рекомендуют ориентироваться на результаты бактериологического исследования мочи, взятой из лоханки во время операции.
Таким образом, размер камня и истинная бактериурия служат достоверным фактором риска развития послеоперационной лихорадки и ССВР, на возникновение которых также влияют технические особенности ПНЛ и длительность операции. Наличие коралловидного нефролитиаза и множественных камней втрое увеличивает риск развития послеоперационных осложнений. Послеоперационный сепсис при ПНЛ развивается редко, но является серьезным осложнением и основной причиной летальности в после-операционном периоде. Несмотря на отрицательные посевы мочи перед операцией, в большом проценте случаев все же развивается послеоперационная инфекция. Применение профилактической антибактериальной терапии с учетом микроорганизмов, высеиваемых из мочевыводящих путей, существенно снижает частоту возникновения послеоперационных инфекционных осложнений. Эффективным считается применение схемы, подразумевающей однократное введение препарата за 30 мин до начала оперативного вмешательства.



