Актуальность. Известно, что уменьшение размеров почки не всегда следствие рубцевания ее паренхимы на фоне многофакторных проявлений хронической болезни почек [1, 2]. Эта проблема становится чрезвычайно важной в случаях бессимптомного течения болезни и требует верификации поражающего фактора. Прижизненная биопсия почек является единственным объективным методом постановки диагноза, однако и она по ряду объективных причин не всегда отражает реальную картину почечной патологии. Проблема заключается в точности забора материала и неоднозначности современной трактовки морфологических изменений. В связи с этим возникла острая необходимость поиска более совершенных и безопасных методов навигации, позволяющих максимально оправдать ожидания врача-клинициста от результатов функциональной диагностики болезни почек и картирования зон планируемой биопсии [3, 4].
Хроническая болезнь почек подразумевает определенную степень утраты функционирующей паренхимы органа, и тактика врача направлена на скорейшее установление диагноза, снижение скорости ее безвозвратной убыли. Следовательно, материал для гистологического исследования важно получить как из региона поражения, так и из сохранившихся жизнеспособными участков паренхимы. На современном этапе внедрения наукоемких и высокотехнологичных методов визуализации этим требованиям в полной мере соответствует совмещенная компьютерная и позитронно-эмиссионная томография (ПЭТ/КТ) [5, 6]. Она позволяет в режиме реального времени визуализировать и математически рассчитывать тонкие биохимические реакции, сопровождающие физиологические процессы в жизнеспособных клетках органов-мишеней и их особенности в морфофункционально несостоятельных регионах. Уже сегодня ПЭТ/КТ-сканирование всего тела с энергетическим метаболитом 18F-фтордезоксиглюкозой (18F-ФДГ) широко используется для мониторинга здоровых людей с патологической боязнью заболеть раком и в случаях наличия у них родственников с установленными онкологическими заболеваниями [7, 8]. В процессе исключения очагов возможного канцерогенеза эта технология позволяет одновременно визуализировать физиологическое включение меченых биомолекул энергетического обмена в локальный метаболизм на всех уровнях организма, включая органы мочеобразования и мочевыведения. Выявленные с помощью ПЭТ/КТ изменения размеров и контуров почек могут отражать как типологические особенности конкретного здорового человека, так и субклинические проявления нефроурологической патологии [9–11]. Исследование ПЭТ/КТ метаболизма меченых биомолекул позволяет определять степень жизнеспособности органоспецифических клеток, при этом результаты визуального и математического анализов достоверно коррелируют с морфологической картиной в очагах тканевой несостоятельности [12]
Цель исследования. ПЭТ/КТ-оценка энергетического метаболизма 18F-ФДГ в паренхиме почек здорового человека, а также пациентов с впервые выявленной гипоплазированной или сморщенной почкой.
Материалы и методы. В рамках мониторинга лиц с патологической боязнью заболеть раком проведено ПЭТ/КТ-обследование 30 здоровых человек, из них 18 женщин, с медианой возраста 39 лет. Во всех случаях новообразования были исключены, однако в 2 (6,7%) наблюдениях выявлено бессимптомное уменьшение размеров одной из почек. Исследования выполняли на аппарате для ПЭТ/КТ Biograph («Siemens»). В работе изучали функциональные изменения в паренхиме почек, которые анализировались по очагам ее повышенной тропности к изотопу глюкозы (18F-ФДГ). Визуализацию дополняли количественной оценкой. Зоны гиперметаболизма анализировали в автоматическом режиме по уровню захвата изотопа глюкозы (SUVmax, норма от 3,5 до 6,5 усл. ед.) и очерчивались штрих-линиями в местах максимального накопления изотопа. Исследования проводили через 40 мин после внутривенного введения 5 мл (200 МБк) препарата. Сканирование во всех случаях выполняли в стандартном режиме. Обработка материала проводилась в автоматическом режиме с 3D реконструкцией цветового изображения паренхимы почек и цифровой оценкой регионального метаболизма в условных единицах (усл.ед.).
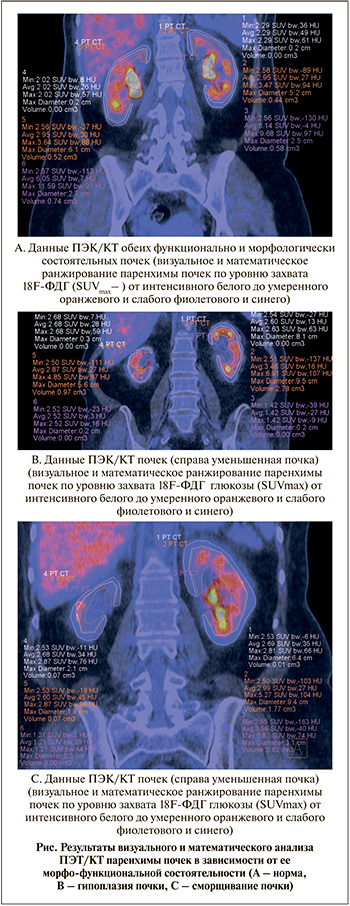 Результаты. В настоящем исследовании по серии ПЭТ/КТ-томограмм была проанализирована ценность визуализации энергетического метаболизма изотопа глюкозы 18F-ФДГ в паренхиме почек здорового человека и лиц с впервые выявленным уменьшением их размеров.
Результаты. В настоящем исследовании по серии ПЭТ/КТ-томограмм была проанализирована ценность визуализации энергетического метаболизма изотопа глюкозы 18F-ФДГ в паренхиме почек здорового человека и лиц с впервые выявленным уменьшением их размеров.
На рис. А представлена ПЭК/КТ-томограмма метаболизма глюкозы в паренхиме интактных почек здорового человека. На уровне коркового слоя уровень захвата изотопа глюкозы составил 2,02 и 2,29 усл. ед., что могло быть отражением энергетических затрат на процесс первичного мочеобразования (клубочковой фильтрации). Мозговой слой характеризовался более выраженной тропностью к изотопу глюкозы (SUVmax – 3,64 и 3,47 усл. ед.), что анатомически и функуционально совпадало с регионом канальцевой реабсорбции. В проекции полостей лоханок содержание изотопа глюкозы составило 11,59 и 9,6 усл. ед. Данная картина могла быть одним из проявлений завершающего (экскреторного) этапа метаболизма глюкозы в паренхиме интактных почек здорового человека.
На рис. В представлена томограмма метаболизма глюкозы в паренхиме интактных почек здорового человека с ПЭТ/КТ-признаками уменьшения размеров справа. При этом на уровне коркового слоя уровень захвата изотопа глюкозы составил 2,68 и 2,63 усл. ед., что указывало на соизмеримый вклад уменьшенной правой почки в процесс клубочковой фильтрации. В мозговом слое наблюдалось нарастание тропности паренхимы левой почки к энергетическому метаболиту (SUVmax – 4,85 и 6,91 усл. ед., с разницей более чем на 25%), однако фазововая интесивность процесса канальцевой реабсорбции во всех регионах мозгового слоя была идентичной, что служило докательством сохранения ее жизнеспособности. Высокая активность изотопа в проекции лоханок обеих почек (SUVmax – 2,52 и 1,42 усл. ед. с преобладанием справа) свидетельствовала об эффективности завершающего (экскреторного) этапа метаболизма глюкозы в паренхиме обеих почек независимо от их размеров. Это дало основание расценить впервые выявленное уменьшение провой почки как вариант функционально состоятельной ее гипоплазии.
На рис. С представлена визуальная и математическая характеристика ПЭТ/КТ-метаболизма изотопа глюкозы в паренхиме увеличенной в размерах левой почки и уменьшенной правой почки. При этом уровень захвата изотопа глюкозы на уровне коркового слоя составил 2,87 и 2,81 усл. ед., что могло соответствовать адекватной утилизации энергоемой молекулы глюкозы в процессе клубочковой фильтрации обеих почек, несмотря на различие их размеров. Однако в мозговом слое наблюдалось почти двукратное преобладание тропности к энергетическому метаболиту (SUVmax – 2,87 и 5,27 усл. ед.) паренхимы левой почки.
В этих условиях фазововая интенсивность вовлечения мозгового слоя в процесс канальцевой реабсорбции во всех регионах мозгового слоя правой почки, кроме среднего сегмента, была крайне низкой, что могло отражать значительное снижение ее нежизнеспособности. Не только анатомически, но и функционально более состоятельная левая почка (компенсаторная гиперплазия) в 3 раза энергичнее выполняла экскреторную функцию по выведению изотопа глюкозы (SUVmax – 1,21 и 5,87 усл. ед.). Причина первично-хронического сморщивания правой почки нам была неизвестна, однако преимущестенное выпадение из энергетического метаболизма мозгового слоя почки косвенно указывало на поражение канальцевого аппарата, что больше характерно для первично выявленного хронического пиелонефрита.
Выводы. В рамках настоящей работы проведена попытка определить стандартный подход к визуальной и математической ПЭТ/КТ-оценке энергетического метаболизма 11F-ФДГ в паренхиме почек здорового человека и пациентов с впервые выявленной гипоплазированной и сморщенной почкой. Полученные визуальные и цифровые данные могут быть использованы для принятия решения о целесообразности биопсии почки и картирования регионов ее проведения.



