Введение. Рак мочевого пузыря – одно из довольно частых онкоурологических заболеваний среди мужчин, в особенности пожилого возраста [1]. Радикальная цистэктомия продолжает оставаться «золотым» стандартом лечения мышечно-инвазивного рака мочевого пузыря (МИРМП). В результате быстрого развития лапароскопии в течение последних десятилетий лапароскопическая радикальная цистэктомия (ЛРЦ) постепенно зарекомендовала себя в качестве надежного малоинвазивного метода лечения МИРМП, позволяющего существенно уменьшать число осложнений. Однако у пожилых людей и пациентов с серьезными сопутствующими заболеваниями выполнение ЛРЦ все еще сопровождается высоким риском развития осложнений. Это во многом обусловлено низкой толерантностью таких пациентов к относительно продолжительному времени операции, длительному пребыванию в положении Транделенбурга и прежде всего значительному повышению внутрибрюшного давления [2]. Хотя целесообразность выполнения ЛРЦ у пожилых и соматически отягощенных пациентов все еще дискутируется [3, 4], некоторые исследования показали относительную безопасность вмешательства для отобранных случаев [2, 5].
Традиционно ЛРЦ выполняют трансперитонеальным доступом, в основном воспроизводя хирургическую технику, надежно зарекомендовавшую себя при открытых операциях. В литературе можно найти лишь отдельные сообщения об использовании экстраперитонеального доступа для ЛРЦ [6, 7]. В то же время большой накопленный нами опыт выполнения лапароскопической экстраперитонеальной радикальной простатэктомии (ЛЭРП) и ретроперитонеоскопических операций на почке показал существенные преимущества внебрюшинного доступа. В этой работе мы приводим начальный опыт выполнения лапароскопической радикальной цистэктомии экстраперитонеальным доступом соматически отягощенным пациентам.
Материалы и методы. В 2017–2021 гг. в нашей клинике были выполнены экстраперитонеальные лапароскопические радикальные цистэктомии (ЛЭРЦ) четырем пациентам мужского пола. Все пациенты имели серьезные сопутствующие заболевания (табл. 1).
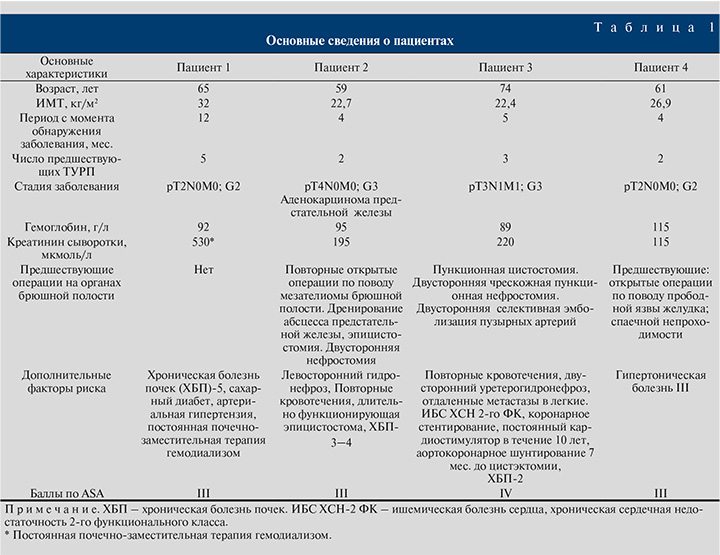
У всех, кроме одного, пациентов до выполнения цистэктомии был гистологически верифицирован мышечно-инвазивный рак мочевого пузыря G2–G3. Предоперационный клинический диагноз был установлен на основании предварительно выполненных повторных трансуретральных резекций (в большинстве случаев с внутрипузырной химиотерапией) мочевого пузыря (ТУР), данных магнито-резонансных и/или рентген-компьютерных томографий, результатов кардиологического обследования. Во всех случаях рак мочевого пузыря имел рецидивирующий прогрессивный характер. У двух пациентов была обнаружена инвазия в области задней уретры. У одного пациента была выявлена аденокарцинома предстательной железы (индекс Глиссона – 5+3=8) с прорастанием стенки мочевого пузыря и развитием уретерогидронефроза, ХБП 3–4.
В выборе экстраперитонеального доступа мы основывались прежде всего на наличии у пациента факторов риска в отношении длительного повышения внутрибрюшинного давления (ИБС, анемии, НК II–III ХБП), повторных предшествующих операций на органах брюшной полости. Кроме того, доступ использовали преимущественно в случаях, когда не планировали деривацию мочи с использованием сегмента кишки. Например, у пациентов с отсутствием функции обеих почек или ситуационным предпочтением уретерокутанеостомии (тяжелые сопутствующие заболевания, небольшая ожидаемая продолжительность жизни).
Методика лапароскопической экстраперитонеальной радикальной цистпростатэктомии
Пациента располагали на столе в умеренном положении Транделенбурга. Первичный доступ (1 см правее пупка) после 1,5–2,0 см разреза кожи подкожной клетчатки и апоневроза осуществляли пальцем позади прямой мышцы живота ниже linea arcuata. Экстраперитонеальное рабочее пространство формировали с помощью введенного баллона, наполняя его 900–1200 мл воздуха (рис. 1). Порты (один для камеры и четыре рабочих) располагали таким же образом, как при выполнении лапароскопической экстраперитонеальной радикальной простатэктомии. Во всех случаях мы использовали 10-мм лапароскоп-300.
Под контролем лапароскопа идентифицировали левый семенной канатик. Тазовую брюшину аккуратно тупо отслаивали от семявыносящих протоков в краниальном направлении до визуализации общих подвздошных сосудов и мочеточника. Лимфодиссекцию осуществляли, следуя общим, наружным, внутренним подвздошным и обтураторным сосудам последовательно справа и слева. Дистальный отдел левого мочеточника мобилизовали до мочевого пузыря, клипировали и пересекали с помощью LigaSure (рис. 2).
Аналогичные манипуляции выполняли с правой стороны. Брюшину отсепаровывали преимущественно тупым путем от передней поверхности и верхушки мочевого пузыря. Урахус пересекали с помощью Ligasure. Далее мобилизовывали заднюю стенку мочевого пузыря (рис. 3). Если заднюю поверхность пузыря не удавалось полностью отделить от брюшины, продолжали остальные этапы выделения. В этом случае после полной мобилизации пузыря вместе с ним отсекали неотделяемый фрагмент брюшины. План диссекции продолжали в направлении семенных пузырьков и семявыносящих протоков. Обычно оба листка фасции Денонвилье отсепаровывали от прямой кишки, оставляя их на семенных пузырьках и простате.
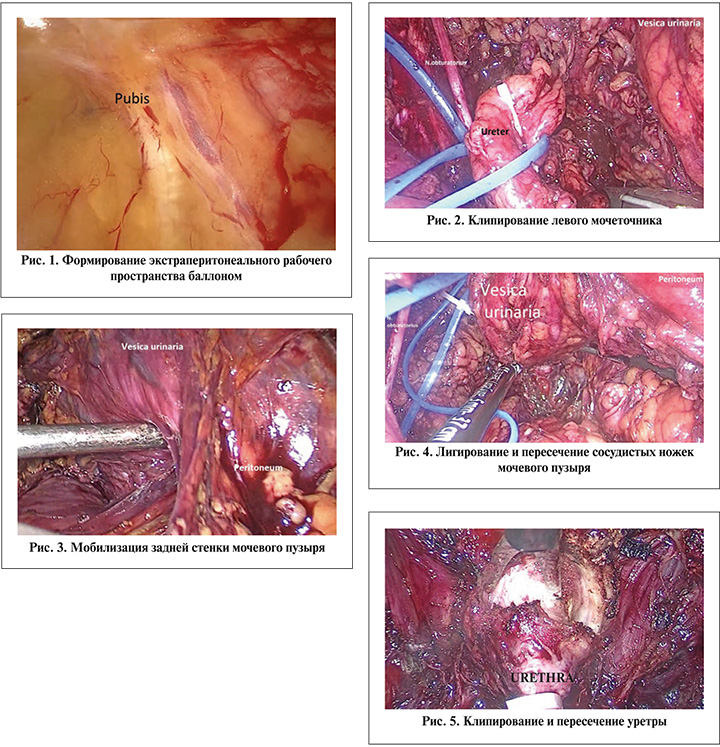
Последовательно слева и справа лигировали и пересекали семявыносящие протоки, ветви пузырных артерий, ножки предстательной железы также с помощью Ligasure (рис. 4).
После полного освобождения мочевого пузыря с предстательной железой и семенными пузырьками таким же образом обрабатывали и пересекали пубопростатические связки и дорзальный сосудистый комплекс. Проксимальный конец уретры клипировали или ушивали, затем пересекали (рис. 5). При необходимости удаления уретры дистальный конец выделяли на небольшом протяжении и отмечали лигатурой или клипсой. Уретрэктомию выполняли после удаления препарата через тот же надлонный доступ.
После завершения цистэктомии в зависимости от клинической ситуации одномоментно выполняли ретроперитонеоскопическую нефрэктомию либо уретерокутанеостомию (рис. 6).

Одному пациенту ретроперитонеоскопическая нефрэктомия справа (нефункционирующей почки) была выполнена отсроченно через 3 нед. после лапароскопической экстраперитонеальной цистпростатэктомии и уретерокутанео-стомии слева. В любом случае вмешательства выполняли лапароскопически экстраперитонеальным доступом, основываясь на приведенных выше соображениях. Пациенту с ХБП 5, находившемуся на постоянном диализе, одномоментно были выполнены ретроперитонеоскопические нефрэктомии с обеих сторон. Двум другим была выполнена ретроперитонеоскопическая уретерокутанеостомия: с одной (у пациента с единственной функционирующей почкой) или с двух сторон. Еще одному пациенту деривация мочи произведена в кондуит из сигмовидной кишки (в связи с значительным вовлечением в спаечный процесс подвздошной кишки).
Двум пациентам с поражением области задней уретры были дополнительно выполнены уретрэктомии. Одному из них уретрэктомия была выполнена одномоментно через надлонный доступ для извлечения препарата мочевого пузыря, другому – отсроченно промежностным доступом.
Результаты. Все операции были выполнены полностью эндоскопически экстраперитонеально. Конверсии в открытое вмешательство не потребовалось ни в одном случае.
Общая продолжительность всех этапов операции составила 250–490 мин с учетом репозиционирования пациента, перемещения операционной бригады и т.п. Максимальная кровопотеря не превышала 500 мл. Гемотрансфузии не потребовались ни одному пациенту (табл. 2). Значимых интраоперационных осложнений отмечено не было. При изучении макропрепарата число удаленных лимфатических узлов составило 9–13, у одного пациента были обнаружены пораженные лимфатические узлы.

Полное восстановление функции ЖКТ (первый стул) наблюдалось в течение 24–36 ч после вмешательства.
У пациентов с ХБП 5 почечно-заместительная терапия была возобновлена через 24–36 ч после окончания операции. Ближайший послеоперационный период у всех пациентов протекал без существенных особенностей. Двум пациентам проводилась адьювантная химиотерапия, одному из них дополнительно лучевая. Период наблюдения составил 4–55 мес. Один пациент умер от прогрессии заболевания через 7 мес. после операции.
Обсуждение. Радикальная цистэктомия даже в лапароскопическом исполнении представляет достаточно объемное оперативное вмешательство, нередко сопровождающееся послеоперационными осложнениями. Многие из них так или иначе связаны с органами брюшной полости. Сохранение целостности париетальной брюшины считают важным условием скорейшего восстановления функции кишечника [8]. При трансперитонеальной радикальной цистэктомии большой фрагмент брюшины удаляется с мочевым пузырем. Контакт тонкой кишки с деперитонезированной стенкой таза сопровождается воспалительной реакцией, выделением фибрина и может приводить к динамической кишечной непроходимости [9]. Сохранение целостности брюшины может предотвращать воспалительные реакции, вызванные контактом тонкого кишечника со стенкой таза [10]. В ранее проведенном исследовании показано, что выполнение лапароскопической цистэктомии экстраперитонеальным доступом сопровождается меньшим периодом до возобновления приема жидкости и восстановления функции ЖКТ.
Ни у одного из наших пациентов не было признаков послеоперационного пареза кишечника. Более того, полное восстановление пассажа по ЖКТ отмечалось в течение 24–36 ч после вмешательства (52 ч у пациента с деривацией мочи в кишечный кондуит). Энтеральное питание начинали уже в первые послеоперационные сутки. Это имеет существенное значение для пациентов с анемией, гипоальбуминемией на фоне осложнений и для пациентов с тяжелыми сопутствующими заболеваниями. Некоторые преимущества экстраперитонеального доступа ранее были показаны в работах, посвященных лапароскопической простатэктомии и резекции мочевого пузыря [11, 12].
С определенными сложностями можно столкнуться при отделении брюшины от задневерхней поверхности пузыря. Ранее проведенные исследования показали очень низкую вероятность вовлечения брюшины при опухолях мочевого пузыря Т1–Т2 [13]. Возможно, применение экстраперитонеального доступа может оказаться онкологически неоправданным при стадии Т3. С другой стороны, выделение задневерхней поверхности пузыря обычно выполняют на заключительном этапе мобилизации и при плотной адгезии этот фрагмент брюшины может быть удален вместе с мочевым пузырем. Таким образом мы поступили в одном из приведенных случаев.
В связи с малым числом наблюдений мы не проводили сравнения количества удаленных лимфоузлов при экстра- и трансперитонеальном лапароскопическом доступе. Однако подобное исследование, выполненное гинекологами при карциноме матки, показало, что среднее число лимфоузлов, удаленных экстраперитонеальным доступом, оказалось больше, чем при использовании трансперитонеальной лимфодиссекции [14]. К тому же, по данным ряда исследований, не было получено преимуществ в общей и канцер-специфической выживаемости пациентов после цистэктомии при выполнении расширенной лимфодиссекции по сравнению с ограниченной в стадиях pT1–T2 [15, 16].
В своей работе Larcher eи соавт. [17] показали преимущества выполнения радикальной цистэктомии с лимфаденэктомией по сравнению с изолированной цистэктомией только для когорты относительно молодых пациентов без серьезных сопутствующих заболеваний. При проведении прямого сравнения другие исследователи отметили одинаковую выживаемость пациентов после выполнения лапароскопической радикальной цистэктомии экстраперитонеальным и трансперитонеальным доступами. В приведенной нами серии у двух пациентов была подтверждена pT2-стадия заболевания. У одного пациента после операции стадия была повышена до рТ3. У одного пациента изначально выявлена pT4-опухоль предстательной железы, прорастающая в мочевой пузырь. Впрочем, у последних двух пациентов цистэктомия была выполнена по жизненным показаниям из-за рецидивирующих кровотечений, не купируемых другими средствами.
Несмотря на некоторые показанные преимущества, экстраперитонеальный доступ для лапароскопической радикальной цистэктомии может использоваться с определенными ограничениями. На этом этапе мы не обсуждали применения метода для женщин, так как большую часть манипуляций пришлось бы все равно выполнять в условиях соединения рабочего пространства с брюшной полостью. Ключевой момент заключается в планировании деривации мочи. Безусловные преимущества экстраперитонеального доступа состоят в полном отсутствии или существенном ограничении контакта с органами брюшной полости и повышении внутрибрюшного давления.
Поэтому преимущественно мы отбирали пациентов, которым изначально планировалась уретерокутанеостомия либо вовсе отсутствовала необходимость отведения мочи в связи сопутствующей терминальной почечной недостаточностью. Во всех случаях это были соматически отягощенные пациенты, нуждавшиеся в минимально инвазивных вмешательствах, иногда по жизненным показаниям. Хотя уретерокутанеостомия в настоящее время редко используется для отведения мочи, тем не менее этот способ может оказаться рациональным для пациентов с плохим прогнозом, тяжелыми сопутствующими заболеваниями или большим риском использования сегмента кишки [18]. В отношении двух пациентов мы прибегли к уретерокутанеостомии, которые выполняли лапароскопически экстраперитонеально. Одному пациенту с ХБП 5 одномоментно были выполнены ретроперитонеоскопические нефрэктомии с двух сторон. Эти операции были выполнены лапароскопически полностью экстраперитонеально без контакта с органами брюшной полости и повышения внутрибрюшного давления, то есть минимально инвазивно. У последнего пациента экстраперитонеальный доступ выбран в том числе из-за выраженного спаечного процесса в брюшной полости. Контакт с брюшной полостью был только на этапе деривации мочи после удаления мочевого пузыря с фрагментом брюшины. После этого был сформирован кондуит из сигмовидной кишки в связи с массивным вовлечением в спаечный процесс подвздошной кишки. Приведенный опыт показывает возможность применения методики к соматически отягощенным пациентам. Несмотря на описанные ограничения, экстраперитонеальный доступ может рассматриваться при необходимости выполнения «спасительных» цистэктомий,
Заключение. Лапароскопическая экстраперитонеальная радикальная цистэктомия – воспроизводимый минимально инвазивный метод оперативного лечения рака мочевого пузыря, который имеет преимущества в отношении послеоперационного восстановления у пациентов с тяжелыми сопутствующими заболеваниями. Использование экстраперитонеального доступа может быть рациональной альтернативой для выполнения «спасительной» цистпростатэктомии пациентам. Необходимо большее число наблюдений для определения места метода в оперативном лечении инвазивного рака мочевого пузыря.



