Согласно данным Европейской ассоциации урологов (ЕАУ), по своей распространенности уротелиальные карциномы (УК) занимают четвертое место среди всех злокачественных новообразований [1]. Порядка 95% случаев УК приходится на мочевой пузырь [2]. Образования мочеточника встречаются в 2 раза реже, чем чашечек и лоханки почки, причем в 17% наблюдений они сочетаются с поражением мочевого пузыря [3]. Таким образом, изолированная УК мочеточника – чрезвычайно редкая патология. Предполагаемый ежегодный прирост заболеваемости УК не превышает 2 случаев на 100 тыс. населения стран Запада [4].
Стандартом лечения уротелиального рака мочеточника пациентов с нормальной функцией контралатеральной почки остается радикальная нефроуретерэктомия с резекцией той части мочевого пузыря, что содержит устье [1]. Однако подобное вмешательство сопряжено с риском гибели больных не столько от онкологии, сколько от кардиоваскулярных осложнений, ассоциированных с прогрессирующей почечной недостаточностью [5]. Более того, около половины пациентов, подвергаемых подобным операциям, являются претендентами на органосохранение, так как в 40–56% случаев при гистологическом исследовании препаратов УК представлена опухолями низкого риска (pT0/pTa/pTis/pT1 low-grade) [6, 7].
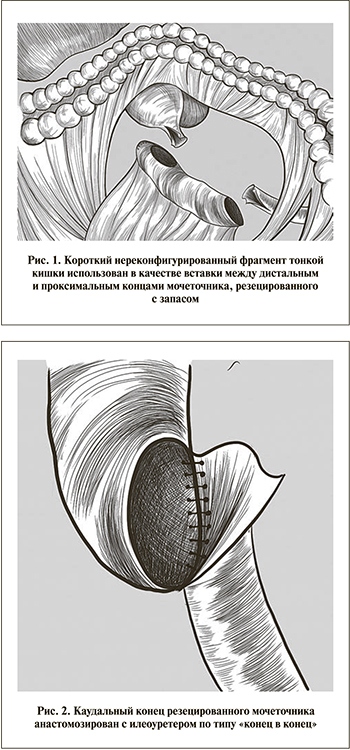 Органосберегающие операции при УК мочеточника традиционно выполнялись только по императивным показаниям у пациентов с единственной почкой, или при билатеральном синхронном поражении, или с почечной недостаточностью [1]. Впрочем, их эффективность для этой категории больных позволила ЕАУ несколько расширить рамки и рекомендовать сегментарную уретерэктомию в качестве альтернативы при всех новообразованиях низкого онкологического риска, локализованных в средней трети [8–10]. Суть вмешательства заключается в резекции пораженной части мочеточника и восстановлении его целостности анастомозом «конец в конец». Однако при несомненных преимуществах функциональных результатов подобные операции сопровождаются определенными рисками. Так, с одной стороны, широкое иссечение в пределах здоровых тканей ставит под сомнение возможность адекватного сопоставления концов мочеточника, с другой – неполноценная резекция грозит онкологическим прогрессированием [11].
Органосберегающие операции при УК мочеточника традиционно выполнялись только по императивным показаниям у пациентов с единственной почкой, или при билатеральном синхронном поражении, или с почечной недостаточностью [1]. Впрочем, их эффективность для этой категории больных позволила ЕАУ несколько расширить рамки и рекомендовать сегментарную уретерэктомию в качестве альтернативы при всех новообразованиях низкого онкологического риска, локализованных в средней трети [8–10]. Суть вмешательства заключается в резекции пораженной части мочеточника и восстановлении его целостности анастомозом «конец в конец». Однако при несомненных преимуществах функциональных результатов подобные операции сопровождаются определенными рисками. Так, с одной стороны, широкое иссечение в пределах здоровых тканей ставит под сомнение возможность адекватного сопоставления концов мочеточника, с другой – неполноценная резекция грозит онкологическим прогрессированием [11].
Попытка найти «золотую середину» реализована в настоящей работе, где описан первый собственный опыт лапароскопической сегментарной уретерэктомии с заместительной кишечной пластикой мочеточника при уротелиальной карциноме средней его трети. Приводим клиническое наблюдение.
П а ц и е н т Х. 57 лет со стажем табакокурения, превышающим 30 лет, и индексом массы тела 33 кг/м2. Приступ почечной колики, сопровождавшийся мочеиспусканием с примесью свежих сгустков крови, послужил причиной госпитализации в одну из районных больниц Нижегородской области. Болевой синдром купирован спазмолитиками. По данным ультразвукового и рентгенологического исследований выявлено ретенционно-обструктивное поражение левых мочевыводящих путей на фоне рентгеннегативного конкремента средней трети мочеточника. Последнее явилось показанием к уретероскопии, во время которой вместо конкремента обнаружена ворсинчатая опухоль, максимальный диаметр основания которой не превышал 7 мм; взята «щипковая» биопсия, операция завершена без дренирования. По результатам гистологического исследования верифицирована УК низкой степени злокачественности G1. Для определения дальнейшей тактики лечения пациент направлен в урологический центр ДКБ на ст. Нижний Новгород, где проведено обследование, включившее МРТ забрюшинного пространства с внутривенным контрастированием. Томография не выявила признаков инвазивного роста, нарушений уродинамики, равно как и изменений в регионарных лимфоузлах. Цисто- и уретеропиелоскопии подтвердили унифокальность заболевания. Клинический диагноз сформулирован как «уротелиальная карцинома средней трети левого мочеточника стадии cT1N0M0». Пациенту в доступной форме и полном объеме разъяснены особенности всех возможных вариантов лечения (от лазерной абляции до радикальной нефроуретерэктомии с резекцией мочевого пузыря). 06.02.2017, спустя 2 нед. с момента манифестации заболевания проведена лапароскопическая трансмезентериальная сегментарная уретерэктомия с заместительной тонкокишечной пластикой.
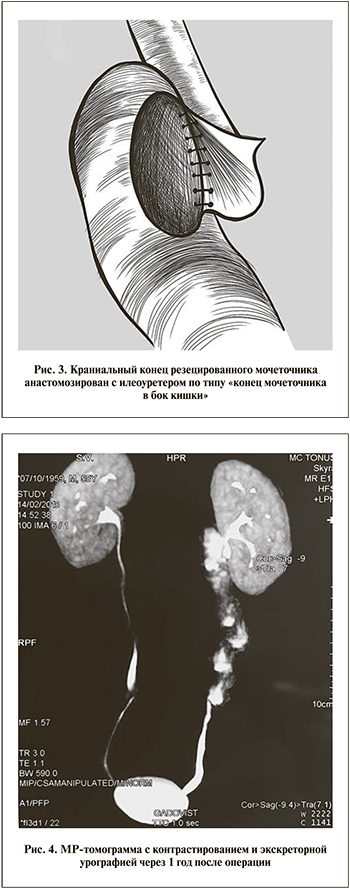
Техника операции (рис. 1). Положение больного на спине с поворотом операционного стола на здоровую сторону. Оптический порт в области пупка. Рабочие троакары установлены в эпигастрии, левой подвздошной области и по латеральному краю прямой мышцы живота слева. На различных этапах вмешательства по необходимости пациента переводили из положения Фовлера в Тренделенбурга и обратно. В брыжейке нисходящей кишки сформировано окно, ограниченное ветвями левых ободочных артерий и нижними брыжеечными сосудами, а также дугой Риолана. Осуществлен доступ к левому мочеточнику, который мобилизован от лоханки до перекреста с подвздошными сосудами, где клипирован Hem-o-lok и пересечен. Верхняя граница резекции мочеточника между клипс – на 3 см ниже лоханочно-мочеточникового сегмента. Препарат эвакуирован через один из рабочих троакаров и направлен на гистологическое исследование. Проведена парааортальная лимфодиссекция от подвздошных до почечных сосудов. Отступив 1,5 м за связку Трейца, после примерки сшивающим аппаратом резецирован фрагмент тонкой кишки, соответствующий мочеточниковому диастазу. Кишечная проходимость восстановлена изоперистальтическим аппаратным анастомозом «бок в бок». Механический шов краниального конца изолированного кишечного сегмента погружен кисетным швом, каудальный – иссечен. Через открывшийся просвет полость кондуита промыта физиологическим раствором. Оба конца мочеточника широко спатулированы, при этом нижний анастомозирован с неоуретером по типу «конец в конец», верхний – «конец мочеточника в бок кишки» на внутреннем JJ-стенте (рис. 2, 3). Зона операции укрыта прядями большого сальника и дренирована трубкой, установленной через рану одного из троакаров.
 Продолжительность вмешательства составила 230 мин при кровопотере менее 100 мл. Пациент активизирован в первые послеоперационные сутки. Тогда же восстановилась кишечная перистальтика. Страховой дренаж извлечен через 20 ч. Самостоятельный стул на 4-й день. Проводилась посиндромная терапия, профилактика инфекционных и тромбоэмболических осложнений. Уретральный катетер удален через 5 сут. Продолжительность послеоперационного пребывания больного в стационаре – 7 койко-дней. Трудоспособность восстановлена полностью через 15 дней (сельский ветеринар). Внутренний стент удален амбулаторно через 4 нед. после операции. Гистологическое заключение: уротелиальная карцинома мочеточника низкой степени злокачественности G1; начало инвазивного роста в подслизистый слой; края резекции свободны от опухолевого роста; в лимфатических узлах метастазов нет. Окончательный диагноз: уротелиальная карцинома средней трети левого мочеточника рT1N0M0.
Продолжительность вмешательства составила 230 мин при кровопотере менее 100 мл. Пациент активизирован в первые послеоперационные сутки. Тогда же восстановилась кишечная перистальтика. Страховой дренаж извлечен через 20 ч. Самостоятельный стул на 4-й день. Проводилась посиндромная терапия, профилактика инфекционных и тромбоэмболических осложнений. Уретральный катетер удален через 5 сут. Продолжительность послеоперационного пребывания больного в стационаре – 7 койко-дней. Трудоспособность восстановлена полностью через 15 дней (сельский ветеринар). Внутренний стент удален амбулаторно через 4 нед. после операции. Гистологическое заключение: уротелиальная карцинома мочеточника низкой степени злокачественности G1; начало инвазивного роста в подслизистый слой; края резекции свободны от опухолевого роста; в лимфатических узлах метастазов нет. Окончательный диагноз: уротелиальная карцинома средней трети левого мочеточника рT1N0M0.
Контрольные обследования проведены через 3, 6, 9 и 12 мес. Спустя 1 год после операции при цисто- и уретеропиелоскопии патологии не выявлено, в моче опухолевых клеток не обнаружено; по данным томографии признаков прогрессирования заболевания нет, функция почек сохранена, своевременна и адекватна (рис. 4). Пациент самочувствием доволен, работает на прежнем месте.
Обсуждение. Эпителиальные опухоли верхних мочевыводящих путей представляют собой чрезвычайно редкую группу новообразований, информация о которых ограничена описанием клинических случаев и небольшими сериями наблюдений. В свою очередь унифокальный уротелиальный рак средней трети мочеточника – настолько редкое заболевание, что степень клинических рекомендаций по его лечению в рамках стандартов как Российского общества урологов, так и ЕАУ не превышает уровня «С» [1–4, 10, 12]. Последнее означает, что «…алгоритмы лечения составлены с ограниченной достоверностью в отсутствие клинических исследований хорошего качества, непосредственно применимых к данной рекомендации. Выводы основаны на результатах по меньшей мере одного клинического испытания, не удовлетворяющего критериям доказательной медицины, например без рандомизации…» [13].
Уротелиальная карцинома, являясь раком собственно уротелия, может в любое время появляться в любых отделах мочевого тракта, обладающих этой выстилкой: в чашечно-лоханочной системе и мочеточнике, в мочевом пузыре и уретре. Именно этим и объясняется высокая частота синхронных опухолей и мультифокального поражения, например, другого мочеточника и мочевого пузыря [1–3]. Более того, на сегодняшний день нет никакой возможности верифицировать первичное образование, рецидив или прогрессирование заболевания, равно как и отличить их друг от друга. Рассматривая проблему в описанном контексте, идеальным способом лечения УК следовало бы считать «уротелийэктомию»... Однако последнее невозможно. Поэтому радикальная нефроуретерэктомия с резекцией части мочевого пузыря, содержащей устье, остается тем самым «золотым» стандартом лечения УК мочеточника, позволяющим иссечь по меньшей мере четверть уротелия, снизив вероятность возникновения новых очагов [1, 10].
Тем временем C. Fang et al. [11], сравнивая исходы радикальной нефроуретерэктомии с результатами сегментарной уретерэктомии у 78 и 53 подобных больных соответственно, не нашли достоверных различий частоты появления карциномы в мочевом пузыре, так же как и поражений контралатерального мочеточника. При этом в случаях опухоли средней трети последнего (low-grade) онкологические результаты были идентичными при средних сроках наблюдения 55 мес. [11]. В аналогичном исследовании [14] вид хирургического пособия не явился независимым прогностическим фактором ни безрецидивной выживаемости, ни онкоспецифической смертности. В свою очередь S. Hung и W. Yang, проведя схожий анализ лечения 112 пациентов, не обнаружили статистически значимого отличия частоты развития местных и мочепузырных рецидивов, отдаленного метастазирования и показателей канцерспецифической выживаемости в группах сегментарной и радикальной нефроуретерэктомии при средних сроках наблюдения 43,8 мес. При этом авторы отметили, что в случаях изолированных образований мочеточника органосохраняющие операции достоверно менее травматичны и обладают лучшими функциональными результатами [15].
С другой стороны, V. Margulis et al. [16] продемонстрировали, что на этапе первичной диагностики у 60% больных раком мочеточника процесс уже носит инвазивный характер. Последнее объясняется проблемами ранней диагностики. Как правило, эти пациенты бессимптомны, а заболевание обнаруживается случайно или при обследовании по поводу гематурии. Жалобы на боли в пояснице предъявляет лишь каждый пятый, а манифестация системных проявлений в виде прогрессивного похудания, фебрилитета и пр., как правило, ассоциирована с метастатической стадией болезни [1, 10].
Таким образом, вид хирургического вмешательства при УК мочеточника должен определяться исключительно персонифицированно, основываясь на скрупулезном комплексном предоперационном обследовании с использованием современного высокоточного оборудования. Малейшие сомнения следует трактовать в пользу максимально радикальной операции. Эффективность сегментарной уретерэктомии не вызывает сомнений, но у тщательно отобранных больных при строгом соблюдении законов абластики. Последние подразумевают не столько регионарную лимфодиссекцию, которая необязательна в случаях опухолей низкого риска, сколько определенные нюансы хирургической техники. А именно: часть мочеточника, подлежащая удалению, должна иссекаться в фасциальном футляре вместе с окружающими тканями; сегмент должен быть герметично изолирован с обеих сторон клипсами или лигатурами для предотвращения контакта его внутреннего содержимого с брюшной полостью, при этом края резекции иссекаются до тех пор, пока срочное морфологическое исследование не подтвердит их чистоту [1, 2, 10, 11, 17]. Этот маневр имеет некоторые ограничения. Во-первых, точно определить локализацию опухоли снаружи, не прибегая к интраоперационной уретероскопии, крайне сложно. Во-вторых, резекция должна производиться в пределах здоровых тканей, отступая несколько миллиметров от клипс (лигатур), для профилактики их миграции. Наконец, контроль хирургических краев и спатуляция тоже не уменьшают дефекта. Сочетание вышеперечисленных факторов порой приводит к образованию диастаза такого размера, что формирование адекватного, без выраженного натяжения, уретероуретероанастомоза весьма проблематично. Такие приемы, как широкая мобилизация проксимального и дистального концов мочеточника, так же как и низведение всей почки, не всегда эффективны. С. Fang и его коллеги отметили необходимость неоднократного повторного иссечения концов мочеточника ввиду положительных краев у 8 (17,8%) из 45 больных, подвергнутых резекции.
К сожалению, авторы не описывали тактику дальнейших действий в подобных ситуациях, равно как и не отслеживали частоту развития послеоперационных стриктур, а ведь чем более протяженный дефект мочеточника приходится стягивать в анастомозе, тем выше вероятность их образования [11, 17, 18].
Именно хирургия протяженных стриктур мочеточника подтолкнула нас к использованию илеопластики в представленном клиническом наблюдении. С тех пор как в 2010 г. А. Е. Санжаров впервые в Российской урологической практике выполнил лапароскопическую кишечную пластику по поводу авульсии, эта операция прочно заняла свое место в арсенале клиники [19]. Однако в традиционном понимании техники подобного вмешательства широкий каудальный анастомоз формируется между илеоуретером и мочевым пузырем [18, 19]. Последнее требует большей длины кишечного сегмента и сопряжено с риском развития метаболических нарушений, а также рефлюкс-пиелонефрита [20]. В настоящей работе короткий нереконфигурированный фрагмент тонкой кишки был использован в качестве вставки между дистальным и проксимальным концами мочеточника, резецированного с запасом. При этом изоперистальтическое его расположение и особенности формирования анастомозов позволили не только исключить вышеописанные осложнения, но и максимально приблизить уродинамику к физиологическому состоянию.
Заключение. Частота встречаемости изолированной уротелиальной карциномы средней трети мочеточника ставит под сомнение возможность доказательного анализа результатов представленной операции. Тем не менее лапароскопическая сегментарная уретерэктомия с заместительной кишечной пластикой обладает рядом бесспорных преимуществ и может рассматриваться в качестве альтернативного метода лечения тщательно отобранных пациентов.



