Аутотрансплантация почки в отечественную практику пришла в модифицированном варианте от ее первых попыток успешного выполнения. Пионер направления Э. Ульман произвел аутотрансплантацию почки на шею собаки в 1902 г. Сосудистый анастомоз был выполнен с помощью магниевых трубок (протез Пайра) [1, 2]. В 1906 г. А. Каррель доложил об успешной аутотрансплантации почки в ряде опытов на кошках и стал основоположником техники сосудистого анастомоза и создания специального атравматичного шовного материала [3]. Первая трансплантация почки человеку выполнена Дж. Мюррей в 1954 г. однояйцевым близнецам, в 1959 г. – пересадка почки от неродственного донора, в 1962-м – пересадка трупной почки [4]. Дж. Харди выполнил первую аутотрансплантацию почки в 1962 г. пациенту 64 лет с гигантской аневризмой гомографта, которая вовлекла в рубцовый процесс две трети мочеточника и привела к гидронефрозу [5].
В 1967 г. выходит ряд отечественных работ под руководством Н. А Лопаткина по трансплантации трупной почки и выполнению аорто-артериоанастомоза [6, 7], созданию временного кровоснабжения трансплантанта [8], использованию трансплантации почки при хронической болезни почек [9], изучению патологических процессов в трансплантированной почке и по методам их раннего определения [10], ферментативной активности при трансплантации почки [11, 12], по реакции отторжения почечного трансплантанта [13].
В СССР первая успешная аутотрансплантация почки выполнена в 1975 г. В. С. Рябинским и И. С. Колпаковым при рубцовой стриктуре мочеточника [14]. При вазоренальной гипертензии аутотрансплантация впервые выполнена в 1978 г. А. П. Торгунаковым и Л. И. Панасенковым [15].
Активное участие в определении показаний и особенностей оперативной техники при экстракорпоральных операциях на почках принял Н. А. Лопаткин. В 1983 г. он опубликовал большой отчет о 50 запланированных операциях ex vivo и 20 фактически выполненных. Автор сделал вывод, согласно которому экстракорпоральная хирургия почек требуется относительно редко – только при наличии строгих показаний [16]. Под руководством коллектива авторов из НИИ урологии в 1981 г. опубликована работа по противоишемической защите при экстракорпоральных операциях на почках [17]. В отечественной литературе есть данные по экстренной операции на почке с использованием экстракорпоральной техники у пациента с артериовенозной мальформацией почек при осложнении эндоваскулярного лечения [18] и при протяженных сужениях мочеточника [19].
В 1992 г. Б. К. Комяков впервые в России выполнил экстракорпоральную резекцию с последующей аутотрансплантацией почки при болезни фон Гиппеля-Линдау (VHL – синдром) [20]. На данный момент под руководством профессора Б. К. Комякова успешно выполнена аутотрансплантация почек 11 пациентам: 4 пациентам выполнена экстракорпоральная резекция с центрально расположенной опухолью почки; 2 – с двусторонним онкологическим процессом, 2 – с опухолью единственной левой почки, в 3 случаях по элективным показаниям [21] .
В последние годы особую роль стала играть экстракорпоральная хирургия почки в органосохраняющем лечении забрюшинных опухолей, позволив сохранять почечную функцию [22–25].
В 2019 г. под руководством А. А.Теплова и А. А. Грицкевича вышла монография «Экстракорпоральная хирургия почек и почечных артерий», где приведена техника хирургических вмешательств при редких вариантах: артериовенозных мальформациях почечных сосудов, ренокавальной форме рака и при аневризмах ветвей почечных артерий [26].
Таким образом, сформировался ряд показаний к аутотрансплантации почки. В данной статье мы привели три клинических примера применения аутотрансплантации почки по урологическим и онкологическим показаниям.
Клиническое наблюдение 1. Пациент Г. 54 лет поступил в НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина с жалобами на наличие нефростомического дренажа слева. В ходе сбора анамнеза заболевания стало известно, что пациент длительно страдает мочекаменной болезнью (МКБ). В 1995 г. по поводу камней в левой почке выполнена левосторонняя пиелотомия с литоэкстракцией. Через 10 лет у пациента отмечен рецидив камнеобразования, диагностированы камни левой почки, в связи с чем в 2005 г. выполнена контактная уретеролитотрипсия слева, стентирование левого мочеточника. Внутренний стент левого мочеточника своевременно удален не был, через 1,5 года после установки стента пациент обратился в клинику для его удаления. В 2006 г. произведено удаление инкрустированного стента, во время операции также была проведена контактная литотрипсия инкрустрированного проксимального завитка стента. Спустя 10 лет у пациента был диагностирован камень левой почки и в 2017 г. ему выполнили перкутанную нефролитолапаксию слева. В 2021 г. пациенту вновь была выполнена перкутанная нефролитолапаксия слева, стентирование левого мочеточника в связи с рецидивом камнеобразования в левой почке. В октябре 2021 г. пациент поступил с конкрементом левого мочеточника в НИИ урологии, была выполнена контактная уретеролитотрипсия с установкой мочеточникового стента слева. При контрольном обследовании в ноябре отмечена миграция стента. Выполнена установка нефростомического дренажа слева. 22.12.2021 мочеточниковый стент был удален, при выполнении ретроградной уретеропиелоскопии, уретеропиелографии, антеградной уретеропиелографии слева на уровне сосудистого перекреста определилось непреодолимое препятствие. Антеградно при введении рентгенконтрастного вещества определился стаз контраста на границе верхней и средней третей левого мочеточника (рис.1 A).

Учтя возраст, сохранную функцию левой почки, протяженную стриктуру мочеточника, а также технические возможности клиники, пациенту выполнена аутотрансплантация левой почки открытым способом 23.02.2022 (рис. 1 Б–Г).
Произведено изъятие левой почки с артерией и веной. Выполнен доступ в левую подвздошную ямку. Артерия и вена левой почки анастомозированы с подвздошной артерией и веной. Левый мочеточник смоделирован из мочевого пузыря по методике Боари и анастомозирован на внутреннем стенте № 6 Сh с лоханкой левой почки. Время операции составило 134 минуты, кровопотеря – 208 мл. Послеоперационный период протекал гладко. Пациент выписан на 10-е сутки после операции. Внутренний стент удален спустя 6 нед. после операции. По данным контрольной компьютерной томографии, левая почка находится в левой подвздошной области, пассаж контрастного вещества из левой почки не нарушен.
При контрольном ультразвуковом исследовании аутотрансплантат расположен в левой подвздошной области. Размеры составляют 10,2х7,2 см. Паренхима его однородная, не изменена, не отечна, толщина ее – 2 см. Чашечнолоханочная система (ЧЛС) аутотрансплантата физиологически расширена. Через лоханку лоцируется стент-пиелостома, расположенный в мочеточнике. Данных за наличие гематом, скопления жидкости в трансплантате и вблизи него не выявлено. Кровоток в аутотрансплантате не изменен, достаточный во всех отделах, доходит до капсулы, тип магистральный, ангиоархитектоника не изменена; гемодинамические показатели на сегментарных/дуговых артериях: скорость кровотока на сегментарных артериях Vs – 26,7 см/с, скорость кровотока на дуговых артериях Vd – 5,65 см/с, индекс резистентности Ri – 0,79, патологической васкуляризации не выявлено. Правая почка размером 12х7,33 см, толщина паренхимы – 1,65 см. ЧЛС не расширена.
Пациент находится под наблюдением 3 мес., ведет активный образ жизни, работает.
Клиническое наблюдение 2. Пациентка В. 51 года с клиническим диагнозом: неорганная забрюшинная опухоль IIIBст сT4N0M0 (забрюшинная многоузловая липосаркома (G1– G2) (рис. 2 А, Б).
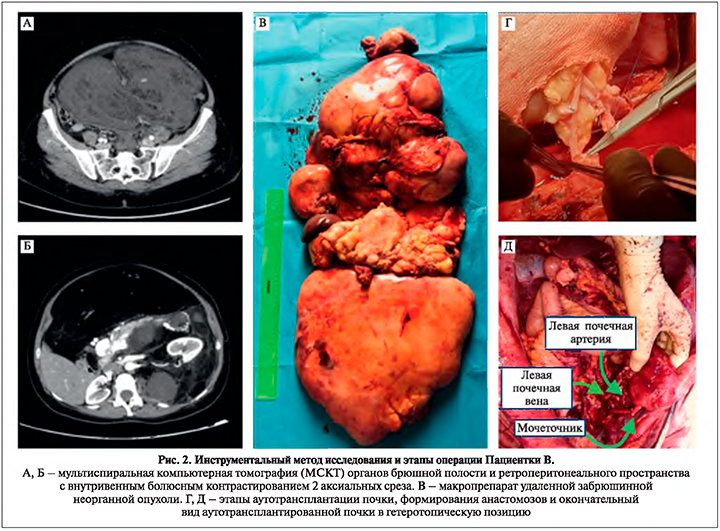
Забрюшинная неорганная опухоль удалена (рис. 2В), произведены резекцией поджелудочной железы, спленэктомия, левосторонняя гемиколэктомия, экстирпация матки с придатками, формирование подвесной еюностомы с аутотрансплантацией левой почки. Этапы аутотрансплантации почки: 1 – формирование сосудистого анастомоза между почечной и левой внутренней подвздошной артериями (рис. 2 Г); 2 – окончательный вид аутотрансплантированной почки в гетеротопическую позицию, после сформированных межсосудистых анастомозов и межмочеточникового анастомоза (рис. 2 Д). Время операции – 430 мин, кровопотеря составила 2700 мл. Течение послеоперационного периода гладкое.
По данным морфологического исследования установлена забрюшинная многоузловая липосаркома (G1–G2), преимущественно высокодифференцированная липомоподобная (G1) с подрастанием к участку диафрагмы, капсуле селезенки, поджелудочной железе, надпочечнику, обрастанием этих органов и узлом миксоидной липосаркомы (G2) с врастанием в стенку одного из фрагментов толстой кишки. Морфологическое исследование удаленного препарата показало онкологическую радикальность операции. Пациентка выписана на 18-е сутки после операции. На протяжении 9 мес. пациентка находится под нашим наблюдением с ремиссией и сохранной функцией аутотрансплантированной почки.
Клиническое наблюдение 3. Пациентка С. 48 лет с клиническим диагнозом: неорганная забрюшинная опухоль IBст рT4N0M0 (недифференцированная липосаркома low grade (G1)) (рис. 3 А, Б).

Неорганная забрюшинная опухоль удалена единым блоком с левой почкой, левым надпочечником (рис. 3 В, Г). Экстракорпорально выполнена резекцией верхнего полюса левой почки и его аутотрансплантация в подвздошную область (рис. 3 Д, Е), выполнена холецистэктомия, подвесная еюностомия. Время операции составило 374 мин, кровопотеря – 1203 мл. Течение послеоперационного периода гладкое. По данным морфологического исследования установлена недифференцированная липосаркома low grade (низкой степени) (G1) веретеноклеточного строения, с малои умеренноклеточными участками, очагами некроза, с 4 митозами на 10 полей зрения при 40-кратном увеличении. Морфологическое исследование удаленного препарата показало онкологическую радикальность операции. Пациентка выписана на 14-е сутки после операции. Проводится послеоперационная реабилитация (1,5 мес. после операции).

С учетом зарубежного, отечественного опыта и последних данных сформировался круг показаний к выполнению аутотрансплантации почки (см. таблицу):
- сосудистые (мешкообразная аневризма почечной артерии больших размеров; синдром средней аорты) [27–29];
- урологические (протяженные стриктуры мочеточника, отрыв мочеточника, идиопатический ретроперитонеальный фиброз) [30, 31];
- онкологические (саркомы забрюшинного пространства) [32, 33].
На сегодняшний день, согласно результатам крупных исследований, можно выделить критерии к выполнению аутотрансплантации почки: уместность, целесообразность и их обоснованность [34].
Аутотрансплантация почки является методом выбора лечения поражений мочеточника, направленного на сохранение почечной функции. Развитие эндоваскулярной хирургии уменьшило спектр сосудистых показаний к аутотрансплантации почки, а развитие эндоурологии увеличило количество травм мочеточника, что предопределило урологические показания как одно из основных для проведения данного вида оперативного вмешательства. В лечении неорганных забрюшинных опухолей (НЗО) отмечена тенденция к отказу от моноблочной и циторедуктивной хирургии в пользу сбалансированного подхода: нефросберегающие вмешательства, удаление высокодифференцированных НЗО отдельными «компартментами», с целью максимальной органосохранности с последующей аутотрансплантацией почки. При подозрении на обширное вовлечение почки в опухолевый процесс с сохранением ее функции необходим мультидисциплинарный подход с участием специалистов трансплантологической службы. Следует отметить, что аутотрансплантация при опухоли почки может приводить к большому спектру осложнений: 4 кровотечение (3,3–5%), инфекции мочевыводящих путей (7,4%), тромбоз почечной вены (4,1%), потеря функции трансплантата (12,3%) – это может быть обусловлено исходно более сложным анатомическим распространением опухолевого процесса [49].
Техника выполнения аутотрансплантации почки предполагает применение управляемой гипотермии [50] (локальная гипотермия на этапе эксплантации опухолевого конгломерата), фармако-холодовой защиты на этапе ex vivo [51]; получение достаточных для выполнения соответствующих анастомозов по длине и диаметру почечной артерии и вены [52], маркировку почечных сосудов на этапе удаления блока «опухоль–почка» [52,53]; использование хирургических бинокулярных луп на этапе экстракорпоральной диссекции почки [53], широкой мобилизации подвздошных сосудов [54, 55]; применение антикоагулянтной терапии с первых суток после аутотрансплантации почки [56, 57].
Приведенные нами клинические наблюдения из урологической и онкологической практики и представленное обсуждение показывают возможность безо-пасного применения аутотрансплантации почки по строго выбранным показаниям.



