Введение. Развитие почечной колики у беременных является одной из самых частых причин обращения в стационар, не связанных с акушерской патологией [1]. Наиболее частыми причинами возникновения болевого синдрома в поясничной области у беременных являются увеличение в размере почки на 1–1,5 см за счет отека и растяжения капсулы, компрессия мочеточника увеличенной и ротированной маткой, гормональные изменения в течение гестации, приводящие к пассивной дилатации мочеточника, и обструкция мочеточника камнем [2, 3].
В период с 1-й по 13-ю неделю беременности сочетание гестационного пиелонефрита с нарушением пассажа мочи по верхним мочевыводящим путям коррелирует с угрозой преждевременных родов. Отечественные и зарубежные исследования объясняют повышенную сократимость миометрия или гипертонус матки температурной реакцией [4–6]. Однако R. L. Kroovand и соавт. отмечают, что в 3-м триместре беременности у 90% пациенток встречается ретенция (ЧЛС), что расценивается как физиологически закономерный процесс [7].
С учетом фармакологических и диагностических ограничений в течение гестации проблема расширения полостной системы почек у беременных, а также выбор тактики лечения остаются сложной клинической задачей. Отсутствие единого последовательного алгоритма действий при выявлении ретенции ЧЛС, диагностируемой преимущественно по данным ультразвукового исследования (УЗИ) почек, «стертой» клинической картине, количество необоснованных дренирований беременных растет с каждым годом.
Цель исследования: оценить результаты лечения обструктивной уропатии у беременных в зависимости от причины ее возникновения и вне зависимости от срока гестации.
Материалы и методы. В исследуемую группу были включены 537 пациенток с обструктивной уропатией со сроком гестации от 5 до 36 нед., находившихся на стационарном лечении в период с января 2018 по январь 2022 г. в ГБУЗ «ГКБ им. С. С. Юдина» ДЗМ. Из окончательной аналитической когорты были исключены пациентки, не имевшие признаков нарушения уродинамики верхних мочевыводящих путей. В зависимости от этиопатогенетической обструктивной уропатии пациентки были разделены на 3 группы: группа I – 201 (37,4%) пациентка с гестационным пиелонефритом (наличие ССВР) и расширением полостной системы почки без подтверждения диагноза МКБ; группа II – 216 (40,2%) пациенток с почечной коликой (наличие болевого синдрома без признаков системной воспалительной реакции) и расширением полостной системы почки, не связанным с МКБ; группа III – 120 (22,4%) беременных с наличием расширения полостной системы почки, обусловленным МКБ, подтвержденной инструментальными методами исследования, как с признаками ССВР, так и без них.
Возраст, индекс массы тела, количество беременностей во всех группах не различались. Средний возраст пациенток в трех группах составил 26,1 года со средним сроком гестации 20,8 нед. Распределение пациенток в группах, исходя из триместра беременности, представлено в табл. 1.

Настоящая беременность была первой у 285 (53,1%), вторая – у 145 (27%), третья – у 59 (11%), четвертая и более – у 48 (8,9%) пациенток соответственно. Среди всех беременных в 89,2% акушерско-гинекологический анамнез был не отягощен, в 8,9% – в анамнезе однократно отмечался самопроизвольный аборт, а в 1,9% – 2 раза и более. На момент осмотра пациенток врачом-акушером-гинекологом в стационаре у 16 (2,9%) беременных выявлено низкое расположение плаценты, у 4 (0,8%) – преждевременное созревание плаценты и у 3 (0,6%) пациенток – ретрохориальная гематома.
На момент обращения в стационар у 433 (80,6%) пациенток наблюдался болевой синдром в поясничной области справа, у 83 (15,5%) – слева, билатеральный характер процесса – у 21 (3,9%) пациентки. Средняя СКФ по CKD-EPI составила 81,1 мл/мин/1,73 м2. Отсутствие роста патогенной микрофлоры, по данным посева мочи, с чувствительностью к антибактериальным препаратам наблюдалось в 66,1%. Подробные результаты бактериологического исследования представлены в табл. 2. Всем пациенткам выполнялось УЗИ мочевыводящих путей, и в 2,9% были выявлены аномалии развития.
Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц «Microsoft Office Excel 2010» (Microsoft Corporation, США) и пакета прикладных программ «IBM SPSS Statistics 22» (IBM, США). Все полученные анамнестические, клинические, лабораторные и инструментальные данные вносились в базу данных Microsoft Excel, разработанную автором, и были обработаны методом вариационной статистики. Количественные показатели были представлены в виде M±SD, где M – среднее арифметическое, SD – стандартное отклонение, а в случае отсутствия нормального распределения – в виде медианы и интерквартильного размаха Me [Q1–Q3], где Me – медиана, Q1 – первый квартиль (25%), Q3 – третий квартиль (75%).
Результаты. В основе выбора тактики лечения беременных разных этиопатогенетических форм обструктивной уропатии мы применяли разработанный алгоритм (см. рисунок) [8].
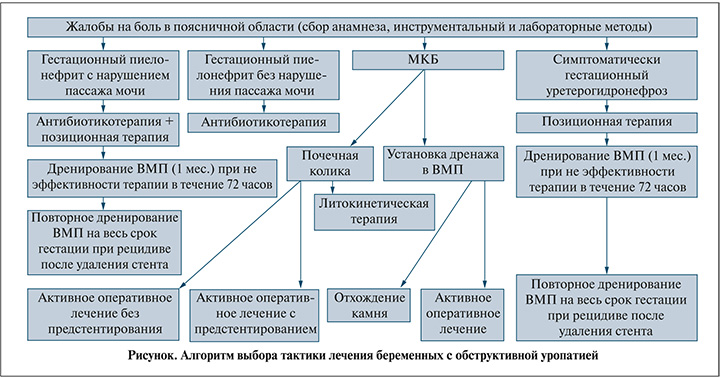
Пациенткам группы I (n=201) с гестационным пиелонефритом и расширением полостной системы проводилось лечение, согласно программе стратегий контроля антимикробной терапии (СКАТ): препаратами группы пенициллинов широкого спектра действия с ингибиторами бета-лактамаз, препаратами группы цефалоспоринов и препаратами группы карбапенемов. Средний уровень лейкоцитов крови составил 15,3 (10*9/л), повышение уровня прокальцитонина наблюдалось у 48 (23,9%) беременных. Проводился ежедневный клинико-лабораторный мониторинг с выполнением УЗИ мочевыводящих путей, консультациями смежных специалистов (врача-акушера-гинеколога, врача-хирурга и т.д.). Эскалация антибактериальной терапии выполнялась в промежуток 48–72 ч при отрицательной динамике, сохранявшейся гипертермии, повышении маркеров системной воспалительной реакции.
В качестве жаропонижающей терапии при необходимости в 100% случаев применялся Парацетамол. Период принятия решения о необходимости установки внутреннего мочеточникового стента в качестве метода дренирования составлял не более 72 ч. Несмотря на проводимые антибактериальную, инфузионную, спазмолитическую и жаропонижающую терапии, 129 (64,2%) беременным был установлен внутренний мочеточниковый стент. После купирования воспалительного процесса спустя 2–4 нед. от момента выписки из стационара всем пациенткам было проведено удаление стента с последующим динамическим наблюдением в течение 3 сут. В результате наблюдения кратко-срочный метод дренирования (до 4 нед.) был эффективным у 90,1% беременных, и только в 9,9% случаев была необходимость повторно установить стент с последующей рутинной сменой дренажа. В этом случае удаление стента выполнялось спустя 14 дней после родоразрешения с предварительным выполнением мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости и забрюшинного пространства без контрастного усиления.
Пациенткам группы II (n=216) с почечной коликой и признаками обструкции без ССВР, не связанными с МКБ, проводилась спазмолитическая терапия, которая дополнялась позиционной гимнастикой (коленно-локтевое положение) в течение 15 мин до 4 раз в сутки. С учетом болевого синдрома обеспечение адекватной анальгезии достигалось внутривенным введением Парацетамола не более 4000 мг в сутки. Сохранявшаяся ретенция полостной системы почки (почек), по данным УЗИ, рефрактерный к анальгезии болевой синдром послужили критериями выбора в пользу дренирования мочевыводящих путей стентом. Период принятия решения, аналогично группе I, составил не более 72 ч.
Дренирование было выполнено 80 (37%) беременным с последующим удалением стента через 2–4 нед. Рутинная замена стента с учетом рецидива болевого синдрома после удаления дренажа выполнялась 2,3% пациенток с последующим удалением стента спустя 14 дней после родоразрешения с предварительным выполнением мультиспиральной компьютерной томографии органов брюшной полости и забрюшинного пространства без контрастного усиления. Алгоритм удаления стента был идентичен группе I.
У пациенток группы III (n=120) с диагнозом МКБ, подтвержденным инструментальными методами диагностики (УЗИ и/или магнитно-резонансная томография), расположение конкремента в ЧЛС наблюдалось в 28 (23,3%), в мочеточнике – в 92 (76,7%) случаях.
При расположении камня в мочеточнике проводилась классическая литокинетическая терапия. Самостоятельное отхождение конкремента было отмечено у 8 (6,7%) пациенток. Возможность выполнения уретероскопии (уретеролитоэкстрация при помощи нитиноловых корзинок/гольмиевая, лазерная, уретеролитотрипсия) без предварительного стентирования наблюдалась у 31 (25,8%) беременной с камнем мочеточника. Условием выполнения эндоскопического вмешательства являлось отсутствие признаков системной воспалительной реакции. Остальным, 81 (67,5%) беременной, первым этапом была выполнена установка стента сроком до 4 нед. При локализации камня в мочеточнике в последующем 32 (22,7%) пациенткам выполнялась контактная лазерная уретеролитотрипсия и 21 (17,5%) – уретеролитоэкстракция. При расположении камня в почке 28 (23,3%) беременным была выполнена пиелокаликолитотрипсия. Большинство оперативных вмешательств выполнялось под спинальной анестезией. Во время выполнения оперативного вмешательства у беременных в третьем триместре, согласно разработанному внутрибольничному протоколу, в операционной присутствовал врач-акушер-гинеколог. Кардиотокография и УЗИ матки с определением маточно-плацентарного кровотока, УЗИ плода с допплерографией выполнялись 100% беременных в первые 24 ч. В послеоперационном периоде были использованы внутренние методы дренирования, такие как мочеточниковый катетер, внутренний мочеточниковый стент с ретракционной нитью, наружный (однопетлевой) мочеточниковый стент.
С целью оценки послеоперационных осложнений была применена шкала Clavien–Dindo. В группах I, II и III среди беременных, которым потребовалась установка стента (n=290), рефлюкс-пиелонефрит, нефункционирующий стент, дислокация стента были отмечены в 5,9% случаев, что привело к замене дренажа и соответствует степени IIIA по шкале Clavien–Dindo. Замена внутреннего мочеточникового стента выполнялась как под местной, так и под внутривенной анестезией. «Непереносимость» внутреннего стента наблюдалась у 5 (1,7%) пациенток, в связи с чем была выполнена чрескожная пункционная нефростомия под ультразвуковым контролем. Отклонение от нормального течения послеоперационного периода, проявившееся субфебрилитетом, дискомфортом в нижней части живота с выраженным болевым синдром, требовавшим анальгезии и соответствовавшим I степени по шкале Clavien–Dindo, было отмечено у 27 (9,3%) пациенток.
Обсуждение. Из исследования A. Vleeming и соавт. следует, что во время беременности более 50% женщин испытывают пояснично-тазовую форму боли [9]. В зависимости от формы болевые ощущения были классифицированы как «легкие», «умеренные» и «сильно выраженные» и наблюдались у 45, 30 и 25% респондентов соответственно [10]. Манифестация болевого синдрома в большинстве случаев отмечалась в период с 12-й по 24-ю неделю беременности и соответствовала второму триместру [11]. В нашем исследовании в зависимости от этиопатогенетического фактора отличался и срок гестации. Инфекционно-воспалительные заболевания мочевыводящих путей чаще встречаются во втором триместре беременности – 62,2% из группы I, также как и дебют МКБ – 65% из группы III. Тогда как почечная колика и/или люмбо-абдоминальный болевой синдром возникают чаще в первом триместре беременности – 56,9% из группы II.
D. S. Ipe и соавт. считают, что бессимптомная бактериурия распространена среди беременных от 2 до 15% и является основным фактором риска развития симптоматических инфекционных заболеваний [12]. В условиях отсутствия лечения бессимптомной бактериурии зарубежные исследования разных годов сходятся во мнении, что трансформация в острые воспалительные заболевания мочевыводящих путей происходит у 20–40% и может сопровождаться осложнениями беременности, включая преждевременные роды [13–15]. Основным возбудителем в 86% является Escherichia сoli [12, 16]. Схожие данные были получены и в нашем исследовании, где на долю E. сoli прищлось 71,9% от посевов с положительным результатом и титром >104 КОЕ/мл.
В обзоре D. W. Branch, посвященном физиологической адаптации организма беременной, лейкоцитоз являлся неотъемлемой составляющей [17]. Всем пациенткам группы I выполнялись клинический анализ крови, анализ уровня С-реактивного белка (С-РБ) и прокальцитонина. Изолированное повышение уровня лейкоцитов без повышения иных маркеров воспаления наблюдалось у 29,4% беременных, повышение уровня С-РБ и лейкоцитов – у 61,7%. Следует отметить важность сочетания клинической картины и лабораторно-инструментальных методов диагностики, чтобы грамотно распознавать физиологически нормальные состояния от патологических, так как во время беременности не каждое расширение ЧЛС является проявлением клинически значимой обструкции и практически в половине случаев не требует дренирования.
А если необходимость дренирования все-таки возникает, то краткосрочный период (до 4 нед.) у большинства (90%) беременных бывает достаточным для купирования атаки пиелонефрита и продолжения дальнейшей беременности без дренажа.
Аналогичная динамика наблюдается и в группе II, когда речь идет только о наличии болевого синдрома и отсутствии ССВР. Лишь у трети пациенток этой группы есть необходимость в дренировании ЧЛС из-за рецидивирующего характера почечной колики, резистентной к комплексной консервативной терапии. Так же как и в группе I, краткосрочного дренирования (до 4 нед.) большинству беременных достаточно для стойкой регрессии болевого синдрома, а необходимость длительного дренирования требуется лишь у 2% пациенток.
Таким образом, подход определения показаний к дренированию беременных с обструктивной уропатией, не обусловленной МКБ, должен быть дифференцированным, а при необходимости дренирования следует отдавать предпочтение краткосрочным методам.
МКБ во время беременности может затруднять постановку диагноза, требуя проведения дифференциальной диагностики с аппендицитом, дивертикулитом и отслойкой плаценты, удлиняя временной интервал [18]. A. Trinchieri в своем исследовании отмечает, что симптомы, связанные с МКБ, проявляются в 80–90% во втором и третьем триместрах беременности [19]. Наше исследование подтверждает данные зарубежных и отечественных источников литературы, так как манифестация МКБ в первом триместре в группе III составляла 5,8% и превалировала на поздних сроках гестации. В систематическом обзоре и мета-анализе H. Salehi-Pourmehr и соавт., посвященном оперативным методам лечения МКБ во время беременности, отмечается, что при экстракции конкремента эффективность составляет 95,4%, при лазерной литотрипсии – 76,4%, но основной вывод – это то, что эндоскопические методы лечения являются эффективными и безопасными с развитием нежелательных явлений менее, чем в 10% [20]. В нашей работе достижение статуса «stone-free» во время выполнения уретероскопии наблюдалось в 92,8%. А осложнения вне зависимости от степени их выраженности по Clavien–Dindo не превышали 8%.
Заключение. Выбор тактики лечения обструктивной уропатии у беременных должен основываться на этиопатогенетической причине и иметь мультидисциплинарный подход. При наличии МКБ вне зависимости от сроков гестации оперативное лечение является эффективным и безопасным методом. При отсутствии МКБ дренирование мочевыводящих путей должно выполняться строго по показаниям, а также следует избегать длительного и отдавать предпочтение краткосрочному дренированию, учитывая минимальное количество повторных «ре-стентирований».



