Введение. Почти все пациенты, перенесшие урологические операции, в послеоперационном периоде испытывают боль. В связи с этим купирование боли представляется важной задачей, решение которой улучшает качество жизни пациентов. Кроме того, эффективное обезболивание способствует ранней реабилитации пациентов, уменьшает частоту послеоперационных осложнений и хронических болевых синдромов [1, 2].
Существует много лекарственных средств и методов немедикаментозного обезболивания. Однако, как показали исследования, проведенные в различных странах, в раннем послеоперационном периоде почти у половины пациентов наблюдается недостаточная анальгезия [5, 6, 8, 9]. Это указывает на важность эффективного обезболивания в послеоперационном периоде.
Одновременное использование разных по механизму лекарственных средств, например трамадола и ацетаминофена, блокирует проведение ноцицептивных болевых импульсов на всех уровнях. Также это способствует уменьшению дозы каждого из анальгетиков, повышению эффективности обезболивания, снижению риска побочных эффектов. Некорригированные явления стресс-ответа замедляют восстановление в послеоперационном периоде, обусловливают большую частоту послеоперационных осложнений [4, 7]. Для детей лучшим обезболиванием после травматичных операций является сочетанное применение НПВП и опиоидных анальгетиков. Синергизм анальгетического действия опиоидов и НПВП уменьшает необходимость использования опиоидов на 20–60%, снижает вероятность развития побочных эффектов. Это сочетание препаратов улучшает внешнее дыхание, способствует восстановлению работы желудочно-кишечного тракта [3].
Цель исследования: разработать оптимальные методы послеоперационного обезболивания при интенсивном болевом синдроме у детей, перенесших урологические операции.
Материалы и методы. В исследование включены 34 пациента, перенесших урологические операции. Дети в возрасте 7–10 лет составили 70,6% от общего количества пациентов, от 11 до 15 лет – 29,4%. Среди пациентов мальчиков было 55,9%, девочек – 44,1%. Для объективной оценки эффективности анальгезии использовали клиническое исследование с определением интенсивности боли по визуальной аналоговой шкале (ВАШ), определение систолического и диастолического артериального давления (АДс, АДд соответственно), пульсоксиметрию (satO2, Ps) и эхокардиографическое исследование. Рассчитывали ударный индекс (УИ)=УОС/S, сердечный индекс (СИ)=МОС/S и удельное периферическое сопротивление (УПС)=АДс/СИ
Эхокардиографию проводили на эхокардиографе Aloka SSD-260 (Япония) с датчиком 3,5 мГц. Оценивали пять параметров: конечные диастолический и систолический объемы левого желудочка (КДО и КСО соответственно), ударный объем сердца (УОС), который рассчитывали как разность между КДО и КСО, фракцию выброса – как отношение УОС к КДО, фракцию циркулярного укорочения переднезаднего размера левого желудочка.
Пациентам первой группы (n=10) при появлении болевого синдрома каждые 6 ч внутривенно вводили трамадол в дозе 2 мг/кг массы тела.
Во второй группе больных (n=12) в таком же случае к той же дозе трамадола капельно добавляли инфулган (парацетамол) 15 мг/кг. Введение препаратов осуществляли каждые 12 ч.
В третьей группе (n=12) при возникновении боли каждые 6 ч использовали кеторолак в дозе 20 мг/кг массы тела.
Изучали клиническое состояние пациентов с субъективной оценкой интенсивности боли по ВАШ. Гемодинамику оценивали на первом этапе – при появлении боли, втором, третьем, четвертом и пятом этапах – через 30, 60 мин, через 2 и 4 ч после обезболивания соответственно.
Статистическая обработка полученных результатов проведена с использованием t-критерия Стьюдента
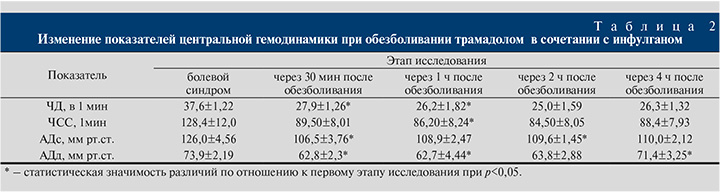
Результаты. В исследуемых группах у детей в раннем послеоперационном периоде болевой синдром не развивался в течение 2,3±0,5 ч. При возникновении боли дети становились неспокойными, плакали, а более старшие говорили о боли в области раны. В первой группе пациентов при развитии болевого синдрома показатели ЧД составили 38,2±1,92 в 1 мин, ЧСС – 132,8±5,9 в 1 мин, АДс и АДд – 128,0±5,56 и 75.9±3.05 мм рт.ст. соответственно (табл. 1).

Через 30 мин после обезболивания трамадолом дети стали чувствовать себя лучше, адекватно отвечали на вопросы, не жаловались на боль. В области раны боль также не ощущалась, безболезненными были кашель и глубокое дыхание. Поведенческие реакции, характеризующие болевой синдром, не наблюдались. Клинические показатели оставались стабильными. ЧСС уменьшилась на 17,85% (р<0,05), АДс – на 10,55%, АДд – на 13,31%.
Спустя 1 ч после обезболивания состояние детей стабилизировалось, жалобы, в том числе на боль, отсутствовали, повышалась их двигательная активность. При пальпации боль также не ощущалась. Достоверно уменьшился показатель ЧД (на 18,32%) по сравнению с первым этапом исследования и на 1,27% по сравнению со вторым этапом. Частота сердечных сокращений уменьшилась на 18,3% по сравнению с первым этапом. Показатели АДс и АДд уменьшились на 13,36 и 17,39%.
Через 2 ч после обезболивания трамадолом ЧД уменьшилась на 16,23%, ЧСС – на 14,53%. Отмечалось снижение АДс на 12,81% и АДд на 16,60%, причем изменения были статистически значимыми по сравнению с первым этапом исследования.
Через 4 ч после обезболивания констатировали уменьшение ЧД на 10,21%, ЧСС на 3,31%, АДс на 7,03% и АДд на 3,29% (см. табл. 1). До развития болевого синдрома субъективная оценка интенсивности боли по ВАШ составила 2,47±0,18 балла. Дети адекватно отвечали на вопросы, не жаловались на боль в покое. Их состояние было стабильным.
В раннем послеоперационном периоде у 8 (22,5%) детей отмечено повышение температура тела. Показатели почасового диуреза достигли 24,4±4,7 мл/ч.
При клиническом лечении второй группы трамадолом в сочетание с инфулганом (парацетамол) можно судить по табл. 2.
Через 30 мин после обезболивания ни один ребенок не жаловался на боль. В области раны боли не было, безболезненными были кашель и глубокое дыхание. Не было в поведении пациентов никаких реакций, говоривших о боли. Оценка интенсивности боли по ВАШ составляла 1,28±0,16 балла (p<0,01 по сравнению с предыдущим этапом). Стабильными были и клинические показатели.
Через 1 ч после обезболивания состояние стабилизировалось. Активность увеличивалась, жалоб не было, дети активно двигались в кроватях. Не было боли и при пальпации раны. Интенсивность боли по ВАШ соответствовала 1 баллу. Показатели почасового диуреза повысились до 32,3±5,2 мл/ч.
Спустя 2 ч после начала обезболивания у всех детей в покое, при движении, при кашле и пальпации раны боль отсутствовала. Двигательная активность сохранялась. Интенсивность боли по ВАШ не изменилась. Повышение температуры тела отмечено у 5 (13,9%) пациентов. Почасовой диурез практически не менялся, составив 32,8±4,5 мл/ч.
Через 4 ч после обезболивания одному ребенку стало больно двигаться и глубоко дышать. Интенсивность боли по ВАШ сохранялась, как на предыдущем этапе обезболивания. В норме был и почасовой диурез – 36,2±6,8 мл/ч. Длительность обезболивания составила 4,3±0,62 ч.
В данной группе исследования немного изменялись сердечный индекс и УИ. На пятом этапе исследования показатель СИ характеризовался тенденцией к уменьшению (5,3%). Во время всего исследования оставалась стабильной и насосная функция сердца, почти не изменялись и показатели ФИ. Показатель СДД продемонстрировал тенденцию к постепенному незначительному снижению: от 76,75±2,22 в момент обезболивания до 71,75 ±1,5 через 4 ч после обезболивания. В начале обезболивания на 12,5% по сравнению с исходными данными снизилось УПС, но через 1 ч оно повысилось до 18,10±2,77. Этот показатель был на 3,1% выше такового, зарегистрированного на предыдущем этапе. По прошествии 5 ч УПС незначительно снизилось – на 5,9%.
При возникновении боли со стороны пациентов были отмечены защитные действия (44,4% наблюдений) или неподвижное положение тела (50%). Если анализировать выражение лица, то зубы были стиснутыми (37%), губы – плотно сжатыми (33,3%), морщился лоб (33,3%). Кроме того, наблюдались плач, крики (20,3%), всхлипывания (33,3%). Оценка интенсивности боли по ВАШ составила в среднем 2,9±0,03 балла у больных второй группы на первом этапе исследования.
Через 30 мин 87% пациентов в покое не чувствовали боли, 64,8% не жаловались на боль при движении, во время откашливания и пальпации раны.
Пациенты чувствовали себя намного лучше, появились аппетит и положительные эмоции. Интенсивность боли по ВАШ снизилась до 0,5±0,05 балла (см. рисунок). У пациентов наблюдались неподвижное положение тела – 20,3%, защитная реакция – 25,9%, сморщивание лба – 25,9%, всхлипывания – 20,3%.
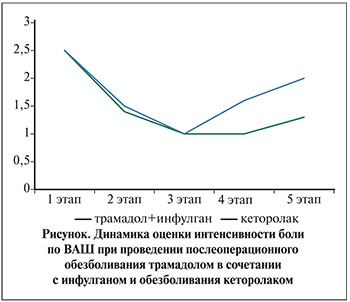
Отмечалось уменьшение ЧД, ЧСС, АДс и АДд на 14,7, 11,5, 9,7 и 15,8% соответственно. Спустя 1 ч после обезболивания боль в покое не чувствовали 90,7% пациентов, в движении, во время кашля и пальпации – 75,9%. Лишь у 24% пациентов отмечались болевые ощущения при активном откашливании, что не ухудшало общего самочувствия больных. Седативный эффект сохранялся у 62,9% пациентов. Частота поведенческих реакций снижалась: защитные действия регистрировали в 18,5% наблюдений, сморщенный лоб – в 16,6%, всхлипывание – в 16,6%. Двигательная активность сохранена. Интенсивность боли по ВАШ оценивалась в 0,4±0,08 балла. Показатели ЧД, ЧСС продолжали снижаться, АД оставалось стабильным по сравнению с предыдущим этапом. Снижение ЧД, ЧСС, АДс и АДд по сравнению с исходными величинами составило 16,2; 15,6; 13,8 и 17,5% соответственно.
Через 3 ч после обезболивания боль в покое отсутствовала у 91% детей. Боль в движении, при кашле и пальпации чувствовали 59,2% пациентов, а 46,8% ощущали умеренную боль во время сильного кашля и пальпации раны, что не ухудшало общего самочувствия и не причиняло значительных страданий. Сохранение седативного эффекта зафиксировано у 22,2% пациентов. Улучшились общее состояние и двигательная активность детей – они старались максимально удобно расположиться в кроватях. На манипуляции, перевязки реагировали безболезненно. Средний показатель интенсивности боли по ВАШ составил 0,8±0,08 балла. Снижение ЧД, ЧСС, АДс и АДд относительно исходных показателей составило 17,1, 17,3, 9 и 13,4% соответственно. Со стороны гемодинамики и дыхания отмечалось нарастание ЧД, ЧСС, АДс, АДд на 5, 12,3, 1,2И 4,5%, через 4 ч после обезболивания по сравнению с предыдущим 4-м этапом, хотя по отношению к исходу они оставались сниженными на 12,9, 7, 7,8 и 9,4% соответственно.
Таким образом, обезболивание трамадолом вместе с инфулганом обеспечивало явный анальгетический эффект. Эффективное и адекватное обезболивание было отмечено у 98% детей.
Клинически обезболивание кеторолаком сопровождалось достаточным анальгетическим эффектом, что в свою очередь улучшало гемодинамику и дыхание после операции. Об эффективном обезболивании говорят 95% наблюдений. При этом хороший анальгетический эффект был в 22,2% наблюдений, отличный – в 64,8%. Продолжительность обезболивания варьировалась от 4 до 6 ч, в 53,1% наблюдений она составила 5 ч. Отсутствие эффекта или очень слабый эффект, который требовал дополнительного обезболивания, отмечены в 12,9% наблюдений. Побочных эффектов и осложнений на протяжении всего исследования не наблюдалось.
Через 30 мин после введения кеторолака наблюдалось снижение гемодинамических показателей, за исключением УПС, которое повышается при болевом ощущении. Показатели УИ, СИ, СДД и ЧСС уменьшились на 14,29, 12, 5,89 и 2,48% соответственно, УПС возросло на 11,94% по сравнению с предыдущим периодом (см. табл. 3).

Третий этап показал увеличение УО, СДД и СИ на 20,66; 9,38 и 21,5% соответственно и снижение УПС на 13,28%. Отмечена тенденция к снижению показателя ФИ, ее можно судить по табл. 3.
Четвертый этап исследования выявил некоторые изменения в центральной и периферической гемодинамике. По сравнению с предыдущим этапом уменьшились показатели СДД на 6,75%, ЧСС на 7,87%, СИ на 11,82%, УПС на 13,56%. Стабилизация гемодинамических показателей была длительной. После применения кеторолака достоверно снижались показатели ЧСС и УПС при одновременном увеличении показателя УО. Это еще раз доказывает обеспечение адекватной аналгезии.
Таким образом, результаты оценки клинического течения послеоперационного периода с мониторингом АД, АДс и АДд исследования субъективной оценки интенсивности боли по ВАШ и показателей центральной гемодинамики показали обеспечение относительной стабильности состояния больных адекватного обезболивания болевого синдрома после урологических операций у детей второй группы, которым осуществлялось обезболивание трамадолом в сочетании с инфулганом. В первой группе препарат трамадол обеспечивал обезболивание малым анальгетическим эффектом. Одновременное применение двух препаратов реализуется в несколько раз более выраженным анальгетическим эффектом по сравнению с кеторолаком.
Выводы
1. Результаты анализа интенсивности боли по ВАШ при введении трамадола и инфулгана после урологических операций свидетельствуют об эффективности обезболивания.
2. Обезболивание трамадолом в сочетании с инфулганом у детей обеспечивает спокойный послеоперационный период, стабильность физиологических показателей по сравнению с п/о обезболиванием кеторолаком.
3. Приведенные результаты свидетельствуют, что адекватное послеоперационное обезболивание после урологических операций сохраняется на 5–7 ч при использовании трамадола и инфулгана. Это способствует снижению медикаментозной нагрузки на детский организм.
4. Основным преимуществом послеоперационного обезболивания трамадолом и инфулганом является стабильность гемодинамических показателей, что особенно необходимо перенесшим урологические вмешательства у детей.



