Введение. Инфекционно-воспалительные заболевания мочеполовой системы являются одной из причин нарушения репродуктивной функции и снижения качества жизни пациентов. Повреждение тканей на фоне инфекционного процесса может происходить как в результате прямого воздействия микроорганизмов, так и опосредованным путем вследствие воспалительной реакции в ответ на инфицирование патогенными микроорганизмами или на массивную колонизацию эндогенными условно-патогенными микроорганизмами.
Одним из наиболее распространенных заболеваний мочеполового тракта у мужчин является уретрит. Несмотря на то что известны и неинфекционные причины возникновения уретрита, большинство случаев данной патологии имеет инфекционную природу, при этом частыми этиологическими агентами заболевания группы возбудителей инфекций, передаваемых половым путем (ИППП), являются Neisseria gonorrhoeae и Chlamydia trachomatis. Развитие нехламидийных негонококковых уретритов может быть также обусловлено Mycoplasma genitalium, Ureaplasma urealyticum, Trichomonas vaginalis, реже – вирусами простого герпеса или аденовирусами [1–3]. В отсутствие возбудителей ИППП наиболее вероятной этиологической причиной уретритов у мужчин являются микроорганизмы, вызывающие заболевания репродуктивного тракта у женщин, а также представители анаэробной микрофлоры [3–6].
До недавнего времени гипотезы о возможных инфекционных возбудителях заболеваний мочеполовой системы могли быть подтверждены только результатами культуральных исследований, что ограничивало идентификацию значительного числа микроорганизмов. Однако в последние годы в результате активного внедрения в практическую медицину молекулярно-биологических методов исследования спектр микроорганизмов – потенциальных этиологически значимых участников патологических процессов в урогенитальном тракте был значительно расширен благодаря идентификации труднокультивируемых или неподдающихся культивированию микроорганизмов [7, 8].
Попытки изучения состава микрофлоры мужской уретры у пациентов с ИППП и поиск доказательств гипотезы о зависимости восприимчивости к инфекциям от состава биоты мужской уретры предпринимались ранее с помощью бактериологических методов. Однако результаты данных исследований часто являлись противоречивыми. Так, при культивировании микроорганизмов из уретральных соскобов, полученных от здоровых мужчин и мужчин с хламидийным и нехламидийным негонококковым уретритом, были выделены разные популяции бактерий [9].
Применение высокотехнологичного метода масс-спектрометрии позволило расширить представления о видовой идентификации условно-патогенных микроорганизмов и увеличить спектр ее выявления на 43,5%. При исследовании микробного спектра урогенитального тракта больных уретритом методом масс-спектрометрии было установлено, что наиболее часто из условно-патогенных микроорганизмов выделялись грамположительные, факультативно-анаэробные микроорганизмы рода Staphylococcus (74,4%), Streptococcus (52,7%), Enterococcus (15,7%), микроорганизмы семейства Enterobacteriaceae (11,5%) в умеренных и высоких диагностических титрах. При этом спектр идентифицируемых видов Streptococcus, Staphylococcus, Corynebacterium, неферментирующих грамотрицательных палочек с применением высокотехнологичного метода MALDI TOF MS был увеличен в 2,2 раза по сравнению с классическим бактериологическим исследованием [10].
В последние годы идет активное развитие некультуральных молекулярно-биологических методов, основанных на анализе нуклеиновых кислот микроорганизмов, что позволяет получать новые данные о составе микрофлоры половых путей при различной патологии. Так, в работе [4] исследование 16S rРНК микроорганизмов позволило выявить существенные различия микробных сообществ у мужчин с уретритом по сравнению со здоровыми мужчинами.
Одной из современных технологий идентификации микроорганизмов является полимеразная цепная реакция с регистрацией результатов в режиме реального времени (ПЦР-РВ) – метод, обеспечивающий возможность количественной оценки любого необходимого спектра инфекционных агентов в биологической пробе. Комбинация высокой чувствительности и специфичности, низкий риск контаминации, скорость получения результата исследования (1–1,5 ч), возможность количественного анализа и идентификации некультивируемых микроорганизмов делают технологию ПЦР-РВ высоковостребованной для диагностики урогенитальных инфекций.
Цель исследования: провести сравнительное изучение состава микробиоты уретры у мужчин с уретритами, вызванными ИППП, и здоровых мужчин.
Материалы и методы. В исследование были включены 103 мужчины в возрасте от 18 до 45 лет, разделенных на 2 группы. В группу исследования вошли 42 мужчины, обратившихся в медицинские организации с жалобами со стороны мочеполового тракта. У пациентов данной группы были выявлены объективные симптомы уретрита, подтвержденные наличием лейкоцитарной реакции в мазках, окрашенных по Граму, а также один или нескольких облигатных патогенов (T. vaginalis, N. gonorrhoeae, C. trachomatis, M. genitalium), идентифицированных методом ПЦР.
Группу сравнения составил 61 мужчина, не имевший субъективных и объективных признаков инфекционно-воспалительного процесса мочеполового тракта и не инфицированный возбудителями ИППП.
Критериями включения в группу сравнения являлись:
- отсутствие субъективных и объективных симптомов заболевания мочеполовой системы;
- наличие в отделяемом уретры не более 5 полиморфно-ядерных лейкоцитов в поле зрения при просмотре более 5 полей зрения при увеличении светового микроскопа 1000;
- отсутствие облигатных патогенов (T. vaginalis, N. gonorrhoeae, C. trachomatis, M. genitalium), подтвержденное результатами ПЦР;
- отсутствие приема антибактериальных и антианаэробных лекарственных препаратов в течение 1 мес. до настоящего исследования;
- отсутствие применения местнодействующих лекарственных препаратов (антисептических, антибактериальных и т.д.) в течение 2 нед. до настоящего исследования;
- отсутствие незащищенных половых контактов в течение 3 дней до настоящего исследования.
Критерием исключения из группы сравнения являлось наличие заболеваний, способных влиять на результаты исследования (сахарный диабет, дерматозы аногенитальной локализации, онкологические заболевания, иммунодефицитные состояния).
С целью идентификации патогенных и условно-патогенных микроорганизмов всем пациентам было выполнено исследование соскобов из уретры методом ПЦР-РВ (ДТ-Prime, тест-система Андрофлор® [ДНК-Технология, Москва]), при этом оценивали следующие показатели: общую бактериальную массу (ОБМ), геномную ДНК человека (ГДЧ), Lactobacillus spp, Staphylococcus spp, Streptococcus spp, Corynebacterium spp., Gardnerella vaginalis, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum, Atopobium cluster, Megasphaera spp./Veillonella spp./Dialister spp., Sneathia spp./Leptotriсhia spp./Fusobacterium spp., Bacteroides spp./Рorphyromonas spp./Prevotella spp., Anaerococcus spp., Eubacterium spp., Peptostreptococcus spp./Parvimonas spp., Pseudomonas aeruginosa/Ralstonia spp./Burkholderia spp., Haemophilus spp., Enterobacteriaceae spp./Enterococcus spp., Candida spp., T. vaginalis, N. gonorrhoeae, C. trachomatis, M. genitalium.
Показатель «Сумма Нормофлора» включил Staphylococcus spp., Streptococcus spp., Corynebacterium spp. относительно ОБМ; показатель «Сумма Бактериальный вагиноз — ассоциированные бактерии (БВ–АБ)»: G. vaginalis, M. hominis, U. urealyticum, U. parvum, Atopobium cluster, Megasphaera spp./Veillonella spp. /Dialister spp., Sneathia spp./Leptotrichia spp./Fusobacterium spp.; показатель «сумма Анаэробы» – Bacteroides spp./Porphyromonas spp./Prevotella spp., Anaerococcus spp., Eubacterium spp.
Исследование мочи не выполняли, так как это не входило в задачи исследования.
Расчет общей бактериальной обсемененности уретрального биотопа, а также абсолютных количеств микроорганизмов в геномных эквивалентах (ГЭ) проводили с помощью программного обеспечения к прибору, используя математическую формулу, учитывающую номер порогового цикла при проведении ПЦР-РВ. Относительные числа микроорганизма/группы микроорганизмов ПО рассчитывали в виде разницы абсолютных значений Lg10 микроорганизма/группы микроорганизмов и ОБМ по формуле ОК=Lg10Х-Lg10(ОБМ), где ОК – относительное число, Х – показатель (микроорганизм/группа микроорганизмов).
Статистическую обработку результатов и построение ROC-кривой проводили с использованием пакета статистических программ SPSS (SPSS Inc., США). Для описания состава микробиоты вычисляли медиану абсолютных и относительных количеств микроорганизмов/групп микроорганизмов. В качестве меры дисперсии использовали верхний и нижний квартили. Сравнение групп проводили с использованием непараметрической статистики (тест Мани–Уитни).
Результаты. При анализе анамнестических данных было установлено, что субъективные симптомы уретрита у 20 (47,6%) мужчин наблюдались в течение 2–7 дней, у 22 (52,4%) – в течение 7–14 дней. Основными субъективными симптомами являлись зуд, жжение в области уретры (38; 90,5%), болезненность при мочеиспускании (29; 69%), дискомфорт в области уретры (10; 23,8%), учащенное мочеиспускание (8; 19%), патологические (гнойные, слизисто-гнойные) выделения из уретры (38; 90,5%). При осмотре у всех пациентов группы исследования были выявлены объективные симптомы уретрита – гиперемия и отечность слизистой оболочки наружного отверстия мочеиспускательного канала (38; 90,5%) и/или инфильтрация стенок уретры (29; 69%) и/или патологические (гнойные, слизисто-гнойные) выделения из уретры (38; 90,5%).
По результатам микроскопического исследования уретральных мазков, окрашенных метиленовым синим и по Граму, у 11 (26,2%) пациентов группы исследования было выявлено от 5 до 10 полиморфно-ядерных лейкоцитов в поле зрения, у 14 (33,3 %) – от 10 до 20, у 17 (40,5%) – более 20.
Согласно результатам обследования на ИППП у пациентов группы исследования были идентифицированы C. trachomatis (26; 61,9 %), M. genitalium (10; 23,8 %), N. gonorrhoeae (5; 11,9 %) и T. vaginalis (1; 2,3 %).
При анализе показателей ОБМ было установлено, что бактериальная обсемененность уретрального биотопа у пациентов с ИППП была существенно выше, чем в группе сравнения (5,8 и 4,7 Lg10 соответственно), при этом у 6 (9,8%) человек из группы здоровых мужчин данный показатель был ниже порогового значения 4,0 Lg10. Самый высокий уровень бактериальной обсемененности был выявлен у пациентов, инфицированных N. gonorrhoeae (6,4 Lg10); при идентификации C. trachomatis, M. genitalium и T. vaginalis показатели ОБМ составили 5,7 Lg10, 5,5 и 6,1 Lg10 соответственно (табл. 1).
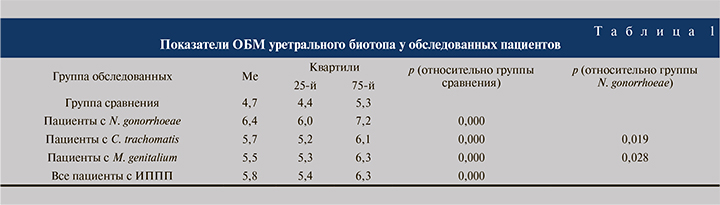
При детальном изучении уретрального биотопа было установлено отсутствие достоверных различий по абсолютным значениям показателей условно-патогенных генитальных микоплазм (U. urealiticum, U. parvum, M. hominis) и Candida spp. у пациентов, инфицированных ИППП, и пациентов группы сравнения. Также не было выявлено значимых различий по относительным значениям следующих показателей: Lactobacillus spp., G. vaginalis, Atopobium cluster, Sneathia spp./Leptotrichia spp./ Fusobacterium spp., Haemophilus spp., Pseudomonas aeruginosa/Ralstonia spp./Burkholderia spp. и Enterobacteriaceae spp./ Enterococcus spp.
Статистически значимо более низкий уровень относительного числа Staphylococcus spp., Streptococcus spp., Corynebacterium spp. и их суммы был выявлен у пациентов с ИППП в целом, а также у пациентов с C. trachomatis и M. genitalium. У пациентов, инфицированных N. gonorrhoeae, уровень относительного количества Staphylococcus spp., Corynebacterium spp. был ниже, чем в группе сравнения, а относительный уровень Streptococcus spp. статистически значимо не отличался от группы клинически здоровых мужчин.
У пациентов с ИППП в целом по сравнению с группой сравнения было выявлено увеличение относительного числа следующих облигатно-анаэробных условно-патогенных микроорганизмов: Megasphaera spp./Veillonella spp./Dialister spp., Anaerococcus spp., Peptostreptococcus spp./Parvimonas spp. и Eubacterium spp. При этом у пациентов, инфицированных C. trachomatis, былj значимо выше относительное число Peptostreptococcus spp./Parvimonas spp., у пациентов, инфицированных M. genitalium, – Megasphaera spp./Veillonella spp./Dialister spp., Anaerococcus spp., Peptostreptococcus spp./Parvimonas spp. и Eubacterium spp.
У пациентов с N. gonorrhoeae значимых различий с группой сравнения в относительном числе условно-патогенных микроорганизмов выявлено не было (табл. 2).
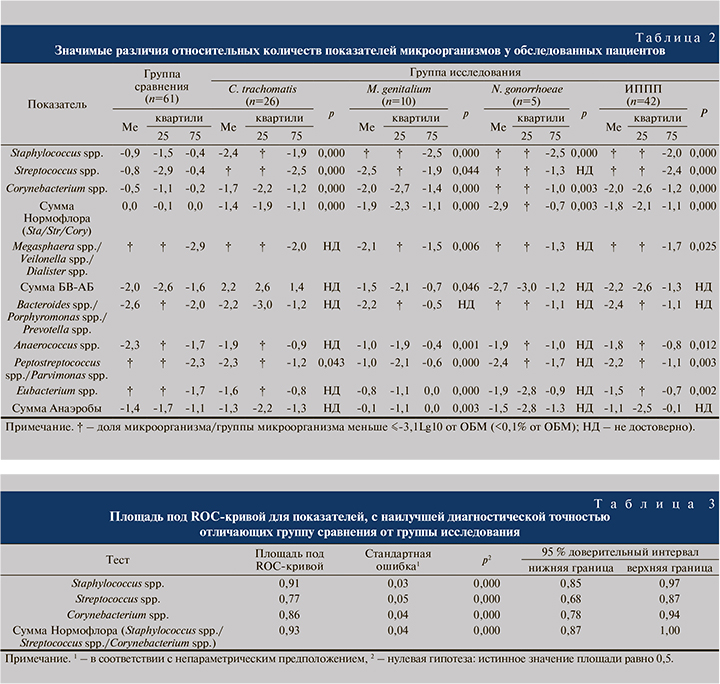
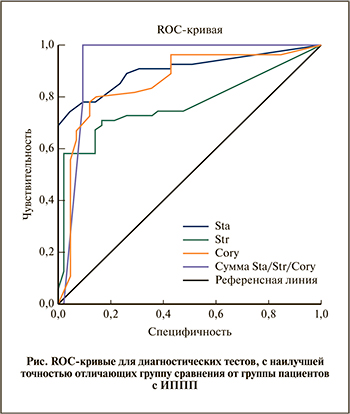
Для подтверждения предположения о том, будто в большинстве наблюдений Staphylococcus spp., Streptococcus spp., Corynebacterium spp. относятся к микроорганизмам, преимущественно занимающим основную долю ОБМ у здоровых мужчин, а также для оценки роли показателя «Сумма Нормофлора», был выполнен ROC-анализ, обладающий наибольшей предсказательной ценностью и позволяющий наглядно демонстрировать разницу групп. Самая высокая диагностическая точность (0,93), которая расценивается как отличная, была получена для показателя «Сумма Нормофлора» (см. рисунок, табл. 3).
 Обсуждение. В настоящее время данные о составе нормальной уретральной микробиоты у мужчин достаточно ограничены и в большинстве известных исследований получены на маленьких выборках пациентов. Так, в работе Ю. В. Иванова [2] у 33 клинически здоровых мужчин культуральным методом были выявлены Staphylococcus epidermidis, Corynebacterium spp., Lactobacillus, Haemophilus vaginalis, Streptococcus α-haemolyticus. Известно, что среди представителей микробного сообщества эпидермиса преобладают стафилококки, стрептококки и коринебактерии [11], в связи с чем проводились исследования по изучению частоты выявления данных микроорганизмов и из отделяемого мочеполовой системы. Q. Dong et al., а также Fouts D.E. et al. [12, 13] при изучении образцов, полученных из уретры здоровых добровольцев, констатировали преобладание Corynebacterium и сделали заключение, согласно которому эти микроорганизмы могут играть определенную роль в поддержании нормальной уретральной микрофлоры.
Обсуждение. В настоящее время данные о составе нормальной уретральной микробиоты у мужчин достаточно ограничены и в большинстве известных исследований получены на маленьких выборках пациентов. Так, в работе Ю. В. Иванова [2] у 33 клинически здоровых мужчин культуральным методом были выявлены Staphylococcus epidermidis, Corynebacterium spp., Lactobacillus, Haemophilus vaginalis, Streptococcus α-haemolyticus. Известно, что среди представителей микробного сообщества эпидермиса преобладают стафилококки, стрептококки и коринебактерии [11], в связи с чем проводились исследования по изучению частоты выявления данных микроорганизмов и из отделяемого мочеполовой системы. Q. Dong et al., а также Fouts D.E. et al. [12, 13] при изучении образцов, полученных из уретры здоровых добровольцев, констатировали преобладание Corynebacterium и сделали заключение, согласно которому эти микроорганизмы могут играть определенную роль в поддержании нормальной уретральной микрофлоры.
Ранее было продемонстрировано, что при негонококковом уретрите наблюдается значительное снижение численных показателей аэробов в микробиоте уретры [12]. Эти данные совпадают с результатами настоящего исследования, в ходе которого установлено, что Staphylococcus являются составной частью нормальной микрофлоры у мужчин и их численные показатели снижаются при инфицировании ИППП, когда безу-словные патогены (а возможно, и условно-патогенные микроорганизмы) замещают представителей нормальной микрофлоры. Нами было показано, что ИППП являлись фактором, заведомо влияющим на состав микробиоты уретры: по сравнению с группой здоровых мужчин у пациентов с ИППП были снижены численные показатели по трем группам бактерий: Staphylococcus, Streptococcus и Corynebacterium, как по отдельности, так и в сумме. ROC-анализ показал, что наилучшим диагностическим показателем, отличающим группу здоровых мужчин от пациентов с ИППП, является сумма указанных групп микроорганизмов (площадь под ROC-кривой 0,93±0,04, p<0,001).
Вывод о возможной взаимосвязи ИППП с условно-патогенными анаэробными микроорганизмами был сделан в работе D. E. Nelson et al. [3]. В настоящем исследовании у пациентов с хламидийной и микоплазменной инфекциями по сравнению со здоровыми лицами также отмечалось увеличение групп некультивируемых и труднокультивируемых анаэробных бактерий (Megasphaera spp./Veilonella spp./Dialister spp., Bacteroides spp./Porphyromonas spp./Prevotella spp., Anaerococcus spp. и Peptostreptococcus spp./Parvimonas spp.), которые ранее связывали с бактериальным вагинозом у женщин [9, 14, 15]. Таким образом, предположения D. E. Nelson et al. [3] о том, что анаэробные микроорганизмы, ассоциированные с развитием бактериального вагиноза, могут быть связаны с риском заражения ИППП у мужчин, нашли подтверждение и в настоящей работе. Тем не менее результаты исследования, полученные нами, так же как и данных D. E. Nelson о возможной связи анаэробов с развитием ИППП, недостаточно для того, чтобы сделать заключение о том, каким образом ИППП-ассоциированные сообщества микроорганизмов взаимосвязаны с заболеванием: предшествуют ему, передаются совместно с возбудителями ИППП или увеличиваются вследствие ИППП?
Заключение. Сравнительное исследование состава микробиоты уретры у здоровых мужчин в норме и мужчин с ИППП, выполненное методом ПЦР-РВ, продемонстрировало увеличение общей бактериальной обсемененности уретры при ИППП, наиболее выраженное при инфицировании N. gonorrhoeae. Наилучшим диагностическим показателем, отличающим таковые нормальной микробиоты от микробиоты пациентов с ИППП, являлась сумма Staphylococcus spp., Streptococcus spp. и Corynebacterium spp. У пациентов с клиническими признаками воспаления и наличием ИППП установлено снижение нормофлоры при всех видах ИППП и увеличение числа ряда облигатных анаэробных бактерий – Megasphaera spp./Veillonella spp./Dialister spp., Bacteroides spp./Porphyromonas spp./Prevotella spp., Anaerococcus spp., Peptostreptococcus spp./Parvimonas spp. и Eubacterium spp.



