Введение. Хламидийная инфекция (связанная с Chlamydia trachomatis) считается основным этиологическим агентом воспалительных заболеваний органов малого таза, при хроническом течении оказывающих пагубное влияние на репродуктивное здоровье, вызывая серьезные осложнения: вторичное бесплодие, внематочная и прерванная беременность, у мужчин – эпидидимиты, простатиты и др. [1–4].
Показано, что частота невынашивания беременности в популяции составляет около 15‒25% [5], а неразвивающаяся беременность среди случаев самопроизвольных выкидышей – до 24,5‒28,6% [6]. Генитальные инфекции признаются главной причиной подобных осложнений [7, 8]. Длительное течение урогенитальной хламидийной инфекции (УГХИ) приводит к нарушению экспрессии прогестероновых рецепторов, снижению чувствительности к прогестерону. Под воздействием инфекционного агента стимулируется продукция провоспалительных цитокинов, а на фоне стимуляции выработки простагландинов происходит размягчение шейки матки [9]. Повышенный уровень антигенов C. trachomatis, имеющий место при персистирующей инфекции, приводит к хроническому воспалению и рубцеванию тканей, может играть роль в патогенезе повреждения эндометрия и маточных труб у женщин при УГХИ [10].
Возможные причины развития вторичного бесплодия у мужчин, опосредованные хронической УГХИ, включают:
1. Воспалительные реакции, которые приводят к активации лейкоцитов, высвобождению кислородных радикалов, протеаз и цитокинов, что может снижать спермальную моторику и влиять на акросомную реакцию. Оплодотворяющая способность при этом уменьшается.
2. Длительно существующая УГХИ приводит к появлению антиспермальных антител C. trachomatis, что нередко (в 6–10% случаев) служит причиной мужского бесплодия. Антитела вызывают агглютинацию сперматозоидов, их обездвиживание и цитотоксическое уничтожение, а также препятствуют нормальной фертилизации яйцеклетки, нарушая их специфическое узнавание. Принято считать, что, если доля покрытых антителами сперматозоидов превышает 40%, беременность в естественном цикле становится невозможной.
3. Хроническая УГХИ вызывает воспалительные процессы, которые могут приводить к облитерирующим повреждениям в семенном тракте, в исключительных случаях – к окклюзивной азооспермии [11, 12].
В связи с вышеизложенным возникла необходимость комплексного изучения УГХИ с точки зрения общего инфекционного воспалительного процесса, выяснения патогенетических факторов, способствующих развитию осложненных форм заболевания. Результаты исследова-ний свидетельствуют о нарушении функций иммунной системы при УГХИ [12–19]. Однако участие иммунной системы в формировании хронического патологического процесса при УГХИ остается дискуссионным.
Цель исследования: оценить выраженность иммунологических нарушений у пациентов с УГХИ и эффективности использования антибактеральной терапии в сочетании с системной энзимотерапией для эрадикации патогенного возбудителя и коррекции выявленных нарушений функционирования иммунной системы.
Материалы и методы. Проведено открытое сравнительное проспективное исследование. Обследованы 419 мужчин и женщин (средний возраст – 26,7±1,25 года), обратившихся в кабинет анонимного обследования и лечения (КАОЛ) ИППП (Новосибирск).
Из них 128 практически здоровых женщин, проходивших плановый медицинский осмотр (работники предприятий торговли и общественного питания [50%], органов здравоохранения [26%], пищевой промышленности [24%]); 107 беременных женщин по направлению врача-акушера-гинеколога; 104 женщины с обострением хронических ВЗОМТ (57%) и нарушениями фертильной функции (43%), а также 120 мужчин, напрямую обратившихся в КАОЛ. Все исследования проводились с использованием метода случайной репрезентативной выборки среди неорганизованного населения [20].
Проводилось лабораторное исследование материала из цервикального канала или уретры на наличие C. trachomatis.
Диагноз УГХИ был верифицирован у 84 человек (51 мужчина и 33 женщины в возрасте от 23 до 47 лет, длительность заболевания от 2 до 7 лет), обратившихся к дерматовенерологу в КАОЛ (Новосибирск) с одной из следующих жалоб (табл. 1). У 14 больных (9 мужчин и 5 женщин) жалобы отсутствовали.

Диагноз УГХИ устанавливался на основании данных анамнеза, субъективных и объективных клинических признаков, положительных результатов лабораторной диагностики C. trachomatis методом полимеразной цепной реакции (ПЦР) («АмплиСенс», ЦНИИЭ МЗ РФ, Москва, Россия).
На каждого из пациентов заполнялась индивидуальная амбулаторная карта, в которой регистрировались анамнестические данные, клинические проявления и результаты лабораторной диагностики.
Помимо C. trachomatis у пациентов выявлены U. urealyticum – 10 (11,9%) больных, M. hominis – 4 (4,8%), M. genitalium – 11 (13,1%). Обнаружены также ассоциации: с Candida albicans у 16 (19,0%) больных и с Gardnerella vaginalis у 8 (9,5%) больных УГХ.
Для оценки эффективности этиотропной и патогенетической терапии больные УГХИ были случайной выборкой рандомизированы на две группы для последующего лечения.
Первая клиническая группа (42 человека) получала адекватную этиотропную антибактериальную терапию на фоне системной энзимотерапии.
Для этого использовались:
1. Доксициклина моногидрат (Юнидокс Солютаб, «Астеллас», Нидерланды), назначался по 100 мг 2 раза в сутки (первая доза – 200 мг) через равные интервалы в течение 10 дней. Суточная доза – 200 мг, курсовая – 2,0 г.
2. Флогэнзим («Мукос Фарма», Германия), содержащий 90 мг бромелаина, 48 мг трипсина и 100 мг рутина, назначался по 3 драже 2 раза в сутки (за 30 мин до еды) в течение 14 дней.
Вторая клиническая группа (42 человека) получала только антибактериальную терапию (доксициклина моногидрат) в тех же дозах, что и в первой клинической группе.
Критериями включения в исследование были пациенты с доказанной УГХИ, давшие согласие воздержаться от незащищенных половых контактов на время проводимого лечения и последующего наблюдения.
Критерии исключения: непереносимость тетрациклинов в анамнезе, почечная и печеночная недостаточность, заболевания ЖКТ; прием антибактериальных препаратов в течение 1 мес/до обращения. Также не включались в исследование пациенты, у которых наряду с C. trachomatis диагностировались другие ИППП.
Контрольные исследования методом ПЦР («АмплиСенс», ЦНИИЭ МЗ РФ, Москва; Россия) проводили через 1,5 и 3 мес. после завершения курса лечения. В ходе всего лечения и последующего контроля пациенты должны были исключить незащищенные половые контакты.
С учетом цели исследования проводились как у больных УГХИ (84 человека), так и в контрольной группе (32 практически здоровых человека). Характер иммунопатологических реакций и состояние системы протеиназы/антипротеиназы оценивали по уровням γ-интерферона (γ-ИФН), интерлейкина-1β (ИЛ-1β), -4 (ИЛ-4), -6 (ИЛ-6), циркулирующих иммунных комплексов (ЦИК), лактоферрина (ЛФ) и α2-макроглобулина (α2-МГ) в сыворотке крови: содержание ЦИК оценивали методом жидкостной преципитации 4% ПЭГ-600 (Н. А. Константинова и др., 1986) [21]; определение α2-МГ проводили согласно методике К. Н. Веремеенко (1969) [22], содержание уровня ЛФ – с помощью тест-системы «ЛАКТОФЕРРИН-стрип D-4106» (ЗАО «Вектор-Бест», п. Кольцово, Новосибирская область, Россия); уровень γ-ИНФ определяли с помощью тест-системы «γ-ИФН-ИФА-БЕСТ» (ЗАО «Вектор-Бест», п. Кольцово, Новосибирская область, Россия), уровень ИЛ-1β, -4, -6 – с помощью тест-систем «ProCon ИЛ-1β», «ProCon ИЛ-4», «ProCon ИЛ-6» (ООО «Протеиновый контур», Санкт-Петербург, Россия).
 Статистическая обработка полученных данных проведена с помощью статистической программы SPSS 6.0. Достоверность различий оценивали по t-критерию Стьюдента. Отношение шансов (OR) c доверительными интервалами (95% CI) рассчитывали по таблице сопряженности. Критерием статистической достоверности был уровень p<0,05.
Статистическая обработка полученных данных проведена с помощью статистической программы SPSS 6.0. Достоверность различий оценивали по t-критерию Стьюдента. Отношение шансов (OR) c доверительными интервалами (95% CI) рассчитывали по таблице сопряженности. Критерием статистической достоверности был уровень p<0,05.
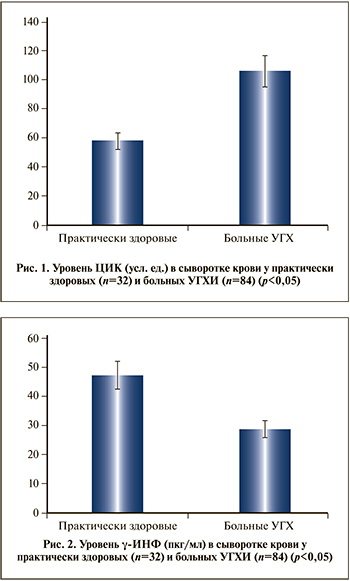
Результаты исследования. При изучении иммунологических показателей обнаружено (рис. 1), что уровень ЦИК в сыворотке крови больных УГХИ значимо выше нормативных показателей.
Формирование ЦИК (комплекс антиген–антитело) считается этапом любого инфекционного процесса.
У больных УГХИ также активизируются аутоиммунные реакции, что приводит к достоверному (р<0,05) увеличению уровня ЦИК (в 1,83 раза) в сыворотке крови по сравнению контролем (106,1±5,12 против 57,8±3,39 усл. ед.; p<0,05).
Важнейшим молекулярным механизмом, регулирующим активность иммуноцитов, считаются цитокины, среди них особую роль в антихламидийном иммунитете отводят γ-ИФН.
Анализ содержания γ-ИФН показал (рис. 2), что его концентрация у больных УГХИ в 1,64 раза ниже, чем у практически здоровых лиц (28,9±4,15 против 47,3±4,26 пкг/мл; p<0,05).
Изучение особенностей патогенеза C. trachomatis и реакций иммунитета заставляет рассматривать баланс системы интерлейкинов у больных УГХИ. Такой анализ целесообразно проводить с учетом роли отдельных интерлейкинов, их про- и противовоспалительных свойств.
Проведенные исследования показали, что изменение содержания ИЛ в крови больных УГХИ имеет однонаправленный вектор, т.е. характеризуется повышением как про-, так и противовоспалительных цитокинов (табл. 2).

Так, уровень провоспалительного ИЛ-1β в сыворотке крови больных УГХИ в 3,12 раза выше по сравнению с практически здоровыми лицами. Аналогичная закономерность отмечается и для ИЛ-6, содержание которого в крови больных УГХИ увеличено в 2,13 раза (p<0,001).
 Аналогичный характер повышения отмечен и при оценке концентрации противовоспалительного ИЛ-4 в сыворотке крови больных УГХИ достоверно выше (в 1,65 раза) по сравнению с практически здоровыми лицами (p<0,05).
Аналогичный характер повышения отмечен и при оценке концентрации противовоспалительного ИЛ-4 в сыворотке крови больных УГХИ достоверно выше (в 1,65 раза) по сравнению с практически здоровыми лицами (p<0,05).
Плейотропность цитокинов и их активное участие во взаимоотношениях иммунокомпетентных клеток с гомеостатическими системами при УГХИ во многом определяют состояние общих механизмов противоинфекционной защиты организма. Таким образом, полученные результаты свидетельствуют о наличии дисбаланса в продукции цитокинов Тh-1- и Тh-2-типов при УГХИ со смещением баланса ИЛ в сторону провоспалительных типов.
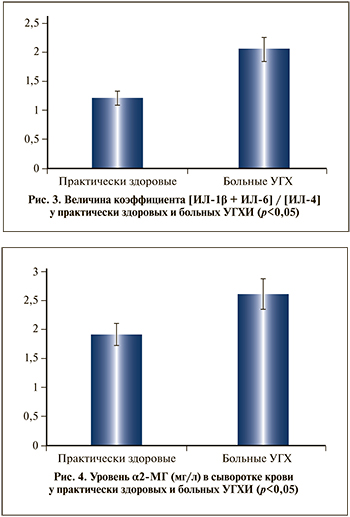
Наглядно это видно при расчете коэффициента соотношений [ИЛ-1β+ИЛ-6]/[ИЛ-4] в норме и патологии (рис. 3).
Указанные закономерности могут быть связаны с активностью нейтрофильных гранулоцитов крови, с их способностью синтезировать ЛФ, обладающего высоким антипаразитарным, антивирусным и антибактериальным действиями, а также выступающего в качестве ингибитора протеаз и прокоагулянтного фактора.
При анализе уровня ЛФ выявлено, что его концентрация у больных УГХИ в 2,37 раза превышает показатель в группе практически здоровых лиц (1742,0±112,15 и 732,1±36,11 нг/мл; p<0,001). Высокий уровень ЛФ, очевидно, служит свидетельством выраженности местного воспаления при УГХИ.
Корреляционный анализ подтвердил это, обнаружив наличие положительной корреляции между уровнем ЛФ и ИЛ-1 (r=+ 0,67; p<0,05), ИЛ-6 и ЛФ (r=+ 0,59; p<0,05) в крови больных УГХИ.
Важно, что высокие уровни цитокинов могут быть связаны как с высокой активностью иммунокомпетентных клеток (В-, Т-лимфоцитов, макрофагов и др.), так и с рядом иных процессов, например, в системе протеолитических ферментов/антипротеаз. Показано, что α2-МГ активно участвует в регуляции уровней цитокинов [28–30], поэтому необходима оценка его концентрации в крови больных УГХИ.
При анализе содержания α2-МГ у больных УГХИ нами выявлено, что его величина достоверно (в 1,36 раза) превышает аналогичные величины в группе практически здоровых лиц (2,59±0,21 и 1,9±0,47 мг/л; p<0,001) (рис. 4).
 В настоящее время доказано, что α2-МГ влияет на многие функции системы иммунитета: модулирует ответ клеток на воздействие мутагенов, стимулирует лимфо- и гранулоцитоз, связывает липополисахариды и ионы металлов, однако одной из ключевых его функций является неспецифическая протеазосвязывающая способность [23–30].
В настоящее время доказано, что α2-МГ влияет на многие функции системы иммунитета: модулирует ответ клеток на воздействие мутагенов, стимулирует лимфо- и гранулоцитоз, связывает липополисахариды и ионы металлов, однако одной из ключевых его функций является неспецифическая протеазосвязывающая способность [23–30].
У всех больных УГХИ (84 человека) указанные иммунологические параметры определялись до начала и после лечения (1,5–3 мес.) в процессе диспансерного наблюдения.
Среди больных УГХИ первой группы, получавших комплексную терапию (доксициклина моногидрат+Флогэнзим), эффективность клинического и микробиологического излечения составила 97,6% (рис. 5).
Во 2-й клинической группе эффективность клинического и микробиологического излечений при использовании доксициклина моногидрата была достоверно ниже (78,6%) статистически значимой по сравнению с исходами в первой группе (OR=11,2; 95% CI – 1,3–247,9; р=0,007).
Таким образом, применение в лечении УГХИ доксициклина моногидрата в сочетании с Флогэнзимом представляется целесообразным, так как ферментный препарат усиливает терапевтическую эффективность антибактериальных средств при хроническом течении инфекции C. trachomatis (в нашем исследовании – на 19,0%).
Особый интерес имеет оценка эффективности системной энзимотерапии (СЭТ) на течение иммунных реакций при УГХИ.
Известно, что, взаимодействуя в крови с α2-МГ, экзогенные протеиназы влияют на метаболизм медиаторов в очаге воспаления, например низкомолекулярных пептидов с кининоподобным действием (кинины, брадикинин, лейкокинины), ИЛ и т.п. Последние накапливаются в месте повреждения тканей и регулируют повышение проницаемости сосудов, миграцию лейкоцитов и др. [31–32]. Протеолитические ферменты в комплексе с α2-МГ способствуют деградации этих пептидов в очаге воспаления, что является одним из механизмов противовоспалительного и противоотечного эффектов СЭТ, а также механизма потенцирования антибиотикотерапии [31, 33–36].
При оценке изменения содержания α2-МГ в динамике системной энзимотерапии (Флогэнзим) обнаружено его достоверное снижение в крови больных УГХИ (рис. 6).
Кроме этого результаты системной энзимотерапии свидетельствует о ее благоприятном влиянии на содержание цитокинов в сыворотке крови: γ-ИФН, ИЛ-1β, -4, -6 (табл. 3).

Установлено достоверное повышение содержания γ-ИФН и снижение содержания ИЛ-1β (р<0,05), отмечена тенденция к снижению содержания ИЛ-6 и -4 на фоне терапии, впрочем, не достигшего уровня достоверности.
Таким образом, полученные результаты отражают факт уменьшения активности Тh-2-типа клеточного звена иммунитета у больных УГХИ, получавших терапию препаратом системной энзимотерапии.
Обсуждение. Считается, что ведущую роль в патогенезе C. trachomatis играют системные иммунопатологические механизмы [12–18, 37–38]. Известно, что ключевым патогенетическим механизмом УГХИ является дисбаланс цитокинов, что проявляется в снижении Тh-1-типа (γ-ИФН) и повышении уровня цитокинов Тh-2-типа (ИЛ-6) в организме больных УГХИ. При преимущественной продукции провоспалительных цитокинов (ИЛ-1β, -6) течение УГХИ приобретает хронический характер [23–26].
Обобщая исследования по вопросам иммунопатологических механизмов развития инфекции C. trachomatis в организме человека, можно в общих чертах представить единую схему патогенеза УГХИ, что не только представляет научный интерес, но и позволяет предложить варианты патогенетически обоснованной терапии.
Иммунный ответ при инфекции C. trachomatis носит преимущественно Th-1-типа характер и именно ему принадлежит решающая роль в выздоровлении [36–38]. Ключевым компонентом этого процесса является γ-ИФН, стимулирующий экспрессию ряда молекул, необходимых для развития специфического иммунного ответа при УГХИ [16–19]. Анализ концентрации γ-ИФН в нашем исследовании показал, что его уровень в сыворотке крови больных УГХИ в 1,64 раза ниже, чем у практически здоровых лиц. Хотя известно, что высокие уровни γ-ИФН ингибируют рост C. trachomatis, а низкие, наоборот: индуцируют развитие морфологически аберрантных форм включений [39–41].
Очевидно, активация неспецифических иммунных реакций и регуляция эффекторов в иммунном ответе – главная функция γ-ИФН в организме при УГХИ. Иммунитет к УГХИ в серьезной степени опосредован активностью Th-1 - типа Т-клеток, индукторов γ-ИФН, предотвращающего распространение инфекции и опосредующей элиминации возбудителя. Это связано с тем, что он усиливает экспрессию антигенов C. trachomatis, включая антигены главного комплекса гистосовместимости I и II классов, Fc-рецепторы, стимулируя активацию макрофагов, фибробластов и эпителиальных клеток, а также синтез ИЛ-1, -2 и Ig [16–19]. Повышенный уровень γ-ИФН ингибирует дифференцировку и пролиферацию Тh-2-типа, приводя к доминированию ответа Тh-1-типа, а ИЛ-4 совместно с ИЛ-10 угнетает продукцию γ-ИФН Тh-1-типа, что приводит к преобладанию ответа Тh-2-типа.
Таким образом, можно сказать, что уровни цитокинов в плазме крови отражают текущее состояние активности иммунной системы и уровень защитных реакций, т.е. синтез цитокинов клетками организма in vivo. В то же время цитокиновый дисбаланс между Тh-1- и Тh-2-типами определяет направление нарушений иммунного ответа при C. trachomatis [16–19].
Полученные данные свидетельствуют о значимом повышении концентраций основных провоспалительных ИЛ у больных УГХИ по сравнению нормой и концентрацией противовоспалительных ИЛ. Уровень ИЛ-1β и -6 у больных УГХИ в нашей работе был в 2–3 раза выше нормы, а прирост ИЛ-4 составил около 65%. Подобная закономерность в дисбалансе Th-1- и Th-2-типов цитокинов при хронических инфекционно-воспалительных заболеваниях органов репродукции отмечена и другими исследователями [16–18].
Снижение при УГХИ резервной возможности системы протеолитических ферментов с последующим увеличением уровня α2-МГ в крови способствует не только нарушению регуляции процессов локального воспаления, но и формированию иммунных расстройств на различных уровнях организма.
Необходимо учитывать и тот факт, что высокое содержание цитокинов в организме при воспалении может быть связано как с высокой активностью иммунокомпетентных клеток (В-, Т-лимфоцитов, макрофагов и др.), так и с дисбалансом в системе протеазы/антипротеазы. В настоящее время известно, что α2-МГ влияет на многие реакции системы иммунитета: тормозит ответ клеток на воздействие ряда мутагенов, связывает ионы металлов, липополисахариды, стимулирует лимфоцитоз и гранулоцитоз, но одной из главных функций является его неспецифическая протеазосвязывающая способность [27, 28]. Высокий уровень α2-МГ в крови больных УГХИ служит отражением патологического изменения динамического равновесия в системе протеиназы/антипротеиназы, что способствует нарушению регуляции цитокинов и активности протеолитических реакций в организме [27, 28].
При анализе содержания α2-МГ в сыворотке крови больных УГХИ установлено, что его величина достоверно, в 1,36 раза, превышает аналогичные величины в группе практически здоровых лиц (2,59±0,21 и 1,9±0,47 мг/л; p<0,001).
Таким образом, при длительном течении УГХИ использование (в качестве базисной патогенетической терапии) системной энзимотерапии (Флогэнзим) оказывает регулирующее воздействие на иммунные реакции при C. trachomatis, способствует усилению активности Тh-1-типа лимфоцитов по синтезу цитокинов (γ-ИФН) и снижению уровня α2-МГ и провоспалительных цитокинов (ИЛ-1β, -6) в крови. Системная энзимотерапия позволяет значительно усиливать эффективность антибиотикотерапии и снижать риск развития побочных эффектов [35, 36, 42].
Полученные результаты по действию системной энзимотерапии (Флогэнзим) на патогенез иммуновоспалительного процесса и систему протеолиза обосновывают ее применение больными УГХИ. Многогранный спектр лечебного действия системной энзимотерапии делает особенно перспективным ее применение в венерологии, гинекологии, урологии, поскольку преобладающее большинство заболеваний, связанных с нарушением репродуктивной функции человека, – это хронические патологические изменения, часто протекающие на фоне дисфункций различных органов и систем (иммунной, нервной, эндокринной и др.) [12, 24, 31–37, 42]. Патогенетические механизмы многих заболеваний органов репродукции могут служить точкой терапевтического воздействия системной энзимотерапии.
Таким образом, проведенные исследования свидетельствуют о том, что УГХИ не только характеризуется местными проявлениями со стороны мочеполовых органов, но и сопровождается патологическими процессами, в которые вовлечены универсальные системы регуляции гомеостаза, ответственные за защитные реакции организма от инфекции и функционирование его в условиях инфекционного процесса на системном уровне. Подведена патофизиологическая основа обоснования целесообразности сочетания эрадикационной антибактериальной терапии с препаратами системной энзимотерапии для повышения эффективности антибиотиков и коррекции системных иммунологических нарушений у пациентов с УГХИ.
Выводы
1. Одним из патогенетических механизмов хронизации УГХИ является дисбаланс цитокинов, проявляющийся в повышении уровня цитокинов Тh-2-типа (интерлейкина-6) и снижении цитокинов семейства Тh-1-типа (γ-ИФН) в организме больных УГХИ. Преимущественная продукция провоспалительных цитокинов (ИЛ-1β, -6) ассоциирована с длительным течением УГХИ. Снижение уровня γ-ИФН в крови больных свидетельствует о неполноценном иммунном ответе при УГХИ. Высокий уровень лактоферрина отражает активность местного воспаления при урогенитальной УГХИ.
2. Снижение при УГХИ резервной возможности системы протеиназы/антипротеиназы с последующим увеличением уровня α2-МГ в крови способствует не только нарушению регуляции процессов локального воспаления, но и формированию системных иммунных расстройств.
3. Влияние системной энзимотерапии на иммунные реакции при хронической УГХИ способствует увеличению синтеза Тh-1-типа цитокинов (γ-) и снижению уровня α2-МГ и провоспалительных цитокинов (ИЛ-1β, -6) в крови. Системная энзимотерапия позволяет значительно усилить эффективность антибиотикотерапии.



