Введение. Аутосомно-доминантный поликистозная болезнь почек (АДПБП) – наиболее распространенное наследственное заболевание почек, исходом которого является терминальная стадия хронической почечной недостаточности (ХПН) [1, 2]. В США и Европе среди всех пациентов с диагнозом «хроническая болезнь почек 5-й стадии», получающих заместительную почечную терапию, больные поликистозом составляют 8–10% [3, 4].
Трансплантация почки как метод лечения терминальной стадии ХПН также актуальна для пациентов с поликистозом, однако имеет ряд особенностей [5]. По мнению многих авторов, поликистозно измененная почка в подавляющем большинстве случаев служит резервуаром хронической инфекции и на фоне иммуносупрессии может стать причиной тяжелых осложнений посттрансплантационного периода [6]. Гнойно-септические послеоперационные осложнения – важный фактор, влияющий на выживаемость трансплантата и реципиента. Наиболее частым послеоперационным осложнением пересадки почки у больных без поликистоза является отторжение трансплантата, тогда как у больных поликистозом – инфекционные осложнения [7]. Значительное увеличение поликистозной почки препятствует выполнению пересадки донорского органа в подвздошную область. Выраженный болевой синдром, нефролитиаз, разрывы кист, рецидивирующая гематурия и частые атаки пиелонефрита служат показанием к нефрэктомии перед трансплантацией [8]. Активное развитие и внедрение в практику лапароскопических технологий способны снизить частоту послеоперационных осложнений, а также расширить показания к удалению собственных поликистозных почек при подготовке пациента к трансплантации [9].
Цель исследования: изучить возможность и безопасность выполнения одномоментной билатеральной лапароскопической нефрэктомии для пациентов с АДПБП в качестве подготовки к трансплантации почки.
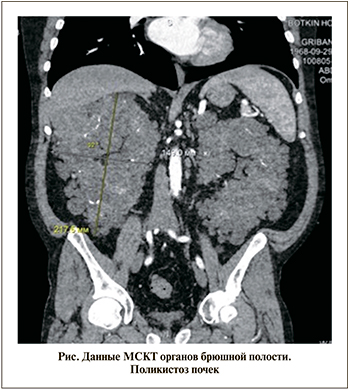 Материалы и методы. С мая 2018 по сентябрь 2019 г. в отделении трансплантации органов и/или тканей обследование для включения в лист ожидания на трансплантацию трупной почки проходили 132 пациента с терминальной стадией ХПН. Из них у 6 (4,5%) причиной терминальной почечной недостаточности оказалась АДПБП. Средний возраст 4 (66,6%) мужчин и 2 (33,4%) женщин составил 48,5±6,53 (40–59) года.
Материалы и методы. С мая 2018 по сентябрь 2019 г. в отделении трансплантации органов и/или тканей обследование для включения в лист ожидания на трансплантацию трупной почки проходили 132 пациента с терминальной стадией ХПН. Из них у 6 (4,5%) причиной терминальной почечной недостаточности оказалась АДПБП. Средний возраст 4 (66,6%) мужчин и 2 (33,4%) женщин составил 48,5±6,53 (40–59) года.
Средний индекс массы тела (ИМТ) был равен 30,19±3,67 (24–36) кг/м2. Средний вертикальный размер почек, по данным КТ, составил 211,67±37,15 (189–238) мм, средний горизонтальный размер – 145,36±19,53 (127–161) мм (см. рисунок).
У всех пациентов в общем анализе мочи отмечена лейкоцитурия 179,17±172,05 (50–500) клетки в 1 мкл.
У 5 (83,3%) пациентов при микробиологическом исследовании мочи определялась бактериурия: у 2 больных – E. coli (104 и 105 КОЕ/мл), у 1 – K. pneumoniae (103 КОЕ/мл), у 1 – P. aeruginosa (титр 103 КОЕ/мл), еще 1 больного – S. haemolyticus (105 КОЕ/мл). Четверо (66,7%) больных проходили лечение по поводу инфицированных кист. В момент обращения у всех пациентов определена терминальная стадия ХПН (средняя скорость клубочной фильтрации – 9,5 мл/мин/1,73 м2) и все они находились на программном гемодиализе.
Больным выполнен стандартный объем предтрансплантационного обследования, согласно Национальным клиническим рекомендациям по трансплантации почки. Кроме того, проведена КТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием для определения сосудистой анатомии почек и характера их структурных изменений (см. рисунок). Решение о проведении билатеральной нефрэктомии в каждом случае принималось мультидисциплинарным консилиумом в составе нефролога, уролога, трансплантолога, анестезиолога-реаниматолога, клинического фармаколога. Во всех случаях выполнена лапароскопическая билатеральная нефрэктомия. У 5 пациентов операция сопровождалась ручной ассистенцией. Операции проходили в междиализный день.
Методика операции. Пациента укладывали на подогреваемый матрас, под все точки возможной компрессии подкладывали гелевые подушки. Пациента тщательно фиксировали в трех местах, что обеспечивало возможность вращения операционного стола во время операции. Вмешательство проводили под эндотрахеальным наркозом с установленным назогастральным зондом.
В положении больного на спине (при ИМТ <30 кг/м2) или на боку (при ИМТ >30 кг/м2) после обработки операционного поля первым этапом осуществляли верхнесрединную лапаротомию длиной 8 см и устанавливали порт для ручной ассистенции Dextrus (Ethicon Endo-Surgery, США). Далее под мануальным контролем устанавливали 10-мм порт для оптики по срединной линии на 4–5 см ниже лапаротомного разреза и по два рабочих порта 5 и 12 мм с каждой стороны на уровне оптического троакара по среднеключичной и переднеподмышечной линиям. Использовали лапароскоп 30°.
Диссекцию проводили с помощью ультразвукового скальпеля Thunderbeat (Olympus Gmbh, Германия) или Harmonic (Ethicon Endo-Surgery, США). Операцию начинали с мобилизации толстого кишечника. Далее последовательно освобождали нижний полюс почки и переднюю поверхность m. psoas. На этом этапе операции неоценима роль ручной ассистенции, которая позволяет тупым способом мобилизовать всю дорсальную поверхность почки вдоль поясничной мышцы до диафрагмы, мануально определить почечную ножку и аккуратно мобилизовать печень и селезенку, кроме того, без помощи руки практически невозможно манипулировать огромной почкой.
После этапа мобилизации почки осуществляли выделение почечной ножки и последовательное клипирование сосудов клипсами Hem-o-loсk (TeleflexInc, США) либо наложением сшивающего аппарата с сосудистой кассетой. Следует отметить, что почечная ножка в гигантских почках часто полностью закрыта множественными кистами, что вынуждает проводить их вскрытие и дренирование. Однако ни в одном случае это не привело к обострению воспалительного процесса даже у иммуноскомпрометированных пациентов. Далее выполняли мобилизацию почки от надпочечника и оставшихся сращений. Мочеточник клипировали и пересекали.
Почку подтягивали к разрезу короткой стороной, последовательно вскрывали кисты, содержимое которых эвакуировали в пакет для сбора жидкости. Уменьшенную посредством описанных манипуляций почку эвакуировали через имеющийся лапаротомный доступ.
Следующим этапом пациента поворачивали на противоположный бок, повторно устанавливали порт для руки и проводили аналогичную операцию на контралатеральной стороне. На заключительном этапе осуществляли тщательный гемостаз, так как гемотрансфузия несет повышенный риск образования анти-HLA-антител у реципиента.
В брюшную полость устанавливали дренажи Penrose с двух сторон через отверстия от 12-мм портов. Операционную рану послойно ушивали.
На следующие сутки после операции проводили гемодиализ в условиях реанимационного отделения с минимальным использованием антикоагулянтов. На 2-е послеоперационные сутки после ультразвукового контроля удаляли страховые дренажи, последующее лечение проводили в урологическом отделении. После выписки решением комиссии пациенты были включены в лист ожидания на трансплантацию трупной почки.
Результаты. Послеоперационной летальности после лапароскопической билатеральной нефрэктомии не было. Среднее время операции составило 225,1±40,37 (190–310) мин. Послеоперационные осложнения зафиксированы у 2 (33,2%) пациентов. У первого больного на 2-е сутки после операции развился геморрагический синдром на фоне гемодиализа, что потребовало проведения интенсивной терапии с использованием гемостатических средств, гемо- и плазмотрансфузии (осложнение класса II по Clavien–Dindo). Повторной операции не потребовалось. Следующим пациентам первые два сеанса гемодиализа после операции проводили с использованием более низкой дозы гепарина, и подобных осложнений не наблюдалось. У другого больного развился тромбоз артериовенозной фистулы, что потребовало тромбэктомии (осложнение класса IIIа по Clavien–Dindo). Койко-день в ОРИТ составил в среднем 1,67±0,81 (1–3) дня, общий койко-день – 8,83±2,13 (7–13). Ни в одном случае клинических проявлений надпочечниковой недостаточности отмечено не было.

С июня 2018 по сентябрь 2019 г. выполнено 65 трупных трансплантаций почки. Двоим (3,07%) пациентам пересадка почки была выполнена после лапароскопической билатеральной нефрэктомии по поводу поликистоза почек. Характеристики пар донор–реципиент представлены в табл. 1.
 Нахождение в листе ожидания для больных, перенесших трансплантацию трупной почки, составило 13 и 17 мес. соответственно. Характеристики проведенных вмешательств представлены в табл. 2.
Нахождение в листе ожидания для больных, перенесших трансплантацию трупной почки, составило 13 и 17 мес. соответственно. Характеристики проведенных вмешательств представлены в табл. 2.
Ни одного послеоперационного осложнения не было. Оба пациента живы.
Обсуждение. Аутосомно-доминантная поликистозная болезнь почек – наследственное заболевание, характеризующееся множественными кистами, разрушающими почечную паренхиму [10]. В зависимости от мутаций генов PKD (Polycystic Kidney Disease) вероятность развития ХПН в возрасте до 50 лет составляет 5–35%, к 60 годам – 15–70%, к 70 достигает 45–90% [11]. Трансплантация почки является «золотым» стандартом лечения больных ХПН [12]. Показана лучшая выживаемость трансплантата у пациентов с поликистозом, перенесших монолатеральную или билатеральную нефрэктомию в рамках подготовки к трансплантации почки [9]. В ряде работ продемонстрировано улучшение физической составляющей качества жизни пациентов после операции, что, вероятно, связано с уменьшением растяжения капсулы почки кистами. Тем не менее до настоящего времени не определено место билатеральной нефрэктомии у больных ХПН на фоне поликистоза почек и основными показаниями к билатеральной нефрэктомии являются боль, рецидивирующие инфекции и отсутствие места для донорской почки.
Лапароскопическая методика с применением ручной ассистенции позволяет выполнять билатеральную операцию за разумное время с минимальным количеством осложнений [13]. По нашим данным, лапароскопическая билатеральная нефрэктомия с ручной ассистенцией является безопасной процедурой для больных поликистозом почек в экспертных центрах лапароскопической хирургии и урологии. Удалить почку размером менее 20 см возможно без применения ручной ассистенции. Возможность ранней активизации пациентов служит важным фактором профилактики послеоперационных осложнений. Преимуществом лапароскопического метода является визуализация и прецизионная техника выделения надпочечников, что позволяет избегать их повреждения и развития надпочечниковой недостаточности, тем самым улучшая качество жизни пациентов. Необходимым условием проведения операции является тщательное наблюдение за артериовенозной фистулой, так как потеря постоянного сосудистого доступа для гемодиализа ассоциируется с увеличением длительности госпитализации. В процессе динамического наблюдения пациенты не предъявляли жалоб, связанных с перенесенным оперативным вмешательством.
Последующая трансплантация почки двоим больным не имела каких-либо технических особенностей, связанных с перенесенным лапароскопическим вмешательством. Послеоперационный период также протекал без каких-либо особенностей.
Наш первый опыт проведения лапароскопической билатеральной нефрэктомии при поликистозе почек оказался успешным. Важным аспектом внедрения данной технологии в широкую клиническую практику является работа мультидисциплинарной команды в составе нефролога, уролога с опытом выполнения лапароскопических операций на почке, трансплантолога, анестезиолога-реаниматолога.
Заключение. Лапароскопическая билатеральная нефрэктомия у больных с ХПН на фоне поликистоза почек выполнима, безопасна, характеризуется небольшим койко-днем, улучшает качество жизни пациентов и облегчает последующую трансплантацию почки.



