Введение. Эректильная дисфункция (ЭД) – это состояние, характеризующееся невозможностью достичь или удержать эрекцию, достаточную для совершения полового акта [1]. Согласно данным европейского многоцентрового популяционного исследования, включившего 3369 мужчин в возрасте 40–79 лет, распространенность ЭД варьируется от 6 до 64%, составляя в среднем 30% и увеличиваясь с возрастом [2]. Эти результаты согласуются с данными другого многонационального исследования, включившего 27 839 мужчин из 8 стран [3]. По данным Nguyen et al. [4], распространенность ЭД среди мужчин в возрасте 70 лет составляет 37%, в возрасте 30 лет – 11%, а в возрасте 20 лет – 8%. Эпидемиологическое исследование распространенности ЭД в Российской Федерации [5] показало, что 89,9% респондентов в возрасте от 20 до 75 лет имеют симптомы ЭД по опроснику МИЭФ-5. При этом средняя степень ЭД отмечена у 6,6% опрошенных, тяжелая – у 12%.
Нормальная сексуальная функция зависит от сложной и слаженной работы сосудистой, нервной и гуморальной системы. Один из факторов, приводящий к ЭД, – это ожирение, широко распространенное в мире [6]. Было показано, что вероятность развития половой дисфункции у мужчин с ожирением на 30% выше, чем у мужчин с нормальной массой тела [7].
Причины органической ЭД можно разделить на неэндокринные и эндокринные. Среди неэндокринных причин выделяют васкулогенные (нарушение артериального притока и аномалии венозного оттока) и нейрогенные. К эндокринным факторам, приводящим к ЭД, относят снижение уровня тестостерона в сыворотке крови [8].
В обзорной статье Кi Hak Moon et al. [9] указано, что к основным патофизиологическим механизмам развития ЭД у мужчин с ожирением относятся окислительный стресс, воспаление, резистентность к инсулину и лептину. Эти факторы приводят к нарушению расслабления кавернозных тел, снижению неадренергического нехоленергического нервно-опосредованного расслабления в кавернозных телах полового члена и к снижению эндотелиального синтеза оксида азота. Также отмечено, что при ожирении снижается уровень тестостерона, повышается уровень общего холестерина (ОХ), триглицеридов (ТГ), окисленных липопротеинов низкой плотности (ЛПНП), интерлейкина-18 и фактора некроза опухоли-α. В эксперименте на крысах показано, что ЭД, вызванная высококалорийной диетой, является результатом повреждения эндотелия [10]. Rui Li et al. в исследовании на лабораторных крысах показали, что при метаболическом синдроме с ЭД (для подтверждения проводился тест с апоморфином) достоверно снижается внутрикавернозное давление и концентрация циклического монофосфат гуанина в кавернозных телах [11].
В научной литературе имеется достаточно информации о патофизиологических механизмах развития ЭД, но практически отсутствует описание морфологических изменений в половом члене при состояниях, приводящих к половой дисфункции. В единичных публикациях, посвященных данной теме, говорится, что ожирение у крыс вызывает атрофию гладких мышц полового члена, эндотелиальную дисфункцию и накопление липидов в кавернозных телах [12]. При сахарном диабете 1-го типа у крыс через 9 нед. от начала эксперимента площадь поперечного сечения гладких мышц в кавернозных телах в процентах от общей площади кавернозных тел была ниже, чем в контрольной группе. Процентное изменение нейронального синтеза оксида азота в дорсальных нервах имеет тенденцию к снижению у крыс с диабетом по сравнению с контрольной группой [13]. В исследовании С. В. Боголюбова и А. В. Астаховой [14], выполненном на аутопсийном материале тканей полового члена, оценивались морфологические изменения кавернозной ткани у мужчин, умерших от ИБС и вследствие других причин. Согласно полученным данным, у мужчин, умерших от ИБС, достоверно чаще встречались сниженное кровенаполнение, кавернозный фиброз, очаговая дезорганизация кавернозной ткани в сочетании с липоматозом [14].
Цель нашего исследования: выявить морфологические изменения в кавернозной ткани полового члена при ожирении на примере биологической модели лабораторных крыс.

Материалы и методы. В условиях in vivo было смоделировано диетиндуцированное ожирение. Исследование проведено на 22 лабораторных половозрелых белых крысах массой 140–160 г. Животных содержали при температуре 18–20°С, влажности 55–65%, 12-часовом световом дне (с 6.00 до 18.00). В течение первой недели все животные находились в одинаковых условиях, получали стандартное питание и воду ad libitum. В дальнейшем животные были разделены на две группы: контрольную (n=10), которая получала стандартную диету в соответствии с нормами кормления лабораторных животных, и экспериментальную группу (n=12), в которой животные получали стандартную диету с добавлением растительного масла, семян подсолнечника, сладкого сгущенного молока (табл. 1). Через 12 нед. животных выводили из эксперимента путем передозировки наркоза. Всем крысам проводили: 1) расчет Ли индекса (индекс массы тела у крыс), по формуле ∛массы тела (г)×10/назоанальная длина (мм) [15]; 2) определение уровня глюкозы в крови глюкозооксидазным методом; 3) определение уровня общего холестерина и триглицеридов на одноканальном биохимическом анализаторе Stat-Fax-1904 с использованием реагентов фирмы Диакон; 4) забор полового члена с фиксацией в 10%-ном формалине, гистологические срезы толщиной 6–8 мкм окрашивали гематоксилином и эозином, а также изготавливали замороженные срезы с последующей окраской суданом-3 для выявления жировых клеток. При изучении гистологических препаратов определяли средний размер не менее 100 жировых клеток и оценивали среднее количество адипоцитов в 10 полях зрения (увеличение 400) в поперечных срезах полового члена.
Статистическую обработку данных проводили с использованием непараметрических методов статистики (SPSS Statistic 10). Сравнение групп выполняли с использованием критерия Манна–Уитни. Полученные результаты представлены в виде М±m, где М – среднее арифметическое, m – стандартная ошибка среднего. Различия считали статистически значимыми при p<0,05.
Результаты. В ходе эксперимента каждые 2 нед. проводили контрольное взвешивание всех животных с расчетом средней массы тела. Через 12 нед. средняя масса тела в контрольной группе составила 298±36 г, в экспериментальной – 416±50 г, т.е. разница средних масс тела в группах составила 118 г (39,6%; р<0,05).
В контрольной группе животных, получавших стандартную диету, Ли индекс составил 0,28± 0,01, в группе животных с высококалорийной диетой – 0,31±0,01 (р<0,05), что подтверждает развитие алиментарного ожирения в экспериментальной группе.
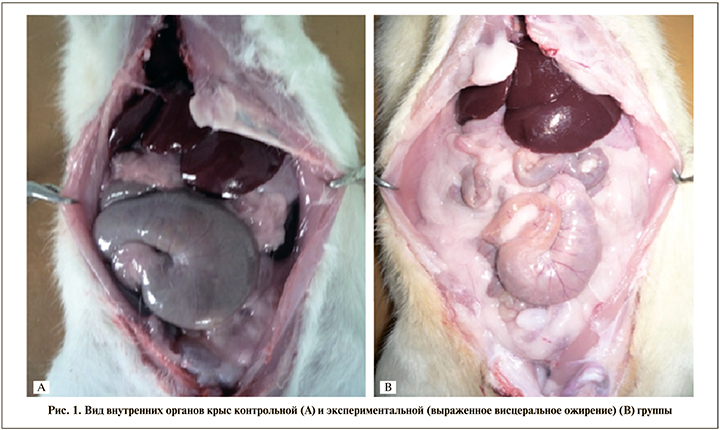
После выведения животных из эксперимента выполняли их секцию с визуальной оценкой висцерального ожирения и отложения жировой ткани в области репродуктивных органов (рис. 1).
По уровню глюкозы (6,7±0,6 и 6,8±0,8 ммоль/л соответственно) и общего холестерина (3,5±0,2 и 3,2±0,3 ммоль/л соответственно) контрольная и экспериментальная группы достоверно не различались. Однако уровень триглицеридов у животных экспериментальной группы был статистически значимо выше, чем в контрольной, и составил 1,6±0,1 и 1,24±0,05 ммоль/л соответственно; р=0,0077).
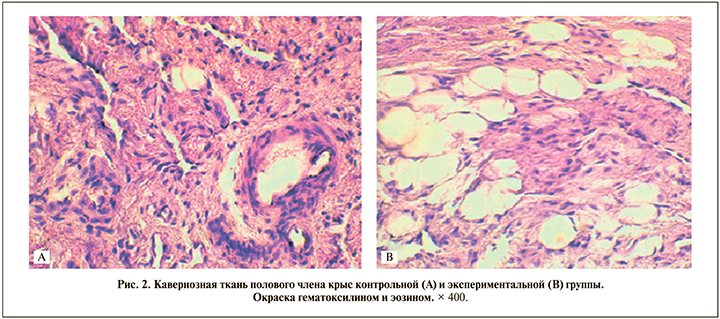
При окраске гистологических препаратов гематоксилином и эозином обнаружены разной величины вакуоли, образовавшиеся вследствие растворения жира спиртом и эфиром (при проводке материала) (рис. 2). Для подтверждения жировой дистрофии были изготовлены замороженные срезы с последующей селективной окраской суданом-3 (рис. 3), в результате которой жировые клетки окрашивались в ярко-оранжевый цвет. При морфометрической оценке препаратов установлено, что среднее число адипоцитов в поперечных срезах полового члена и их площадь были достоверно больше в группе крыс с алиментарным ожирением (табл. 2).
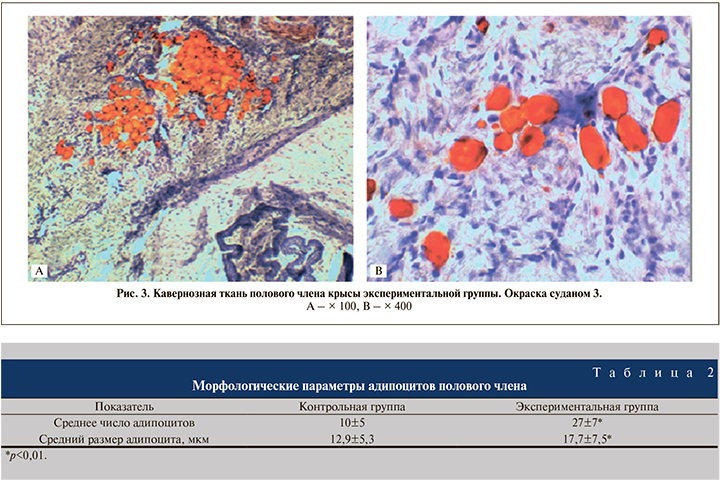
Обсуждение. В рамках проведенной работы нам удалось добиться развития алиментарного диетиндуцированного ожирения. Ожирение подобного типа в эксперименте получено и другими исследователями при использовании различных высококалорийных диет [11, 16].
Размер адипоцитов определяет метаболическую активность жировой ткани. Выделяют малые (диаметром до 50 мкм), большие (диаметром от 50 до 100 мкм), крупные (диаметром более 100 мкм) адипоциты [16]. Увеличение жировой ткани может происходить за счет двух процессов: гипертрофии (увеличение объема жировых клеток) и гиперплазии (увеличение количества жировых клеток) [17]. В нашем исследовании в половом члене крыс с ожирением наблюдалась как гипертрофия, так и гиперплазия жировых клеток по сравнению с контрольной группой.
Жировая ткань продуцирует провоспалительные цитокины (их уровень повышается при ожирении), которые обусловливают местную и системную резистентность к инсулину. Также по мере увеличения жировой массы в условиях чрезмерного питания может развиваться местная гипоксия [18]. Эти факторы могут быть одной из причин развития половой дисфункции.
Висцеральное ожирение, в том числе у крыс [19], ассоциировано со снижением уровня общего тестостерона в крови и повышением содержания эстрадиола, что может быть еще одной причиной развития ЭД при ожирении.
Возможным фактором, способствующему развитию ЭД, может быть дислипидемия (гиперхолестеринемия и гипертриглицеридемия) [11], которая приводит к нарушению микроциркуляции и повреждению ткани за счет липотоксичности.
Нами было отмечено, что скопления жировой ткани в половом члене крыс при алиментарном ожирении чаще располагались под белочной оболочкой. Эта анатомическая особенность может быть одной из причин нарушения венооклюзионного механизма эрекции.
Заключение. При алиментарном ожирении у крыс отложение жировой ткани наблюдается не только в висцеральной и паратестикулярной областях, но и в кавернозной ткани полового члена, что может негативно влиять на эректильную функцию.



