Введение. Рак мочевого пузыря (РМП) является одной из наиболее распространенных опухолей мочевыводящих путей. По данным F. Bray et al. [1], в 2018 г. у 549 тыс. пациентов был диагностирован РМП, а мировая смертность от данного заболевания составляла около 199 тыс. пациентов. Удельный вес злокачественных опухолей мочеполовой системы у мужчин составляет 25,1% среди всех онкологических заболеваний в России. В мировой структуре онкологической заболеваемости РМП занимает 7-е место среди мужчин и 11-е среди лиц обоих полов.
В России злокачественные образования мочевого пузыря в структуре общей заболеваемости (оба пола) занимают 13-е (2,8%) место по частоте, а среди мужского населения – 9-е (4,7%) место [2, 3]. РМП может проявляться в виде неагрессивных, неинвазивных опухолей, имеющих тенденцию к рецидивированию, и агрессивных, инвазивных опухолей, характеризующихся высокой смертностью [4].
Радикальная цистэктомия является методом выбора пациентов с распространенными формами РМП [5–7]. После проведения радикальной цистэктомии необходим выбор типа деривации мочи и формирования резервуара. Деривация мочи возможна на кожу и через уретру. К первому типу относят инконтинентное (чрескожная пункционная нефростомия, уретерокутанеостомия, операция Bricker) или континентное (гетеротопические резервуары) отведение мочи, ко второму – ортотопическое (формирование резервуаров с помощью желудочно-кишечного тракта, анастомозирующего с уретрой, например операция Studer) [8, 9].
Общее состояние пациента и сопутствующие заболевания оказывают влияние на результат лечения, их необходимо учитывать при выборе типа отведения мочи [10].
Ортотопическая кишечная пластика мочевого пузыря обеспечивает наилучшее качество жизни пациента после операции и является методом выбора в отсутствие противопоказаний [11, 12].
В крупном исследовании S. Yang Linda и соавт. [13] при сравнении физического здоровья пациентов, которым были сформированы континентные и инконтинентные мочевые резервуары, не отмечено принципиальной разницы. Однако исследователи отмечают лучшие показатели психоэмоционального здоровья в первой группе.
Критерием реабилитации больных после энтероцистопластики является нормализация функции почек и уродинамики верхних мочевыводящих путей. Осложнения цистэктомии можно разделить на общехирургические и связанные с проблемой деривации мочи. Профилактика интра- и послеоперационных осложнений проводится в первую очередь путем совершенствования техники оперативного вмешательства, выбора оптимальных методов трансплантации мочеточников, формирования пузырно-уретрального сегмента.
По данным исследования О. Н. Васильева и соавт. (2019), включившего анализ онкологических результатов лечения 458 пациентов, ранние послеоперационные осложнения, связанные с уродеривацией (<30 сут. после операции), выявлены у 68 больных, из них осложнение в виде острого пиелонефрита выявлено у 30 (44,1 %) пациентов. Поздние послеоперационные осложнения (31–90-е сутки после операции) выявлены у 33 (48,5%) пациентов, острый пиелонефрит наблюдался у 2 (2,9 %) пациентов [14].
Помимо хирургических методов в профилактике осложнений и реабилитации пациентов важную роль играет адекватная и безопасная терапия в послеоперационном периоде.
К сожалению, даже длительное применение антибактериальных препаратов не позволяет исключать повторные атаки мочевой инфекции. По-прежнему остается много нерешенных проблем в вопросах метафилактики и патогенетической профилактики.
В последнее время отмечается повышение интереса к применению растительных препаратов в лечении урологических заболеваний. Эффективность применения лекарственных растений доказана не только эмпирически, но и с помощью научно обоснованных методов. Полученные в ходе многочисленных исследований результаты свидетельствуют о высокой эффективности растительных препаратов, которые часто не уступают синтетическим химическим веществам. К фитопрепаратам больше не относятся как к препаратам второй линии. Безопасность и эффективность фитопрепаратов обеспечиваются значительно выросшей в последнее время технологичностью производства.
Одним из комплексов, применяемым в урологии, является НефроБест-Н. Он содержит экстракты листьев брусники, травы золототысячника, травы розмарина, корней любистока. НефроБест-Н оказывает мочегонное, спазмолитическое, противовоспалительное, противомикробное действия. Проведенные клинические исследования подтверждают благоприятный профиль безопасности и эффективности добавок линейки НефроБест, как собственно комплекса НефроБест с его доказанными мочегонным, спазмолитическим, противовоспалительным и антисептическим действиями, так и относительно нового продукта НефроБест-Н, который дополнительно обладает более выраженным мочегонным эффектом благодаря высокому содержанию экстракта листьев брусники.
Цели исследования: оценить эффективность и безопасность БАД НефроБест-Н у пациентов, перенесших лапароскопическую радикальную цистэктомию с энтероцистопластикой.
Материалы и методы. Проведено рандомизированное многоцентровое исследование в параллельных группах, включившее 60 пациентов с инвазивным РМП, проходивших лечение в ФГБУ ГНЦ ФМБЦ им А. И. Бурназяна и в Кузбасской клинической больнице скорой медицинской помощи им. М. А. Подгорбунского в 2021–2022 гг. Исследование состояло из периода скрининга продолжительностью до 4 дней (визит 1) и периода оценки эффективности терапии, продолжавшегося 90±2 дня, включившего 3 визита: 14-й день – визит 2, 30±2 дня – визит 3 и 90±2 дня – визит 4.
Лабораторное обследование включило биохимический анализ крови (мочевина, креатинин, K, Na, С-реактивный белок [СРБ]), общий анализ мочи (наличие слизи, количество лейкоцитов), бактериологическое исследование мочи с целью выявления наличия и вида инфекционного агента и определения бактериального числа (количество патогенов в 1 мл мочи), физикальный осмотр, ультразвуковое исследование (УЗИ) почек с определением объема остаточной мочи.
Выраженность бактериурии оценивали в баллах. Отсутствие бактерий по данным посева мочи оценивали как 0 баллов, 103 и менее бактерий – 1 балл, 104–105 – 2 балла, 106 и более – 3 балла.
Количество слизи в общем анализе мочи оценивали в p/HPF (per high power field) – усредненный количественный результат в поле зрения. Результат 0–60 p/HPF оценивался как 0 баллов, 61–100 – как 1 балл, 101–150 – как 2 балла, более 150 – как 3 балла. Также проводили оценку качества жизни по шкале QoL в баллах от 0 до 6, где 0 – прекрасно, 6 – очень плохо.
Пациенты, прошедшие скрининг во время визита 1 и удовлетворившие критериям включения, были рандомизированы в 2 группы. В исследование были включены пациенты обоих полов в возрасте от 45 до 65 лет, средний возраст – 57 лет, проходивших лечение в 2021–2022 гг., перенесших радикальную лапароскопическую цистэктомию с энтероцистопластикой по Studer. Критерии невключения: развитие у больных послеоперационных осложнений в виде перитонита, непроходимости кишечника, применение больным антибактериальной терапии, назначенной в связи с сопутствовавшими заболеваниями либо развитием острого пиелонефрита; отягощенный аллергологический анамнез; индивидуальная непереносимость компонентов, входящих в состав НефроБест-Н; развитие аллергических реакций во время приема НефроБест-Н; любые клинически значимые состояния, которые могли влиять на результаты исследования.
Полный курс терапии и 4 визита прошли 60 пациентов, по 30 пациентов основной и контрольной групп соответственно.
В основную группу включены пациенты, которые получали НефроБест-Н по 1 капсуле 2 раза в день на протяжении 90 дней. Прием комплекса начинался на 7–9-й день после оперативного лечения. В контрольную группу вошли пациенты, не получавшие фитотерапии. Во время проведения исследования пациенты обеих групп по показаниям получали терапию, обусловленную сопутствовавшими заболеваниями. Прием антибактериальных препаратов пациентами обеих групп не проводился.
Контрольные осмотры пациентов с оценкой соматического статуса, лабораторным контролем, УЗИ почек, неоциста с определением объема остаточной мочи проводили во время всех четырех визитов исследования.
Оценку безопасности проводили на основании жалоб, данных физикального осмотра, лабораторных данных и результатов УЗИ.
Перед началом применения НефроБест-Н пациенты подписывали добровольное информированное согласие гражданина на применение терапии.
Статистический анализ. Результаты исследования были подвергнуты статистическому анализу с использованием программы IBM SPSS Statistics v.26. Определение значимости статистических различий проводилось при помощи t-критерия Стьюдента. Накопление, корректировку, си-стематизацию исходной информации осуществляли в электронных таблицах Microsoft Excel.
Результаты исследования. В результате исследования установлено, что НефроБест-Н при использовании по схеме 1 капсула 2 раза в день на протяжении 90 дней обладает клинической эффективностью и оказывает положительное влияние на изменения в общем анализе мочи, маркеры острого воспаления (СРБ), на индикаторы функции почек (креатинин, мочевина).
При сравнительном анализе результатов исследований основной и контрольной групп получены следующие данные.
Уровень СРБ в основной и контрольной группах в начале исследования составил 52,5±21,1 и 50,1±19,4 мг/л соответственно (рис. 1). В ходе последующего наблюдения отмечено неуклонное снижение данного показателя, более выраженное в основной группе.

Среднее значение уровня мочевины (рис. 2) в исследуемых группах в начале исследования находилось на уровне 5,8±1,6 ммоль/л в основной группе и 5,9±1,3 ммоль/л в контрольной. У пациентов основной группы констатировали постепенное снижение показателя, достигавшего 4,1 ммоль/л к окончанию исследования. В контрольной группе отмечался рост содержания мочевины до 6,6 ммоль/л к визиту 2, в дальнейшем отмечено незначительное снижение с сохранением на уровне примерно 6 ммоль/л в течение всего периода наблюдения.
В начале исследования уровень креатинина в группах был одинаковым, составив 77,1±8,6 мкмоль/л в основной группе и 77,2±7,1 мкмоль/л в контрольной (рис. 3). На 14-й день отмечалось снижение показателя до 72,8 мкмоль/л в основной группе и повышение его в контрольной группе до 79,9 мкмоль/л. В последующем уровень креатинина равномерно снижался в обеих группах: на 12% в основной группе, на 3,9% в контрольной.

Показатели содержания Na и K находились в пределах референсных значений на всех визитах.
К концу первого месяца исследования отмечалось изменение субъективной оценки качества жизни от плохого к неудовлетворительному. К концу 3-го месяца в основной группе качество жизни характеризовалось как хорошее и удовлетворительное, в контрольной – как удовлетворительное. В целом в основной группе показатель (балл) качества жизни изменился на 58,5%, в контрольной – на 46% (рис. 4).
На протяжении всего исследования у пациентов конт-рольной группы сохранялось большое количество слизи в анализе (2,9±0,4 балла в начале исследования, 2,7 через 3 мес.) (рис. 5). В основной группе отмечалось значительное уменьшение количества слизи в конце первого месяца приема НефроБест-Н, по прошествии 3 мес. приема количество слизи в моче соответствовало 1 баллу.
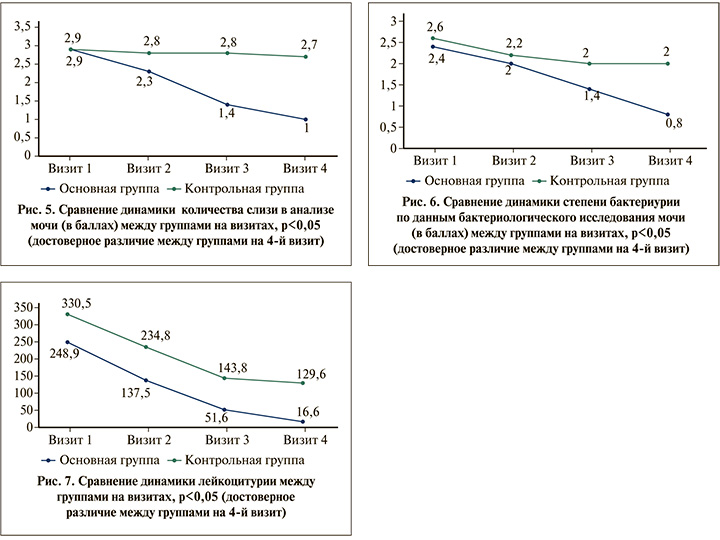
О динамике степени бактериурии позволяет судить график (рис. 6). В начале исследования степень бактериурии в обеих группах была на одном уровне (2,4 балла в основной группе, 2,6 баллов в контрольной). Отчетливая положительная динамика данного показателя отмечена через 3 мес., когда в основной группе он уменьшился до 0,8 балла, в контрольной – до 2.
В ходе исследования также было выявлено изменение степени лейкоцитурии у пациентов обеих групп (рис. 7). При скрининге показатель составил 248,9±35 кл/мкл в основной группе и 330,5±47 кл/мкл в контрольной. К визиту 4 в основной группе показатель снизился до 16,6 кл/мкл, в контрольной – лишь до 129,6 кл/мкл.
Обсуждение. В ходе наблюдения были достигнуты цели исследования: проведена оценка эффективности комплекса НефроБест-Н. Было доказано, что прием НефроБест-Н приводит к более быстрому улучшению показателей общего анализа мочи, бактериологического исследования мочи. Использование данного комплекса в клинической практике возможно для профилактики обострения мочевой инфекции. Важно, что применение НефроБест-Н курсом продолжительностью 90 дней обеспечивает положительный терапевтический эффект. При этом отсутствуют побочные и нежелательные эффекты, развивающиеся при длительном применении антибактериальной терапии.
Так, отмечена статистически значимая разница в показателях степени лейкоцитурии, уменьшении количества слизи в общем анализе мочи, степени бактериурии по данным микробиологического исследования мочи, улучшении качества жизни. Положительным аспектом применения НефроБест-Н является снижение уровня показателей азотистого обмена. Выявлено снижение значение СРБ – информативного показателя текущего воспалительного процесса в организме.
Полученный положительный терапевтический эффект, хорошая переносимость терапии, подтвержденные в ходе настоящего исследования, свидетельствует об эффективности и безопасности НефроБест-Н.
Заключение. По результатам рандомизированного многоцентрового клинического исследования эффективности и безопасности комплекса Нефробест-Н у больных, перенесших лапароскопическую радикальную цистэктомию с энтероцистопластикой, был сделан вывод о целесообразности применения НефроБест-Н в послеоперационном периоде. НефроБест-Н имеет благоприятный профиль эффективности и безопасности. Согласно нашему опыту, прием НефроБест-Н способствует снижению степени лейкоцитурии и бактериурии, уменьшает количество слизи в моче, что способствует профилактике активации мочевой инфекции и улучшает качество жизни пациентов, перенесших радикальную лапароскопическую цистэктомию с энтероцистопластикой.



