Введение. Увеличение продолжительности жизни населения привело к тому, что возросла доля лиц старческого и пожилого возраста, в связи с чем изменились структура и уровень заболеваемости [1]. Здоровье и качество жизни мужчин старше 50 лет, согласно современной геронтологической концепции, находятся в прямой зависимости от неонкологических заболеваний: гиперплазии предстательной железы, сердечно-сосудистых заболеваний, эректильной дисфункции. Наиболее широко распространенным доброкачественным урологическим заболеванием у мужчин старшего возраста является гиперплазия предстательной железы [2]. Доброкачественная гиперплазия предстательной железы (ДГПЖ), которая встречается более чем у 40% мужчин старше 60 лет, по-прежнему остается ведущей причиной развития симптомов нижних мочевыводящих путей (СНМП) [3]. Хирургическое лечение в отношении гиперплазии простаты – один из основных методов лечения, несмотря на применение других малоинвазивных способов лечения и широкое применение медикаментозной терапии. Несмотря на широкое распространение и эффективность лекарственной терапии СНМП, обусловленных ДГПЖ, в отношении пациентов, продолжающих испытывать расстройства мочеиспускания, приходится прибегать к хирургическому лечению не только с целью улучшения качества жизни, но и для предотвращения или ликвидации таких осложнений, как наличие остаточной мочи, конкрементов мочевого пузыря и т.д.
Благодаря своей безопасности и эффективности, в том числе и долгосрочным результатам, в течение многих лет трансуретральная резекция гиперплазии простаты (ТУРП) служит общепринятым «золотым» стандартом хирургического лечения ДГПЖ [4], однако она не лишена таких осложнений, как кровотечение, гипонатриемия и ТУР-синдром [5–9]. Продолжительное время резекции способствует возникновению электролитных расстройств, что ограничивает возможность проведения ТУРП пациентам при объеме простаты более 80 см3. Это стало поводом для поиска альтернативных методов эндоскопического оперативного лечения пациентов, одним из которых, согласно рекомендациям Европейской ассоциации урологов (ЕАУ), является гольмиевая лазерная энуклеация гиперплазии предстательной железы (HoLEP) [10]. HoLEP, впервые описанная в 1996 г., в последние годы приобрела широкую популярность [11, 12]. Результаты множества проведенных исследований, среди которых представлены результаты обследования пациентов через 10 лет после операции, подтверждают высокую эффективность гольмиевой энуклеации в ликвидации инфравезикальной обструкции, обусловленной гиперплазией простаты, в том числе и при гиперплазии больших размеров [13, 14]. HoLEP имеет ряд преимуществ по отношению к ТУРП, особенно для пациентов с большим объемом предстательной железы [15, 16]. Cогласно ЕАУ, при объеме простаты больше 80 см3 HoLEP является операцией выбора наряду с открытой аденомэктомией и биполярной энуклеацией [17, 18]. Ряд авторов HoLEP называют новым «золотым» стандартом хирургического лечения гиперплазии простаты [2]. Несмотря на доказанную эффективность HoLEP в лечении больных ДГПЖ, ее широкое применение показало наличие как интра-, так и послеоперационных осложнений [19, 20].
Цель работы – улучшение результатов хирургического лечения больных ДГПЖ.
Материалы и методы. Проведено проспективное исследование, в которое вошли 310 пациентов, находившихся на обследовании и лечении в клинике урологии Первого МГМУ им. И. М. Сеченова с января 2013 по октябрь 2015 г., которым выполнена HoLEP по поводу ДГПЖ. Операция выполнялась по технике Gilling. Основной рабочий режим – 2,0 Дж и 50 Гц и соответственная мощность – 100 W. Критерии включения: наличие СНМП (Qmax<15 мл/с, Qср<10 мл/с, наличие остаточной мочи, балл по IPSS>5, QoL>2), отсутствие активного воспалительного процесса со стороны мочеполовой системы.
Возраст больных колебался от 50 до 89 лет, средний возраст составил 68,6±6,8 года. Наибольшее количество пациентов было в возрасте от 60 до 65 лет (18%), от 65 до 70 (27%) и от 70 до 75 лет (25%). У 272 (87,7%) пациентов дренирования мочевого пузыря не осуществлялось, у 15 (4,8%) в связи с острой задержкой мочи был установлен уретральный катетер, у 23 (7,4%) – цистостомический дренаж. Средний балл по IPSS составил 22,4±4,2. Все пациенты отвечали на вопрос о качестве жизни при мочеиспускании. Средний балл по шкале QоL составил 4,3±1,2. На рис. 1 представлено распределение пациентов в зависимости от возраста и объема предстательной железы.
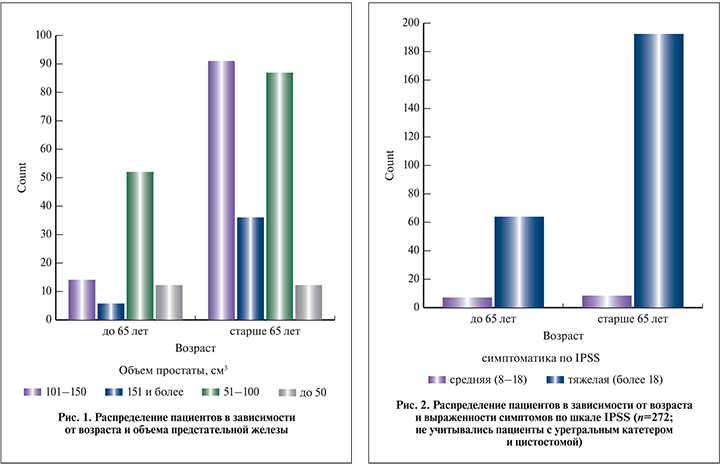
В группе до 65 лет преобладали пациенты с объемом простаты от 51 до 100 см3, в группе старше 65 лет – от 101 до 150 см3. В целом с возрастом статистически значимо увеличивается количество пациентов с большими объемами простаты (р<0,001).
Как видно на рис. 2, в обеих группах преобладали пациенты с выраженной симптоматикой по шкале IPSS (р=0,112). Максимальная скорость мочеиспускания у пациентов до 65 лет составила 9±7 мл/с, у пациентов старше 65 лет – 7±5 мл/с. С возрастом отмечено снижение максимальной скорости мочеиспускания (р=0,023). Контрольное обследование после HoLEP проведено через 1, 3 и 6 мес.
Статистический анализ проведен с помощью программы SPSS Ver. 14. Данные представлены в виде M±m, где М – среднее арифметическое, m – статистическая погрешность среднего арифметического. Достоверность различий средних определялась при помощи дисперсного анализа. При значении p<0,05 различия считали статистически значимыми.
Результаты и обсуждение. Чаще всего (n=45) на энуклеацию уходило от 60 до 80 мин (рис. 3), средняя продолжительность энуклеации составила 76±27 мин.

С наибольшей частотой время морцелляции варьировалось от 15 до 20 мин (n=43; рис. 4). В среднем на морцелляцию уходило 19,3±7 мин. Средняя масса «сухого» остатка оказалась равной 70,4±19,5 г. Весь послеоперационный материал был отправлен на гистологическое исследование. До операции сумма баллов по шкале IPSS составляла от 10 до 33, после операции – от 0 до 7 (р<0,0001).
Качество жизни, связанное с СНМП, до операции соответствовало 2–6, после операции – 0–4 баллам (р<0,0001). Максимальная скорость мочеиспускания до операции составила 9±4, после операции – 20±10 мл/с (р<0,0001), средняя скорость мочеиспускания – 5±2 и 10±4 мл/с соответственно (р<0,0001), объем остаточной мочи – 110±50 и 25±10 мл (р<0,0001), объем предстательной железы – 125±52 и 25±7 см3 (р<0,0001).
Все возникшие осложнения были разделены по тяжести согласно шкале Клавьена (см. таблицу).

Все осложнения, возникшие в ходе нашего исследования, были разделены на интраоперационные, ранние и поздние послеоперационные.
Среди интраоперационных осложнений выраженная геморрагия при энуклеации выявлена у 16 (5,2%) прооперированных, повреждение стенки мочевого пузыря – у 17 (5,5%), повреждение устьев мочеточников – у 2 (0,6%). В нашем исследовании было 17 наблюдений повреждения стенки мочевого пузыря (Clavien IIIB) и 2 повреждения устьев мочеточников (Clavien IIIB) во время морцелляции, что в свою очередь было связано с плохой видимостью. Необходимо обеспечивать максимально адекватную видимость для этапа морцелляции, что позволит избежать травматизации стенки мочевого пузыря, в случае технических трудностей – не исключать разделения операции на два этапа с последующим выполнением морцелляции. Благодаря соблюдению данных условиях в последующем удалось избежать данного осложнения. У 16 пациентов, у которых была отмечена выраженная геморрагия на этапе энуклеации (Clavien IIIB), в секрете простаты наблюдались лейкоциты сплошь в поле зрения (при стерильном бактериологическом посеве). Всем пациентам в качестве премедикации за 30 мин до операции проведена антибактериальная терапия.
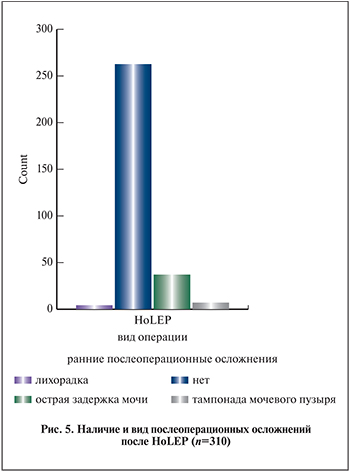 У 263 (84,6%) пациентов в раннем послеоперационным периоде осложнений не возникло. В 4 (1,3%) наблюдениях зафиксирована лихорадка, в 7 (2,3%) – тампонада мочевого пузыря, потребовавшая цистоскопии и эвакуации сгустков крови (рис. 5).
У 263 (84,6%) пациентов в раннем послеоперационным периоде осложнений не возникло. В 4 (1,3%) наблюдениях зафиксирована лихорадка, в 7 (2,3%) – тампонада мочевого пузыря, потребовавшая цистоскопии и эвакуации сгустков крови (рис. 5).
В нашем исследовании выявлено 7 случаев тампонады мочевого пузыря (Clavien IIIА), 4 из которых связаны с самостоятельным отхождением уретрального катетера на 1–2-е сутки после HoLEP. Последнее, вероятнее всего, связано с дефектом баллончика уретрального катетера. Было выявлено 10 наблюдений острой задержки мочи (Clavien IIIА) на фоне резидуальной ткани аденомы. Использование газовой среды на завершающем этапе морцелляции после выполнения HoLEP можно использовать в качестве диагностической процедуры, позволяющей четко определить наличие и локализацию недоморцеллированной аденоматозной ткани с целью окончательного ее удаления.
В отдаленном периоде у 39 (12,6%) прооперированных отмечено недержание мочи (Clavien IIIА), у 9 (2,9%) – стриктура уретры (Clavien IIIВ), в дальнейшем потребовавшая оперативного лечения. Продолжительность недержания мочи не превышала 1 мес. На фоне проводимой терапии блокаторами м-холинорецепторов и с помощью аппаратных комплексов биологической обратной связи мы успешно справлялись с данным видом осложнения после HoLEP.
Обсуждение. Многие исследования показали, что частота осложнений после HoLEP коррелируют с опытом хирурга. Во время выполнения HoLEP создается хороший гемостаз даже у пациентов, получающих антикоагулянтную терапию. Общий процент переливания крови после HoLEP находится в диапазоне от 0 до 4%. Тем не менее, несмотря на отличный гемостаз при выполнении HoLEP, также может возникать обильное кровотечение, связанное с определенными факторами риска. Большая площадь поверхности капсулы предстательной железы вместе с дополнительной плотностью сосудов, воспаление по данным секрета простаты, безусловно, могут повышать риск кровотечения, несмотря на хороший гемостаз при HoLEP. Многие авторы считают, что HoLEP является столь же эффективным методом лечения больных ДГПЖ, как ТУРП, но с гораздо меньшей продолжительностью катетеризации мочевого пузыря. Тем не менее после удаления уретрального катетера врачи могут сталкиваться с острой задержкой мочи, в результате чего необходимо повторно дренировать мочевой пузырь. Во избежание травмы мочевого пузыря во время морцелляции необходимо, чтобы мочевой пузырь был расправлен ирригационным раствором. Таким образом, чрезмерное перерастяжение мочевого пузыря может приводить к его миогенной травме, которая может вызывать отрую задержку мочи после удаления уретрального катетера. Наличие плотных узелков в энуклеированной аденоматозной ткани. Вероятнее всего, жесткие узелки состоят из плотной волокнистой стромы, что в свою очередь может приводить к увеличению времени морцелляции.
Montorsi F. и соавт. отмечают, что в раннем послеоперационном периоде НМ встречается у 38,6% пациентов после ТУРП и 44% пациентов после HoLEP через 1 мес. после операции. НМ после HoLEP, как правило, носит временный характер [21].
Выводы. Гольмиевая энуклеация гиперплазии простаты –эффективная и безопасная методика оперативного лечения больных ДГПЖ с минимальным процентом осложнений, выполнимая практически при любых размерах аденомы.



