Роль медиаторов в формировании гиперчувствительности и боли мочевого пузыря. Эффекты ботулотоксина А
Развитие гиперчувствительности мочевого пузыря может быть опосредовано изменениями в уротелии. Эти последние происходят под влиянием многочисленных биологически активных веществ и затрагивают не только переходный эпителий, но и более глубокие слои мочевого пузыря, что в конечном итоге обусловливает появление боли. Для того чтобы представить патофизиологию расстройств мочеиспускания и боли, в данном разделе строение мочевого пузыря рассмотрено послойно.
Характеристика функциональных слоев мочевого пузыря
Уротелий. Долгое время считалось, что переходный эпителий мочевого пузыря – это защитный биологический барьер, однако результаты исследований последних лет показывают, что он обладает значимыми сенсорными свойствами, что позволяет ему отвечать на раздражители и «давать команды» интрамуральным нервным волокнам [1, 2]. Эти свойства определяются способностью уротелия экспрессировать рецепторы разных классов. Среди них: никотиновые, мускариновые, адренергические, брадикининовые и некоторые семейства TRP-рецепторов (Transient Receptor Potential) [3]. Каждый из этих рецепторов связывается со своим медиатором (АТФ, ацетилхолин [Aсh], оксид азота [NO] и др.), высвобождаемым афферентными нервами в стенке мочевого пузыря. При этом каждый медиатор выполняет строго отведенную роль, сбои в этой отлаженной системе запускают механизмы, ведущие к различным патологическим состояниям. Среди них спонтанные сокращения детрузора, повышение чувствительности мочевого пузыря, хроническое воспаление с формированием синдрома болезненного мочевого пузыря (СБМП). S. Buckner et al. [4] сравнили величины спонтанных сокращений в полосках ткани мочевого пузыря свиньи с удаленным и сохраненным уротелием. Оказалось, что спонтанная фазовая активность была значимо ниже в интактном фрагменте мочевого пузыря.
Определив уротелий как структуру, обладающую сенсорными функциями, необходимо более подробно описать рецепторы и медиаторы, обеспечивающие эти функции. Согласно данным литературы, лидерами по плотности расположения в уротелии являются мускариновые (м2, м3) и никотиновые (nACh) рецепторы, а ацетилхолин в мочевом пузыре вырабатывается в ответ на любые химические или механические раздражители [5–7]. A. Kanai et al. применили агонист мускариновых рецепторов на полоске ткани мочевого пузыря, что индуцировало потенциал действия на границе уротелия и субуротелиального слоя, который затем распространился на детрузор [8]. Эти данные указывают на то, что ацетилхолин является центральным медиатором, отвечающим за нервно-уротелиальные механизмы передачи сигнала в мочевом пузыре. Однако, согласно вновь полученным сведениям, значимая роль в модуляции и обеспечении нормального функционирования нижних мочевыводящих путей (НМП) принадлежит и другим биологически активным веществам. Так, помимо ацетилхолиновых рецепторов внимания заслуживает еще один класс чувствительных окончаний – рецепторы к АТФ, а именно P2X2 и P2X3. Доказано, что АТФ выделяется уротелием не только в ответ на растяжение ткани, но еще и при воздействии агонистов мускариновых, брадикининовых и TRPV-1 (Transient Receptor Potential Vanilloid-1)-рецепторов [9]. Особый интерес для клинической практики представляют данные об эффективности антагониста P2X3-рецепторов в снижении проявлений СБМП [10]. Центральная роль в этом механизме принадлежит NO-синтазе уротелия.
J. Gillespie et al. [11] установили, что интерстициальные клетки мочевого пузыря свиньи отвечают на повышение содержания NO увеличением уровня вторичного посредника цГМФ. Этот вторичный посредник распространяет в клетке информацию о присоединении к рецептору лиганда, что обеспечивает большинство процессов жизнедеятельности клетки. В свою очередь группа исследователей во главе с N. Aizawa [12] применила L-аргинин (субстрат NO) на крысах и показала его значимую роль в снижении активности A-δ и С-волокон, отвечающих за болевую чувствительность и сенсорные свойства. Механизм действия NO, как уже было сказано, заключается в увеличении уровня цГМФ, который регулируется фосфодиэстеразами. Таким образом, ингибиторы фосфодиэстразы 5-го типа (ФДЭ-5) могут пролонгировать действие NO, подавляя синтез цГМФ, тем самым стабилизируя сверхчувствительный и воспаленный мочевой пузырь. Данное предположение нашло подтверждение в работе [13], где в качестве ингибитора ФДЭ-5 был использован тадалафил.
Исходя из описанных механизмов, становится понятно, что именно в уротелии запускается первичный ответ на любой физический или химический раздражитель [8]. По этой причине одной из рекомендаций при воспалительных процессах в мочевом пузыре, а также при его гиперсенсорности и гиперактивности служит ограничение употребления кофеина, специй, соли, алкоголя, никотина и других веществ, меняющих качественный состав мочи. Помимо этого раздражающими факторами при поврежденном уротелии могут быть и увеличение объема мочи в мочевом пузыре (в фазу наполнения), и даже сама боль (формирование «порочного круга»). При нарушении целостности уротелия посредством любого из приведенных факторов помимо повышения синтеза уже описанных медиаторов активируются специализированные ионные каналы, например TRPA (Transient Receptor Potential Ankyrin). Доказано, что это семейство рецепторов отвечает за формирование болевых ощущений в мочевом пузыре, которые транслируются в ЦНС по немиелинизированным С-волокнам [1]. Как правило, у пациентов, длительно страдающих СБМП, повышается чувствительность болевых рецепторов. Импульсы практически постоянно достигают ЦНС. Даже после прекращения воздействия раздражителя по С-волокнам продолжается проведение импульса, который доставляет ложные сигналы о присутствии боли в головной мозг. Так формируется центральная сенсибилизация. Этим объясняется сложность и низкая эффективность лечения пациентов с длительно существующим СБМП: необходимость многоступенчатых схем лечения (с обязательным введением нейротропных препаратов) и низкая вероятность полной ликвидации боли. При развитии центральной сенсибилизации дополнительно подключаются психосоматические механизмы. Часто пациенты отмечают появление невротических состояний, на фоне которых проявляются новые или обостряются имеющиеся хронические заболевания.
Еще одним важным звеном формирования болевых ощущений в мочевом пузыре и развития гиперактивности является синтез специфических биологически активных веществ – сенсорных нейропептидов. Речь идет в первую очередь о веществе P (ВP, substance P – SP) и кальцитонин-ген-связанном пептиде (КГСП, Сalcitonin Gene Related Product – CGRP). Эти структуры, объединенные в понятие «тахикинины», выделяются в большом количестве афферентными волокнами [14]. Вещество P и кальцитонин-ген-связанный пептид стимулируют высвобождение фактора роста нервов (ФРН, Neura l Growth Factor – NGF) [15] и экспрессию рецепторов TRPV1, P2X3 [16]. В свою очередь активация рецепторов TRPV1 способствует выбросу вещества P и кальцитонин-ген-связанного пептида из афферентных волокон (рис. 1). Участие тахикининов в регуляции мочеиспускания и болевой чувствительности мочевого пузыря подтверждено экспериментально на лабораторных животных [17]. Г. Г. Кривобородов и соавт. [18] оценили значение ФРН в моче пациентов с идиопатической гиперактивностью детрузора и без нее. Авторы установили, что количественный показатель ФРН в моче пациентов с гиперактивностью детрузора превосходил его количество в отсутствие заболевания. Эти данные дают основание потенциально рассматривать тахикинины как цель для фармакологического воздействия на мочевой пузырь.

Помимо сенсорных нейропептидов еще одной привлекательной целью для лекарственного воздействия уже на протяжении длительного времени являются ионные каналы. Однако главной проблемой в этом вопросе было и остается обеспечение селективного воздействия на НМП. Подробно этот вопрос осветили A. F. Brading et al. в своей обзорной статье [19]. На данный момент наибольший потенциал признается за TRPV4-ионными каналами в мочевом пузыре, располагающимися на мембранах клеток базального слоя [20]. Применение антагониста этих рецепторов (каналов) на лабораторных животных значимо увеличивало интервал между мочеиспусканиями, а также емкость мочевого пузыря, снижая выброс уротелиального АТФ из афферентных волокон [21, 22]. Недавно был опубликован протокол первой фазы клинического испытания системного антагониста TRPV4. Осуществляется проверка его безопасности и переносимости здоровыми субъектами и пациентами с сердечной недостаточностью. Результаты этого исследования могут ознаменовать начало новой эры в медикаментозном лечении гиперактивности мочевого пузыря [23].
Детрузор. Следом за уротелием в мочевом пузыре располагается детрузор – сеть связанных между собой гладкомышечных клеток, функционирующих по принципу синцития [19]. Главная особенность последнего состоит в том, что образующие его клетки не полностью отделены друг от друга, образуя своего рода мультиядерную структурную единицу. Основным процессом, характеризующим деятельность детрузора как функционального слоя, является сокращение. Обеспечивается оно посредством медиатора парасимпатической нервной системы, ацетилхолина, выделяющегося постганглионарными аксонами тазовых нервов. В данном случае ацетилхолин связывается с мускариновыми (м3) рецепторами детрузора, что создает основу любого мышечного сокращения – потенциал действия. Углубляясь в процесс формирования потенциала действия в мышце мочевого пузыря, необходимо отметить, что центральная роль в нем принадлежит кальциевым ионным каналам L-типа на мембране гладкомышечных клеток. Именно по ним осуществляется массивный приток ионов Ca2+, что активирует м3-рецептор, в конечном счете обеспечивает сокращение мышцы и физиологическое изгнание мочи [24].
Слой интерстициальных клеток. Рассмотрев физиологическую роль уротелия и детрузора, нельзя не упомянуть о клетках, лежащих непосредственно между этими двумя слоями. Речь идет о субуротелиальных интерстициальных клетках, или миофибробластах [25]. Отдельного описания они заслужили благодаря своей особой роли посредника между сенсорным уротелием и сократительным детрузором [26–29]. Выполнение этой важной функции стало возможным ввиду их расположения в непосредственной близости от афферентных нервных волокон, а также их тесной связи друг с другом посредством щелевых межклеточных контактов [19]. Интересно, что проницаемость этих контактов снижается при внутриклеточном повышении концентрации кальция [30], а гладкомышечные клетки, как было описано выше, при таких условиях, напротив, сокращаются. Это дает основание пролагать, что интерстициальные клетки предотвращают бесконтрольное повышение концентрации ионов Ca2+ и предупреждают спонтанные сокращения детрузора по принципу отрицательной обратной связи.
В физиологических условиях во время фазы наполнения и растяжения стенки мочевого пузыря реализуется сложный каскад биохимических превращений, способствующий передаче сигнала по чувствительным нервным волокнам напрямую в задние рога спинного мозга. На рис. 1 продемонстрирована общая картина функционирования мочевого пузыря в различных его слоях, позволяющая лучше понимать сущность вышеописанных процессов.
Как показано на рис. 1, ацетилхолин, высвобождаемый в мочевом пузыре парасимпатическими нервами тазового сплетения (показаны красным), проходит два противоположных пути превращения. Путь активации, опосредованный никотиновыми рецепторами типа α3(+), – возбуждающий. Этот механизм предполагает дальнейшее связывание медиатора с мускариновым рецептором, что приводит к сокращению детрузора. Второй путь дезактивации – ингибиторный, осуществляемый через α7(-)-рецепторы. Он обеспечивает накопление мочи. Афферентные волокна (показаны синим) секретируют ВP, который вступает в каскад биохимических реакций с КГСП, стимулирует высвобождение ФРН и рецепторов TRPV1, P2X3. Биологический смысл представленного цикла реакций заключается в передаче информации афферентным волокнам о боли или наполнении мочевого пузыря. Также ВР реализует свои уже описанные выше биологические эффекты, связываясь со специфичным для себя рецептором NK1.
Подробно рассмотрев структурную организацию слоев мочевого пузыря, становится очевидно, что даже малейшее отклонение от физиологической нормы на уровне медиаторов приведет к патологическим ситуациям, проявляющимся в виде симптомов или синдрома. Однако перенаправить действие биологически активных веществ, вернув им здоровое функционирование, в настоящее время не представляется возможным. Единственный выход – отключение «сломанного» механизма. Речь идет о медикаментозном блокировании выброса медиаторов либо угнетении рецепторов мочевого пузыря посредством инъекций ботулотоксина А и приема мускариновых антагонистов. Вопрос эффективности холинолитиков будет рассмотрен в соответствующем разделе, здесь же основное внимание будет уделено механизму действия и новым технологиям в применении ботулотоксина А.
Современные методы доставки ботулинического токсина А
Внутрипузырное введение лекарственного препарата для лечения дисфункции НМП обладает двумя неоспоримыми преимуществами: обеспечивает высокую концентрацию фармакологических агентов непосредственно в ткани мочевого пузыря и минимизирует системные побочные эффекты. Именно эти преимущества относятся к использованию ботулотоксина А. Это нейротоксин, продуцируемый бактериями рода Clostridium botulinum. Существует семь подтипов ботулотоксина (от A до G) [31]. Подтип А имеет наибольшую продолжительность действия, что делает его наиболее актуальным для клинического применения.
Имея представление о работе медиаторов в слоях мочевого пузыря, понять механизм действия ботулотоксина А довольно просто. При попадании в ткань препарат ингибирует высвобождение всех задействованных в сокращении мочевого пузыря биологически активных веществ (см. рис. 1), среди которых ацетилхолин [32], ФРН и ВР [33]. Кроме того, для ботулотоксина А характерно снижение реактивности ранее рассмотренных рецепторов TRPV1 и P2X3, а также секреции АТФ [34]. Такое тотальное ингибирование медиаторов и временный «паралич» мочевого пузыря служат результатом действия токсина на мембранные белки-мишени SNARE [35]. Тем не менее действие ботулотоксина А обратимо. За 8–10 мес. аксоны развивают боковые отростки и полностью регенерируют, что требует повторного введения препарата [36].
На сегодняшний день способ доставки ботулотоксина А в ткань не является стандартизованным. И хотя внутрипузырные инъекции – минимально инвазивный метод, с ними могут быть связаны нежелательные побочные эффекты и дискомфорт пациентов после процедуры [37]. В связи с этим возникла потребность в новых способах доставки препарата в мочевой пузырь. Некоторые из них уже находятся на этапе клинических испытаний [38].
Электрокинетическая доставка. В отличие от любой другой формы введения лекарства этот процесс ускоряет поступление препарата в ткани мочевого пузыря посредством электрокинетических явлений. Среди них: ионофорез, определяемый как активный транспорт ионизированных молекул в ткани под воздействием электрического тока и электроосмос, при котором проникающая способность неионизированных растворенных веществ в тканях повышается посредством электрического тока. Для реализации способа первый электрод размещают в мочевом пузыре, проведя его через катетер, а второй электрод устанавливают на передней брюшной стенке. На сегодняшний день это единственный неинъекционный метод доставки ботулотоксина А, использованный пациентами с нейрогенной гиперактивностью детрузора, а именно детьми с миеломенингоцеле. Авторы сообщили о значительном улучшении уродинамических показателей на фоне проводимого лечения. В частности, об увеличении максимальной цистометрической емкости, снижении максимального детрузорного давления, сокращении числа эпизодов недержания мочи и риска возникновения пузырно-мочеточникого рефлюкса [39, 40].
Липосомальные лекарственные препараты (липотоксины). Липосомы представляют собой микроскопические пузырьки с фосфолипидным бислоем, что позволяет им инкапсулировать гидрофильные и гидрофобные молекулы, которые затем могут доставляться в клетки посредством эндоцитоза [41]. Дискуссия вокруг возможной комбинации ботулотоксина А с липосомами продолжается на протяжении нескольких десятилетий. Исследователями было показано, что после липосомальной инкапсуляции частицы ботулотоксина А остаются активными [42]. Кроме того, дальнейшие эксперименты продемонстрировали ингибирующее влияние инкапсулированного в липосомах ботулотоксина А на высвобождение нейротрансмиттеров в уротелии [43]. В двух рандомизированных плацебо-контролируемых исследованиях изучался эффект внутрипузырной доставки инкапсулированного в липосомы ботулотоксина А 24 и 55 пациентам с идиопатической гиперактивностью детрузора, резистентной к антимускариновым препаратам [44, 45]. Оба исследования продемонстрировали влияние липотоксина на такие показатели, как частота мочеиспусканий и число эпизодов ургентности. Уменьшение числа эпизодов ургентности и болезненности мочевого пузыря, сохранявшееся в течение 12 и 8 нед. соответственно, констатировали в небольшом исследовании с участием 14 пациентов, получавших липосомы [46]. Несмотря на эти обнадеживающие результаты, в двухцентровом двойном слепом плацебо-контролируемом исследовании 59 пациентам с синдромом болезненного мочевого пузыря не удалось продемонстрировать снижение симптомов при внутрипузырном введении липотоксина по сравнению с NaBota или плацебо [47].
Термочувствительные гидрогели. Термочувствительные гидрогели представляют собой зависящие от температуры водные растворы полимеров, которые используются для увеличения биодоступности препарата в мочевом пузыре. При инстилляции они находятся в жидком состоянии, но при температуре тела становятся полутвердыми. Внедрение ботулотоксина А в гидрогели, по-видимому, продлевает его действие в мочевом пузыре до 6–8 ч против 2 ч при простой инстилляции [48]. Результаты исследований выглядят многообещающими, позволяя рассматривать возможность проведения дальнейших клинических испытаний [48, 49].
Таким образом, разработка новых методов доставки ботулотоксина А остается перспективным направлением исследований, ориентированных прежде всего на сохранение высокой эффективности терапии и минимизацию побочных эффектов.
Конкурентные ингибиторы мускариновых рецепторов: механизм действия и вопросы эффективности
Анализ результатов фундаментальных исследований позволил сформировать представления о структуре, свойствах и изменениях в мускариновом рецепторе, а значит, лучше понять механизм действия лекарственных препаратов. В данном разделе рассмотрены процесс взаимодействия холинолитиков с рецепторами и возможные причины возникновения препятствий на пути к достижению желаемого лекарственного эффекта в лечении ГАМП.
На сегодняшний день в мочевом пузыре выделяют два типа мускариновых рецепторов к ацетилхолину – м3 и м2. Однако функциональные исследования на полосках ткани детрузора человека показали, что за контрактильность в большей степени отвечают именно м3-рецепторы, что и сделало их мишенью селективной лекарственной терапии [50, 51]. Известно, что конкурентные антагонисты мускариновых рецепторов воздействуют на уровне не детрузора, а уротелия, где плотность м3-рецепторов существенно выше [52–54], снижая в большей степени гиперсенсорность, чем мышечную гиперактивность. Тем не менее необходимо выяснить: что же влияет на эффективность ингибиторов мускариновых рецепторов и по какому механизму осуществляется это воздействие? Данные вопросы чрезвычайно сложны, и дать однозначные ответы на них пока не представляется возможным. И все же, используя накопленные знания в области биохимии и физиологии клетки, мы можем рассмотреть мускариновый рецептор с точки зрения его структурно-функциональных особенностей, что позволит спрогнозировать возможные рецепторные модификации и исходы терапии холинолитиками.
Виды рецепторов. Прежде всего необходимо иметь общее представление о видах рецепторов к медиаторам и гормоноподобным веществам в организме человека. Выделяют две группы рецепторов: ионоторопные и метаботропные (рис. 2).
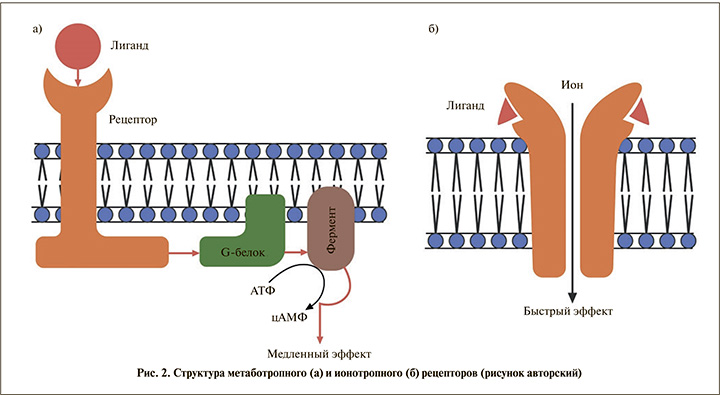
Ионотропные рецепторы имеют непосредственный контакт с ионным каналом клетки, и при их активации посредством входа или выхода из клетки заряженных частиц происходят изменения электрического потенциала клетки и локальные физиологические эффекты. Передача сигнала по метаботропным рецепторам происходит сложнее посредством транспортных G-белков. Эти белки при связывании с лигандом (медиатор, гормон, фармакологический препарат) активируют систему вторичных посредников (цАМФ, цГМФ, тирозинкиназа), что так же, как и в случае с ионоторпными рецепторами, приводит к физиологическому эффекту. Однако, в отличие от ионотропных рецепторов, метаботропные рецепторы обеспечивают более продолжительный эффект и оказывают влияние на метаболизм и жизнедеятельность всей клетки. Именно к классу метаботропных рецепторов и относится рассматриваемый ацетилхолиновый мускариновый рецептор.
Ввиду сложного многостадийного механизма функционирования этому классу рецепторов присущи различные изменения его биохимических свойств. Среди них развитие десенситизации [55], т.е. потери чувствительности под влиянием агонистов, а также увеличение числа рецепторов под влиянием антагонистов и ингибиторов [56, 57]. Все это в итоге приводит к изменению терапевтического эффекта лекарственных веществ. Однако, прежде чем напрямую коснуться рецепторных изменений и вопросов эффективности лечения, необходимо затронуть основы метаболизма ацетилхолина. Этот медиатор непрерывно синтезируется в нервных волокнах в большом количестве, стремясь к постоянному восполнению своих запасов, которые истощаются малыми порциями даже в состоянии покоя [57]. При растяжении стенки мочевого пузыря и высвобождении ацетилхолина из нервных окончаний он моментально связывается со всеми доступными рецепторами на мембране, а его излишки лизируются холинэстеразами или подвергаются обратному захвату. Именно на момент связывания лиганда с активным сайтом рецептора и действуют конкурентные ингибиторы, чья концентрация изначально должна превосходить концентрацию медиатора у конкретного пациента для достижения значимого терапевтического эффекта. Даже если дозировака препарата сразу была подобрана верно и ингибитор смог конкурентно блокировать действие ацетилхолина, на какое-то время обеспечивая снижение симптомов гиперактивности мочевого пузыря, через определенный период число метаботропных мускариновых рецепторов начнет расти в связи с необходимостью связывания большого числа свободного медиатора [56]. В этом случае может потребоваться увеличение дозировки лекарства, что нередко приводит к усилению побочных эффектов. В отсутствие коррекции терапии, которая, как правило, сочетается с нарушением режима приема препарата пациентом ввиду снижающейся эффективности, возможно развитие так называемого феномена выстрела наповал. Он возникает, когда возросшие физиологические концентрации несвязанного эндогенного ацетилхолина начинают активно взаимодействовать с освободившимися от конкурентного ингибитора рецепторами, что приводит к увеличению выраженности ранее контролируемых симптомов [56]. По данным литературы, отказ пациентов от приема холинолитиков, даже не завершив курс, назначенный врачом, имеет место и обусловлен прежде всего недостаточной эффективностью, которая подкрепляется побочными действиями [58, 59]. Кроме этого необходимо помнить и про другие медиаторы, о роли которых уже говорилось ранее. Афферентные С-волокна будут продолжать секретировать АТФ, вещество P, КГСП и другие биологически активные вещества, на которые не будут действовать конкурентные ингибиторы мускариновых рецепторов. Более того, имеются данные, согласно которым вклад мускариновых механизмов в регуляцию сократимости мочевого пузыря значительно снижается в пользу перечисленных выше медиаторов при развитии заболеваний [60].
Основные положения второй части лекции можно сформулировать следующим образом:
- Поражения уротелия могут приводить как к развитию гиперчувствительности и СБМП, так и к детрузорной гиперактивности посредством плотных межклеточных связей, проводящих патологическое возбуждение от уротелия к детрузору;
- Симптомокомплекс ГАМП может быть в большей степени опосредован нарушениями тахикининового контроля и контроля АТФ, чем изменением холинового контроля;
- М3-мускариновые рецепторы метаботропны и при воздействии конкурентных ингибиторов склонны к росту численности, что может сказываться на эффективности лекарственной терапии;
- Внутрипузырное введение ботулотоксина А с использованием различных модификаций его доставки остается наиболее перспективным направлением лечения гиперчувствительности мочевого пузыря и СБМП.
В процессе написания данной лекции проведен анализ фундаментальных исследований за период с 1983 по 2019 г., что дало возможность проследить динамику представлений о функционировании НМП. Однако следует признать, что материал должен быть истолкован в свете некоторых ограничений. Ввиду специфичности рассматриваемой темы количество мета-анализов и систематических обзоров в базах данных ограниченно. И хотя при поиске материалов не проводилось разделения публикаций на клинические и фундаментальные, основную массу использованных для анализа работ составили оригинальные исследования.



