Введение. Мочекаменная болезнь (МКБ) занимает одно из первых мест в структуре урологической заболеваемости. По оценкам разных исследователей, МКБ встречается у 1–15% населения планеты в зависимости от региона проживания [1–4]. Заболеваемость уролитиазом неуклонно растет как в Российской Федерации, так и в мире в целом [5, 6].
В настоящее время большое внимание уделяется коморбидности МКБ. Некоторые авторы относят МКБ к группе системных заболеваний [7–11]. Прослеживается патогенетическая связь уролитиаза с атеросклерозом, гипертонической болезнью, метаболическим синдромом, инфарктом миокарда, инсультом [12, 13]. Также в последние годы опубликовано довольно много работ, свидетельствующих о том, что еще одним значимым фактором риска развития МКБ является сахарный диабет 2 типа (СД2) [14–16]. Показано, что абдоминальное ожирение, гипергликемия и СД2 независимо коррелируют с повышенным риском уролитиаза [17]. Это связано с одновременным действием двух групп факторов: метаболическими нарушениями, ведущими к развитию инсулинорезистентности и гипергликемии, а также изменениями в составе мочи, способствующими камнеобразованию вследствие действия тканевого воспаления, и молекулярными нарушениями, влияющими на транспорт метаболитов в мочу [18].
По мнению J. P. Haymann et al. [19], выявление камней в почках может рассматриваться как почечное проявление СД2 и метаболического синдрома, а их наличие должно учитываться при назначении консервативного лечения больным с так называемым идиопатическим уролитиазом.
Таким образом, у больных СД2 имеются предпосылки к развитию МКБ, обусловленные развитием ряда метаболических нарушений, влияющих на функцию почек и состав мочи, основные из которых – гипергликемия и инсулинорезистентность. В то же время эти больные, как правило, получают противодиабетическую терапию, направленную на контроль уровня сахара в крови, стимуляцию секреции инсулина поджелудочной железой и повышение чувствительности инсулиновых рецепторов к этому гормону (т.е. снижение инсулинорезистентности), что потенциально может влиять на риск развития МКБ как в положительную, так и в отрицательную сторону.
С учетом всего вышесказанного целью нашей работы было сравнить биохимические показатели крови и мочи, а также химический состав мочевых камней, выявленных у пациентов с МКБ в среднем по популяции и у пациентов, страдавших одновременно уролитиазом и СД2.
Материалы и методы. Работа была проведена в два этапа.
Первый этап – анализ химического состава мочевых камней у пациентов с МКБ в среднем по популяции и у пациентов, страдавших одновременно уролитиазом и СД2.
В работе проанализировано две группы пациентов.
В первой группе были изучены данные 5669 пациентов, страдавших МКБ, из которых 3240 мужчин и 2429 женщин в возрасте от 16 до 74 лет, находившихся на лечении в НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина – филиал НМИЦ радиологии Минздрава России с 2010 по 2013 г. Результаты указанной работы опубликованы ранее [20].
Во вторую группу были включены 350 пациентов, страдавших одновременно МКБ и СД2, из них 146 мужчин и 204 женщины в возрасте от 30 лет до 61 года.
Для определения химического состава использовали мочевые камни, удаленные оперативно, отошедшие самостоятельно или фрагментированные с помощью дистанционной литотрипсии. Минеральный состав мочевых конкрементов или их фрагментов определяли методом инфракрасной спектроскопии на спектрофотометре Nicolet iS10 («Thermo Fisher Scientific Inc.», США).
Идентификацию минерального состава осуществляли с помощью специального программного обеспечения (Kidney Stones Analysis) для качественного и количественного анализа мочевых камней с использованием встроенной библиотеки спектров и специального алгоритма для идентификации компонентов камней.
Отнесение камней смешанного состава к тому или иному типу (кальций-оксалатные, уратные, кальций-фосфатные, цистиновые) проводили по главному преобладающему минеральному компоненту (более 50% всей минеральной основы). Такой подход к классификации типов мочевых конкрементов наиболее распространен.
Второй этап – анализ биохимических показателей крови и мочи у пациентов с МКБ в среднем по популяции и у пациентов, страдавших одновременно уролитиазом и СД2.
В сыворотке крови определяли уровень кальция, мочевой кислоты, в суточной моче – показатели экскреции кальция, натрия, фосфора, магния, мочевой кислоты, pH мочи.
Определение биохимических показателей проводили на автоанализаторе ADVIA 1200 («Bayer-Siemens», Германия) c использованием наборов реагентов той же фирмы в пробах сыворотки венозной крови, взятой натощак, и в пробах суточной или утренней мочи.
Так же как и на первом этапе работы, материалом для исследования служили данные двух групп пациентов.
В первую группу вошел 101 пациент с диагнозом МКБ. Во вторую – 350 пациентов с диагнозом МКБ и СД2, из них 146 мужчин и 204 женщины в возрасте от 30 лет до 61 года.
В исследование отбирали больных МКБ, перенесших почечную колику с самостоятельным отхождением камня хотя бы раз в жизни или оперативные вмешательства на верхних мочевых путях по поводу МКБ. Большинство (77%) обследованных постоянно проживали на территории Москвы и Московской области, остальные – в других регионах РФ. Все обследованные были гражданами РФ.
Для статистического анализа результатов использовали пакет прикладных программ Statistica 10.0. Рассчитывали частоту встречаемости признаков, для анализа межгрупповых различий применяли t-критерий Стьюдента. Критический уровень достоверности различия между группами принимали равным 0,05.
Результаты. Общее распределение пациентов с МКБ
В общей популяции пациентов, страдающих уролитиазом, по показателю встречаемости доминируют оксалатные камни (56,8%), тогда как среди пациентов, страдающих МКБ и имеющих сопутствующий СД2, превалирующим является мочекислый тип конкрементов (74,3%; табл. 1). Цистиновые камни встречались в единичных случаях, при этом не было выявлено ни одного случая сочетания цистинового уролитиаза и СД2 (см. табл. 1).

Распределение по полу
Определенный интерес представляют особенности распределения конкрементов в зависимости от пола больных.Как видно из табл. 2, в общей популяции пациентов с МКБ для женщин характерна несколько большая склонность к формированию фосфатных камней, а относительная частота уратного уролитиаза у мужчин и женщин практически не различалась (17,4 против 16%). При сопутствующем СД2 пол больных никак не влиял на вероятность формирования конкрементов того или иного состава (табл. 3).

Распределение по возрасту
Анализ возрастных особенностей показал, что в целом по популяции МКБ страдают в основном работоспособные граждане в возрасте 20–50 лет (51,5%). В возрасте старше 70 лет данное заболевание регистрируют существенно реже – в 7,2% случаев (рис. 2).
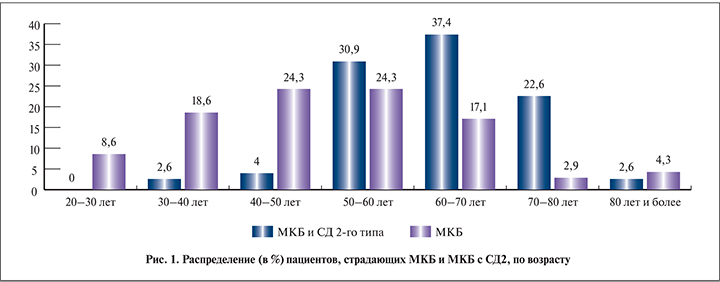
Оценка возрастных категорий пациентов с МКБ и СД2 показала, что в отличие от общепопуляционных тенденций уролитиаз в сочетании с СД2 гораздо чаще встречается в возрасте 50–70 лет (68,3% случаев). При этом в возрасте 20–50 лет МКБ и СД2 выявляются довольно редко (6,6%), в возрасте старше 70 лет – заметно чаще (25,2%; см. рис. 1).
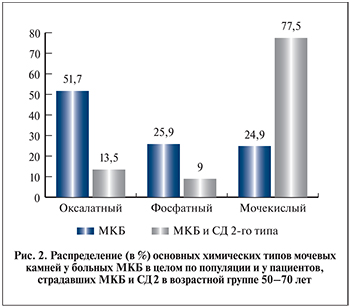 Поскольку химический состав мочевых камней в разных возрастных группах имеет свои особенности [21], сравнивали распределение основных химических типов мочевых камней у больных МКБ в целом по популяции и у пациентов, страдавших МКБ и СД2, в возрастной группе 50–70 лет.
Поскольку химический состав мочевых камней в разных возрастных группах имеет свои особенности [21], сравнивали распределение основных химических типов мочевых камней у больных МКБ в целом по популяции и у пациентов, страдавших МКБ и СД2, в возрастной группе 50–70 лет.
Проведенный анализ выявил определенную тенденцию к увеличению встречаемости уратного уролитиаза в общей популяции больных МКБ среди пациентов в возрасте 50–70 лет (24,9 против 17,4% во всех возрастных группах).
В общей популяции больных МКБ преобладает кальций-оксалатный уролитиаз (51,66%), при СД2 основным типом мочевых камней являются ураты (77,5%; рис. 2).
Метаболические литогенные нарушения у больных МКБ и пациентов с МКБ и СД2
Выявленные особенности распределения почечных конкрементов в общей популяции и при сопутствующем СД2 имеют в своей основе различные биохимические фено-мены.
Основным метаболическим нарушением, предрасполагающим к камнеобразованию, традиционно считается гиперкальциурия, выявляемая у 60,4% пациентов общей популяции. В то же время при сопутствующем СД2 повышенный уровень почечной экскреции кальция наблюдался у достоверно меньшего числа больных – 9,4% (p<0,00001; табл. 4).
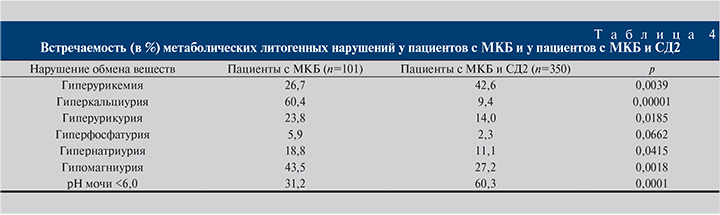
Гиперурикурия чаще выявлялась у пациентов без сопутствующего СД2 в анамнезе (26,7 против 42,6%; p=0,0039; табл. 4). При этом повышенная концентрация мочевой кислоты крови чаще определялась при МКБ и СД2 (42,5 против 26,7%; p=0,0039).
У 60,3% пациентов с МКБ и СД2 отмечена резко кислая реакция утренней порции мочи (pH<6,0).
Повышенная почечная экскреция неорганического фосфата несколько чаще наблюдалась в общей популяции пациентов, страдавших МКБ, чем в субпопуляции, имевшей сочетанное заболевание (5,9 против 2,3%). Однако различия не достигли уровня статистической значимости (p=0,0662), поэтому здесь можно говорить лишь о намечающейся тенденции.
Стоит подчеркнуть, что гипомагниурия у пациентов с МКБ и СД2 обнаружена в 27,2% случаев. В общей популяции пациентов с уролитиазом достаточно часто встречается гипомагниурия (43,5%). Как известно, магний образует комплексы с оксалатами и солями кальция и таким образом ингибирует процессы камнеобразования. Низкий уровень магния связан со снижением ингибиторной активности мочи, а также сопровождается низким уровнем цитратов в моче, что также стимулирует процессы камнеобразования [22].
Анализ экскреции натрия с мочой у пациентов с МКБ показал, что гипернатриурия встречается в 18,8% случаев в целом по популяции и в 11,1% – у пациентов с уролитиазом и СД2 (см. табл. 4).
Обсуждение. Высокая встречаемость уратного уролитиаза у пациентов, имевших не только СД2, но и вообще нарушения углеводного обмена, на сегодняшний день хорошо доказанный факт. Однако ввиду противоречивости имеющейся в литературе информации представляют интерес более точные эпидемиологические данные. Кроме того, все еще остается нерешенным вопрос о вторичном характере уролитиаза у больных, страдающих СД.
Полученные в ходе исследования большой выборки (более 5500 пациентов) результаты демонстрируют высокую частоту выявления уратных камней у пациентов, имевших СД2 (74%), причем без существенных различий по частоте выявления конкрементов различного состава в зависимости от пола.
Возрастные особенности уролитиаза при СД2 также вполне объяснимы склонностью этого типа диабета к развитию в среднем и пожилом возрасте. Причем нередко манифестации предшествует длительный (иногда многолетний) период, когда у пациента отмечается лишь субклиническое нарушение толерантности к глюкозе.
Исследование О. И. Аполихина и соавт. [23] продемонстрировало четкую взаимосвязь между наличием у пациента метаболического синдрома с нарушением толерантности к глюкозе и повышенным риском уролитиаза. В исследование не включали пациентов с СД2, однако повышенная частота уролитиаза все равно была обусловлена главным образом гиперурикемией и гиперурикурией. Можно полагать, что ассоциированный с СД риск уратного уролитиаза формируется еще до манифестации диабета на этапе нарушения толерантности к глюкозе.
Известно, что образование камней разного химического состава обусловлено различными патофизиологическими механизмами. Проведенный анализ показал, что во всех группах с сопутствующим СД2 преобладали больные, имевшие уратные камни, что характерно для уролитиаза на фоне нарушений углеводного обмена и соответствует результатам ранее проведенных исследований [24, 25].
Показано, что увеличение частоты выявления уратных конкрементов у пациентов с СД2 связано со значительным снижением показателей pH мочи. В свою очередь инсулинорезистентность служит основной причиной подкисления мочи у пациентов с МКБ и СД2. Как известно, инсулин стимулирует процесс образования в эпителии почечных канальцев ионов аммония из аминокислот путем их дезаминирования (аммониогенез) [27], а также натрий-водородный обмен в почечных канальцах [27], что инициирует экскрецию ионов аммония с мочой [28]. У пациентов с СД2 инсулинорезистентность может нарушать аммониогенез и таким образом снижать pH мочи. У здоровых лиц значительного снижения концентрации ионов аммония (NH4+) в моче не происходит в связи с тем, что данный процесс компенсируется путем увеличения концентрации титруемых аминокислот. Однако у пациентов с СД2 нарушаются компенсаторные механизмы и как следствие – отмечается сниженная концентрация ионов аммония в моче [28].
Увеличение частоты выявления уратных конкрементов при МКБ на фоне СД2 по сравнению с МКБ у пациентов с сохранным углеводным обменом также может быть связано с ростом уровня инсулина, что, как правило, сопровождается повышением концентрации мочевой кислоты в сыворотке крови и усилением реабсорбции натрия в проксимальных почечных канальцах [29]. Считают, что не гиперинсулинизм, а гипергликемия влияет на канальцевую реабсорбцию глюкозы и натрия, что в свою очередь отражается на почечной экскреции мочевой кислоты [30].
Кроме того, в работе [31] продемонстрирована повышенная частота гиперурикемии (40%) у пациентов, страдающих СД2, по сравнению с лицами, не имеющими нарушений углеводного обмена [31]. Автор предполагает, что склонность к сдвигу pH мочи в кислую сторону связана с истощением буферных систем на фоне ацидоза, обусловленного СД.
В дополнение к сказанному следует добавить, что не исключено влияние на показатели pH мочи специфической гипогликемической терапии, которую получают пациенты с СД2. При этом замечено, что у пациентов с МКБ и СД2, получающих инсулин, уровень pH мочи будет значительно выше, чем у пациентов, принимающих гипогликемические таблетированные препараты. Так, F. C. Torricelli et al. [32] установили, что у пациентов, страдавших МКБ и СД2 с высоким уровнем гликозилированного гемоглобина, получавших инсулин, уровень pH мочи выше, чем у таковых, принимавших другие виды гипогликемической терапии.
Стоит обратить внимание на тот факт, что по результатам проведенного исследования перенасыщенность мочи камнеобразующими веществами у пациентов с МКБ и СД2 встречалась достаточно редко (табл. 4). Вероятно, роль суперсатурации мочи в процессах литогенеза при СД2 не столь велика. Вполне возможно, что при образовании уратных камней перенасыщенная моча не влияет на процессы камнеобразования. Подобная тенденция отмечена в выполненной нами ранее работе, где было обнаружено, что урикурия выше 4,3 ммоль/сут стимулировала формирование преимущественно оксалатных камней, но не уратных конкрементов, частота выявления которых даже снижалась с 42,1 до 14,6% [33].
Наряду с низкими значениями pH мочи возможным звеном патогенеза уратного уролитиаза может быть свободнорадикальное окисление. Мочевая кислота крови выступает в качестве свободного радикала и активирует процессы перекисного окисления липидов, в результате чего повреждается стенка уротелия и образуется пробка Рендалла [34].
Очень сложен вопрос о вторичном характере уролитиаза при СД2. Формулировка «вторичный» означает, что известен этиологический фактор, по отношению к которому процесс камнеобразования вторичен, в отличие от классической МКБ, где этиология литогенеза до сих пор окончательно не раскрыта. В современной урологии понятия «первичное» и «вторичное заболевание» проработаны недостаточно и в отношении уролитиаза официально не признаны.
Между тем термины «вторичная гиперурикемия» и «вторичная подагра» вполне легитимны и достаточно широко применяются, однако преимущественно в терапевтических специальностях – ревматологии, нефрологии и т.д.
Самым ярким вариантом вторичной гиперурикемии служит «синдром распада опухоли», развивающийся при химио- и радиотерапии лимфопролиферативных заболеваний, реже – опухолей другой локализации. Одновременное разрушение массы делящихся клеток сопровождается гиперпродукцией мочевой кислоты, приводящей к развитию острой мочекислой (подагрической) нефропатии, причем зачастую в ранее неизмененных почках.
Мочекаменная болезнь на фоне сопутствующего СД2, на наш взгляд, не обладает свойствами и особенностями, позволяющими однозначно считать ее вторичной.
При СД2 нередко имеют место гиперурикемия и гиперурикурия, явно вторичные по отношению к нарушениям углеводного обмена. Однако эти мочевые феномены отмечаются далеко не у всех пациентов. И существенного повышения частоты именно уратного уролитиаза, как это имеет место при генетически обусловленных гемолитических анемиях (талассемиях различного типа) или суставном псориазе, не наблюдается [35].
Не прослеживается четкой взаимосвязи между тяжестью и частотой обострений (рецидивов, эпизодов декомпенсации и т.д.) основного заболевания и рецидивированием уролитиаза. Например, в отношении диабетической нефропатии (бесспорно носящей вторичный характер) эта зависимость прослеживается очень ярко [36].
Отсутствие ярко выраженных групп риска, выделенных по половому, возрастному признакам, другим демографическим или медицинским параметрам и частоте рецидивирования уролитиаза, и вышеупомянутые факты свидетельствуют о том, что СД2 и МКБ являются коморбидными заболеваниями.
Заключение. Анализ химического состава мочевых камней и литогенных параметров крови и мочи показал, что у пациентов с МКБ и сочетанным СД2 гораздо чаще образуются уратные конкременты, чем в целом по популяции. При этом низкие показатели pH мочи (<6,0) в рассматриваемой группе пациентов, по всей видимости, определяют особенности процессов камнеобразования. Коррекция метаболических литогенных нарушений при СД2 должна быть направлена в первую очередь на повышение значений pH мочи и снижение концентрации мочевой кислоты в крови и моче. Требуются дальнейшие исследования определения роли СД2 при камнеобразовании.



