Введение. Нижние мочевыводящие пути представлены мочевым пузырем и мочеиспускательным каналом. Одной из самых часто встречающихся патологий уретры является стриктурная болезнь, реже – полная облитерация уретры и различные врожденные заболевания уретры.
Стриктура уретры – это полиэтиологическое заболевание, проявляющееся симптомами нижних мочевыводящих путей, при котором возникает сужение диаметра просвета уретры вплоть до полной ее облитерации в результате рубцового перерождения тканей стенки мочеиспускательного канала.
Протяженность, локализация, причины и степень тяжести стриктур уретры разнообразны. В первую очередь это определяется этиологией их возникновения. Они могут быть вызваны различными ятрогенными повреждениями уретры, травмой костного тазового кольца со смещением костных отломков, приводящей к дистракционным разрывам уретры на уровне тазовой диафрагмы, прямой травмой промежности, эндоскопическими манипуляциями при трансуретральных операциях, длительной катетеризацией мочевого пузыря у больных, находящихся в отделениях реанимации, хроническим воспалением в уретре при неэффективном лечении острых уретритов [1–3].
Основным методом диагностики облитераций и стриктур уретры в настоящее время служит рентгенологическое исследование уретры, которое включает ретроградную (восходящую) уретрографию и антеградную (микционную) цистоуретрографию. Данные методики используются уже в течение столетия в качестве стандартного способа визуализации для оценки строения и функции нижних мочевыводящих путей [4–6]. Однако классические рентгенологические методики имеют ряд недостатков. Видимое изображение в силу физических законов не всегда отражает истинную форму, величину, положение и структуру исследуемого объекта, т.е. возникает искажение получаемой картины. Инвазивность процедуры, связанная с ретроградным введением контрастного препарата в уретру и риском ее инфицирования, также накладывает свои ограничения [7–9].
В некоторых случаях с помощью рентгенологических методов обследования не удается получить исчерпывающие данные об анатомии уретры, локализации и протяженности стриктуры, осложнениях и т.д. В подобных ситуациях возникает необходимость в дополнительных методах исследования, таких как УЗИ, магнитно-резонансная томография (МРТ) и компьютерная томография (КТ) [10–11].
Компьютерная томография, выполняемая на аппаратах с многорядными детекторами, обеспечивает быстрое получение диагностического изображения и возможность выполнения динамических исследований, к которым относится объемная динамическая микционная мультиспиральная компьютерная цистоуретрография (ОДММКЦ). Это относительно новая и малоизученная диагностическая методика, которая может быть использована для выявления патологии нижних мочевыводящих путей [11–14].
Целью настоящего исследования стало определение возможности использования объемной динамической микционной мультиспиральной компьютерной цистоуретрографии (ОДММКЦ) для оценки состояния нижних мочевыводящих путей во время мочеиспускания.
Материалы и методы. В исследование вошли 22 пациента, которые находились на лечении в отделении пластической и реконструктивной хирургии Университетской клинической больницы № 1 Первого МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет) с марта 2017 по ноябрь 2018 г. Возраст пациентов варьировался от 17 до 58 лет (средний возраст – 43,8 года). Четыре (18%) пациента были прооперированы по поводу посттравматического дефекта уретры, Восемнадцати (82%) пациентам были выполнены операции по смене пола при транссексуализме. Часть пациентов прооперированы в рамках протоколов клинической апробации метода микрохирургической аутотрансплантации комплексов тканей для лечения протяженных стриктур и облитераций уретры, а также метода микрохирургической аутотрансплантации комплексов тканей – заместительная интеграционная фаллопластика – для лечения ампутаций полового члена, травм и последствий ятрогений наружных мужских мочеполовых органов, приводящих к невозможности их функционирования, а также врожденных и наследственных заболеваний, связанных с полным или частичным недоразвитием полового члена, утвержденных Министерством здравоохранения России. Для реконструкции уретры и/или полового члена использовали свободные реваскуляризированные микрохирургические аутотрансплантаты – кожно-фасциальный лучевой и кожно-мышечный торакодорсальный.
В рамках предоперационной подготовки и послеоперационного контроля полученных результатов хирургического лечения всем пациентам были проведены урофлуометрия, УЗИ органов малого таза и наружных половых органов, ретроградная и микционная цистоуретрография.
 Всем пациентам до и после операции выполняли МСКТ в сочетании с ОДММКЦ на мультиспиральном компьютерном томографе Aquilion One («Toshiba»). Данный 640-срезовый компьютерный томограф обладает 320 рядами детекторов, каждый шириной по 0,5 мм, что позволяет рентгеновской трубке за один оборот покрывать зону сканирования в 16 см. С учетом размера половых органов и мочевого пузыря такие технические параметры аппарата позволяют проводить динамическое исследование всей области интереса.
Всем пациентам до и после операции выполняли МСКТ в сочетании с ОДММКЦ на мультиспиральном компьютерном томографе Aquilion One («Toshiba»). Данный 640-срезовый компьютерный томограф обладает 320 рядами детекторов, каждый шириной по 0,5 мм, что позволяет рентгеновской трубке за один оборот покрывать зону сканирования в 16 см. С учетом размера половых органов и мочевого пузыря такие технические параметры аппарата позволяют проводить динамическое исследование всей области интереса.
Исследования выполняли в стандартной укладке пациента на спине с заведенными за голову руками. Перед исследованием больной выпивал до 500 мл воды с целью наполнения мочевого пузыря. При возникновении достаточного позыва к мочеиспусканию пациента укладывали на стол компьютерного томографа. Для сбора мочи использовали памперс. Так как мочеиспускание в положении лежа у некоторых пациентов представляет определенные сложности, за 1–2 дня до исследования их учили мочиться лежа на спине. Для контрастирования использовали йодсодержащий контрастный препарат с концентрацией йода не менее 350 мг/мл. Объем вводимого контрастного препарата определяли исходя из массы тела пациента из расчета 1 мл на 1 кг массы. Сразу же после окончания внутривенного введения контрастного препарата со скоростью не менее 4 мл/с вводили физиологический раствор в объеме 50 мл.
 Первым этапом выполняли две сканограммы – ориентировочные сканирования во фронтальной и сагиттальной плоскостях, служащие для разметки будущего исследования. Вторым этапом осуществляли нативное исследование органов брюшной полости, малого таза и наружных половых органов. Третьим этапом выполнялось сканирование с внутривенным контрастированием с получением серий в артериальную, венозную и отсроченную фазы сканирования. Полученные в аксиальной плоскости изображения обрабатывали с построением мультипланарных и трехмерных реконструкций. Четвертым этапом проводили ОДММКЦ (см. таблицу). Данная часть обследования выполнялась в объемном динамическом режиме сканирования, без движения стола по отношению к детектору томографа, поэтому зона исследования ограничена шириной детектора томографа, т.е. 16 см. На сканограмме осуществляли разметку таким образом, чтобы в зону исследования попали наружные половые органы и мочевой пузырь. К этому времени мочевой пузырь наполняется контрастной мочой, выделяемой почками, поэтому дополнительных инвазивных процедур по введению контрастного препарата в мочевой пузырь не требуется. Обследование длится 10 с. По команде оператора пациент начинает мочиться в памперс.
Первым этапом выполняли две сканограммы – ориентировочные сканирования во фронтальной и сагиттальной плоскостях, служащие для разметки будущего исследования. Вторым этапом осуществляли нативное исследование органов брюшной полости, малого таза и наружных половых органов. Третьим этапом выполнялось сканирование с внутривенным контрастированием с получением серий в артериальную, венозную и отсроченную фазы сканирования. Полученные в аксиальной плоскости изображения обрабатывали с построением мультипланарных и трехмерных реконструкций. Четвертым этапом проводили ОДММКЦ (см. таблицу). Данная часть обследования выполнялась в объемном динамическом режиме сканирования, без движения стола по отношению к детектору томографа, поэтому зона исследования ограничена шириной детектора томографа, т.е. 16 см. На сканограмме осуществляли разметку таким образом, чтобы в зону исследования попали наружные половые органы и мочевой пузырь. К этому времени мочевой пузырь наполняется контрастной мочой, выделяемой почками, поэтому дополнительных инвазивных процедур по введению контрастного препарата в мочевой пузырь не требуется. Обследование длится 10 с. По команде оператора пациент начинает мочиться в памперс.
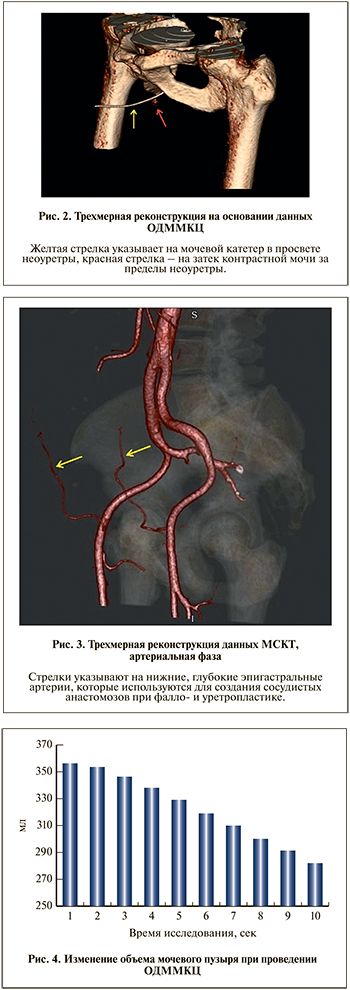 Далее проводили поэтапный анализ полученных изображений в мультипланарных (рис. 1), 3D- и 4D-реконструкциях (рис. 2). Измеряли ширину просвета уретры во всех отделах, выявляли зоны ее наибольшего сужения и их протяженность, оценивали состояние окружающих тканей в этих участках, степень раскрытия шейки мочевого пузыря во время микции, определяли объем мочевого пузыря и скорость потока мочи в различные фазы мочеиспускания, а также изучали сосудистую анатомию, в первую очередь нижних эпигастральных артерий, для планирования уретропластики с использованием свободного реваскуляризированного микрохирургического лучевого аутотрансплантата (рис. 3).
Далее проводили поэтапный анализ полученных изображений в мультипланарных (рис. 1), 3D- и 4D-реконструкциях (рис. 2). Измеряли ширину просвета уретры во всех отделах, выявляли зоны ее наибольшего сужения и их протяженность, оценивали состояние окружающих тканей в этих участках, степень раскрытия шейки мочевого пузыря во время микции, определяли объем мочевого пузыря и скорость потока мочи в различные фазы мочеиспускания, а также изучали сосудистую анатомию, в первую очередь нижних эпигастральных артерий, для планирования уретропластики с использованием свободного реваскуляризированного микрохирургического лучевого аутотрансплантата (рис. 3).
Результаты. При анализе полученных данных всех пациентов были установлены причина и локализация стриктуры уретры (см. рис. 1) или иной патологии (см. рис. 2).
Восемнадцати из двадцати двух обследованных была выполнена реконструкция фаллоса и уретры с использованием свободных реваскуляризированных микрохирургических аутотрансплантатов, остальным пациентам проведена только реконструкция уретры. После удаления мочевого катетера все пациенты мочились самостоятельно и не предъявляли жалоб, связанных с микцией. По результатам ОДММКЦ у всех обследованных был определен объем мочевого пузыря до начала и во время микции. Объем мочевого пузыря в среднем составил 356,3±179,9 мл, при этом фактический объем выделенной мочи во время микции равнялся 299,5±154,8 мл, что связано с остаточным объемом мочи в мочевом пузыре, составившим 57,0±25,1 мл (рис. 4). Данные результаты на до- и послеоперационных этапах не различались.
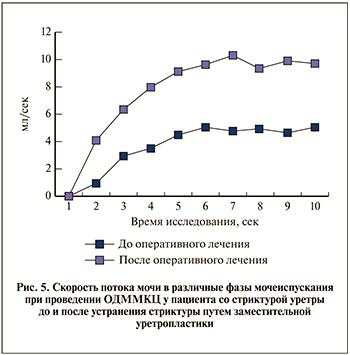
На основании показателей объема мочевого пузыря в процессе мочеиспускания рассчитана скорость потока мочи в каждую фазу динамического исследования (с 1-й по 10-ю секунду; рис. 5). Средняя скорость потока мочи при стриктурах уретры составила 4,1±1,1, после устранения стриктуры – 7,9±5,1 мл/с. Максимальная зафиксированная скорость составила 19 мл/с. Так как для снижения лучевой нагрузки на пациента протокол сканирования был ограничен 10 с, определить полное время мочеиспускания в настоящем исследовании не представлялось возможным.
После реконструкции уретры и/или полового члена с использованием свободного реваскуляризированного микрохирургического аутотрансплантата ни один пациент не предъявлял жалоб на нарушение процесса мочеиспускания: ни в одном случае не было выявлено зон сужения просвета уретры, а также отмечалось улучшение урофлуометрических показателей, полученных по результатам ОДММКЦ (см. рис. 5).
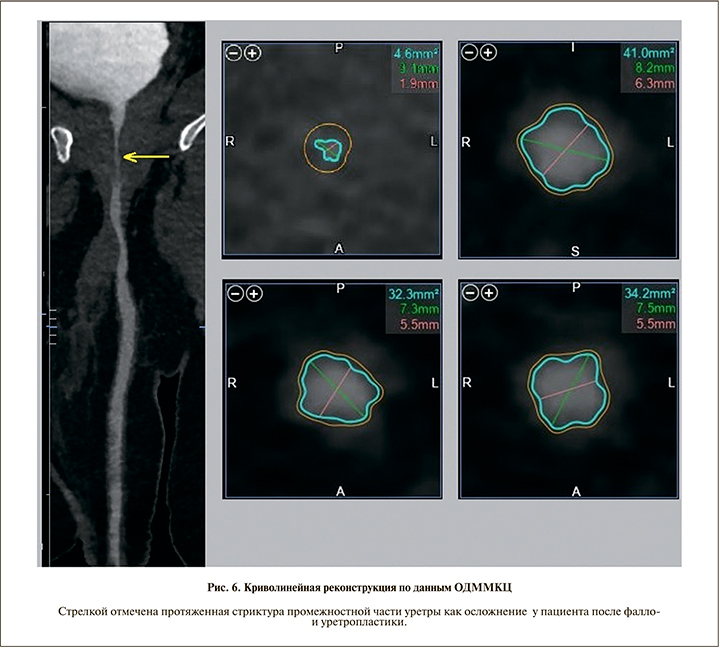
Все полученные изображения были обработаны на рабочей станции Vitrea с построением криволинейных реконструкций уретры и автоматическим определением ее диаметра во всех отделах (рис. 6). Средний диаметр уретры, по данным ОДММКЦ, после выполнения уретропластики составил 7,6±2,1 мм. Минимальная протяженность стриктур уретры составила 17, максимальная – 32 мм.
 Для всех обследованных пациентов была определена лучевая нагрузка, полученная при проведении ОДММКЦ, которая составила в среднем 7,9±4,1 мЗв. Данные значения сопоставимы, а для большинства пациентов были ниже, чем среднее значение индивидуальной эффективной дозы за процедуру рентгеноскопического исследования органов малого таза (микционная цистоуретроскопия или ретроградная уретроцистоскопия), по данным рекомендаций по обеспечению радиационной безопасности в среднем составившая 12 мЗв [15].
Для всех обследованных пациентов была определена лучевая нагрузка, полученная при проведении ОДММКЦ, которая составила в среднем 7,9±4,1 мЗв. Данные значения сопоставимы, а для большинства пациентов были ниже, чем среднее значение индивидуальной эффективной дозы за процедуру рентгеноскопического исследования органов малого таза (микционная цистоуретроскопия или ретроградная уретроцистоскопия), по данным рекомендаций по обеспечению радиационной безопасности в среднем составившая 12 мЗв [15].
Обсуждение. Современный стандарт обследования пациентов с заболеваниями урогенитальной области помимо рутинных методов урологического скрининга в качестве базового метода диагностики включает ретроградную уретрографию в сочетании с микционной цистоуретрографией [16–19].
Эта методика позволяет определять локализацию и протяженность стриктуры уретры, которая не всегда приводит к значимому нарушению уродинамики и может длительно протекать бессимптомно [20]. Несмотря на высокую чувствительность (75–100%) и специфичность (72–97 %), уретрография имеет два существенных недостатка. Во-первых, при стандартной косой укладке пациента в ¾ возникают проекционные искажения размеров уретры, что может стать причиной недооценки протяженности стриктуры, а следовательно, неверного выбора метода хирургического лечения. Во-вторых, ретроградная уретрография не дает представления о глубине и протяженности спонгиофиброза – важнейшего фактора в выборе лечебной тактики. Также следует отметить возможность различной интерпретации результатов уретрографии рентгенологами и урологами [3].
С середины 1980-х гг. популярность стала завоевывать соноуретрография, предложенная J. W. McAninch [24]. Чувствительность указанного метода диагностики уретральных стриктур колеблется в пределах 66–100%, специфичность – 97–98%. При правильном выполнении метод по информативности незначительно уступает традиционной уретрографии, при этом позволяет определять степень спонгиофиброза и избирать оптимальную тактику лечения [21–23].
К сожалению, точность определения протяженности стриктуры с помощью данной методики лимитирована 3–5 см [24]. При этом ретроградное вмешательство считается неприятной и болезненной процедурой. Предпочтительно проводить микционную соноуретрографию в режиме реального времени [25–26]. Также к недостаткам метода условно можно отнести то, что врач, проводящий исследование, должен обладать высокой квалификацией как в технике выполнения, так и в интерпретации полученных данных [27].
Преимуществом объемной динамической микционной цистоуретрографии служит возможность объективно оценивать характер изменений, лежащих в основе патологического процесса, в условиях, максимально приближенных к физиологическим, т.е. при мочеиспускании [28–30]. Преимуществом также является то, что контрастное вещество вводится внутривенно, через некоторое время мочевой пузырь в достаточной мере заполняется контрастной мочой, выделяемой почками.
Таким образом, в ходе одного исследования можно оценить анатомию брюшной полости малого таза, в том числе сосудистую, для дальнейшего планирования оперативного лечения и последующего проведения ОДММКЦ. Еще одним несомненным плюсом разработанной методики является возможность изучения скоростных показателей струи мочи в динамике, что позволяет делать выводы о сократительной способности мочевого пузыря.
К недостаткам метода относится необходимость мочиться в положении лежа, что в нашем исследовании не получилось в отношении трех пациентов. Данная методика не требует проведения традиционной эндоскопической уретроскопии, что чрезвычайно актуально в наше время, так как частота ятрогенного инфицирования мочевыводящих путей при эндоскопических манипуляциях по-прежнему достигает высоких значений (8–34%) [31]. Кроме этого объемная динамическая микционная цистоуретрография позволяет оценивать состояние парауретральной ткани и окружающих органов, что возможно сделать лишь с помощью некоторых инвазивных методик.
Заключение. ОДММКЦ, выполненная с использованием широкодетекторного компьютерного томографа, обладает отличным пространственным разрешением, широким диапазоном области сканирования и быстрой системой сбора данных с возможностью последующего построения 3D- и 4D-реконструкций интересующей области. Результаты анализа полученных данных позволяют с уверенностью утверждать, что МСКТ в сочетании с ОДММКЦ высокоинформативна в оценке состояния органов брюшной полости малого таза, а также уретры пациента. Возможность выявления послеоперационных осложнений (анатомических дефектов уретры, таких как стриктура, свищи, дивертикулы и т.д.) еще больше повышает ценность данного исследования. Важно подчеркнуть, что полученные данные отражают состояние уретры в динамике, т.е. во время мочеиспускания. Вышеописанный метод позволяет получать подробную информацию о топографо-анатомических особенностях мочеиспускательного канала, а также устанавливать локализацию и протяженность стриктуры, точно спланировать ход предстоящего оперативного пособия, что в свою очередь позволит улучшить результаты лечения. Доказанная эффективность разработанного метода дает основания говорить о перспективности его использования при обследовании пациентов с заболеваниями урогенитальной области.



