Актуальность. Мужской фактор диагностируется в половине случаев бесплодного брака [1, 2]. В настоящее время принято считать, что наиболее частой причиной мужского бесплодия (35–40% случаев) являются идиопатические олиго-, астено- и/или тератозооспермии [3–7]. При этом изменения в количественных и качественных показателях спермы наблюдаются в отсутствие анамнестических факторов риска, при нормальных данных медицинского осмотра и отсутствии отклонений в результатах эндокринных исследований.
Для улучшения качества спермы при идиопатическом бесплодии используются различные лекарственные препараты, наиболее часто – антиоксиданты, витамины, микроэлементы, карнитины, биофлавоноиды [3–13]. Несколько рандомизированных клинических исследований показали потенциал антиоксидантных добавок для лечения мужской субфертильности, связанной с оксидативным стрессом (ОС) [14–16]. По результатам мета-анализа [17], антиоксиданты улучшают жизнеспособность, концентрацию и прогрессивную подвижность, связывание с яйцеклеткой, фрагментацию ДНК сперматозоидов, повышают процент беременностей при естественном зачатии и в программах вспомогательных репродуктивных технологий. Однако, характеризуя качество включенных в анализ исследований, авторы обзора отмечают, что уровень доказательности при этом «низкий» и «очень низкий». На недавно прошедшем конгрессе EAU группа английских авторов [13] представили результаты систематического обзора публикаций, найденных в базах данных OVID MEDLINE, Pubmed и Embase, по применению различных пищевых добавок для лечения идиопатического мужского бесплодия. Отмечено, что только 17 из 1745 статей соответствовали критериям включения, т.е. представляли собой результат рандомизированных плацебо-контролируемых исследований. По мнению авторов, несмотря на то что есть данные об улучшении параметров спермы при использовании некоторых нутриентов (кoэнзим Q10, L-карнитин, витамин Е, омега-3, селен) и увеличении при этом частоты наступления беременностей на 3,4–21,2%, отсутствуют доказательства того, что это коррелирует с улучшением реальной рождаемости [13].
 Невысокая стоимость и относительно низкий риск токсичности антиоксидантов привлекательны для пациентов и врачей, поэтому с 2013 г. они рекомендованы EAU для лечения мужского бесплодия, но, как подчеркивается в последнем Руководстве EAU, «не для лечения идиопатических форм» [7]. Причина, очевидно, в том, что идиопатическое бесплодие далеко не всегда является следствием ОС: 30–80% случаев – по обобщенным данным M. Showell et al. [17], около 40% – по нашим данным [18]. В иных случаях применение антиоксидантов представляется малоперспективным.
Невысокая стоимость и относительно низкий риск токсичности антиоксидантов привлекательны для пациентов и врачей, поэтому с 2013 г. они рекомендованы EAU для лечения мужского бесплодия, но, как подчеркивается в последнем Руководстве EAU, «не для лечения идиопатических форм» [7]. Причина, очевидно, в том, что идиопатическое бесплодие далеко не всегда является следствием ОС: 30–80% случаев – по обобщенным данным M. Showell et al. [17], около 40% – по нашим данным [18]. В иных случаях применение антиоксидантов представляется малоперспективным.
Таким образом, показания и ожидаемая эффективность лечения мужского бесплодия антиоксидантами как в режиме монотерапии, так и при комбинированном использовании остаются не вполне ясными.
Цель исследования: установить предикторы эффективности лечения комплексом нутриентов.
Материалы и методы. Проведено открытое многоцентровое проспективное исследование, в которое были включены 102 мужчины из бесплодных пар в возрасте от 25 до 45 лет.
Критерии включения в исследование:
- отсутствие беременности в браке более 12 мес. половой жизни без контрацепции;
- наличие сперматозоидов в эякуляте;
- идиопатическая астенотератозооспермия;
- отсутствие инфекций репродуктивного тракта (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis), диагностированных методом полимеразной цепной реакции;
- отсутствие клинических и лабораторных признаков воспалительного процесса дополнительных половых желез;
- отсутствие выраженных аутоиммунных реакций против сперматозоидов, когда антиспермальные антитела (АСАТ) покрывают не более десятой части подвижных гамет (MAR IgG <10%);
- отсутствие пальпируемого варикоцеле;
- отсутствие выраженной соматической патологии;
- отсутствие психосексуальной и эякуляторной дисфункции.
Все мужчины, включенные в исследование, дали свое информированное согласие.
Обследование мужчин проведено на базе амбулаторных подразделений специализированных клиник уроандрологического и гинекологического профиля, где работают авторы, в соответствии с рекомендациями ВОЗ [1, 2].
Исследование эякулята проведено в соответствии с требованиями ВОЗ (2010): определяли концентрацию, подвижность и долю нормальных форм, вычисляли количество прогрессивно-подвижных сперматозоидов в эякуляте (произведение объема эякулята х концентрацию сперматозоидов х долю прогрессивно подвижных форм). Методом смешанной реакции агглютинации определяли процент подвижных сперматозоидов, покрытых АСАТ (SpermMar Kit, FertiPro, Бельгия).
Оксидативный стресс характеризовали, оценивая продукцию активных форм кислорода (АФК) методом люминол-зависимой хемилюминесценции с помощью хемилюминометров LKB-Wallac 1256 (Финляндия), Chemiluminometer-003 «UGATU» (Россия). Об интенсивности хемилюминесценции судили по светосумме и максимальной амплитуде свечения, которые соответствовали скорости образования АФК. Определяли АФК в нативном эякуляте и отмытых сперматозоидах в соответствии с протоколом, описанным A. Agarwal и F. Deepinder [19] и в Руководстве ВОЗ [2].
Все пациенты получали отечественный биологически активный комплекс (БАД) «АндроДоз». В суточной дозировке (4 капсулы по 410 мг) содержатся L-аргинин (720 мг), L-карнитин (240 мг), L-карнозин (92 мг), коэнзим Q10 (10 мг), глицирризиновая кислота (6 мг), цинк (4,8 мг), витамин Е (3,2 мг), витамин А (0,36 мг), селен (0,034 мг), что составляет для данных веществ от 12 до 80% рекомендуемого уровня суточного потребления.
 Эякулят оценивали до и через 3–3,5 мес. лечения.
Эякулят оценивали до и через 3–3,5 мес. лечения.
Обработку эмпирических данных провели с использованием программы STATISTICA («StatSoft», США). Средние значения по группам представляли в виде M±SD, медианы, 25-го и 75-го процентилей, диапазона «невыпадающих значений». На графиках Box-and-whisker «выпадающими» являлись точки, которые находятся далеко от центра распределения и не характерны для него (возможно, являются результатом ошибок наблюдения или выбросами). Они определены следующим образом: значения больше чем верхняя граница «ящика»+коэффициент*(верхняя граница «ящика»–нижняя граница «ящика»); значения меньше, чем нижняя граница «ящика»–коэффициент* (верхняя граница «ящика»–нижняя граница «ящика») с коэффициентом 1. «Экстремумы» опредеены так же, но в формуле коэффициент умножается на 2.
По соответствующему алгоритму «STATISTICA» для связанных выборок на основании M, SD и R вычислен стандартизованный эффект (Es) для каждого исследуемого параметра в сравниваемых группах. При величине Es от 0,2 до 0,49 эффект считали слабым, от 0,5 до 0,79 – средним и от 0,8 и более – выраженным. По номограмме на основании значений Es и принятого минимального уровня значимости 0,05 вычисляли полученную статистическую мощность (чувствительность) для каждого из основных показателей спермограммы. Достаточной считали мощность исследования на уровне 80% (0,8).
Значимость различий между группами проверяли с помощью критериев Стьюдента (t), Манна–Уитни (m-w), знаков (z), χ2 и Вилкоксона (w); различия считали статистически значимыми при p<0,05.
Результаты. Средний возраст пациентов составил 33,5±5,5 года. Первичным бесплодие было в 57% случаев, длительность бесплодия составляла в среднем 49,4±39,5 мес.
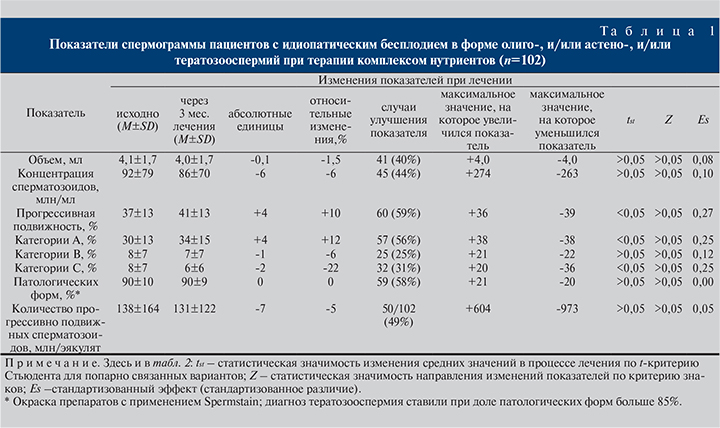
Через 3 мес. лечения (табл. 1) доля прогрессивно подвижных сперматозидов увеличилась в среднем по группе на 4% (+10% относительно исходных значений; р<0,05) за счет увеличения доли быстроподвижных сперматозоидов (категория А) на 4% (+12% в относительных; р<0,05) и уменьшения доли сперматозоидов с непоступательным движением (-2% и 22% соответственно; р<0,05). Увеличение процента прогрессивно подвижных сперматозоидов имело место только у 59% пациентов (р>0,05). Наблюдаемый эффект оказался статистически слабым: Es=0,27 для процента прогрессивно подвижных сперматозоидов и 0,25 – для подвижных категории А.
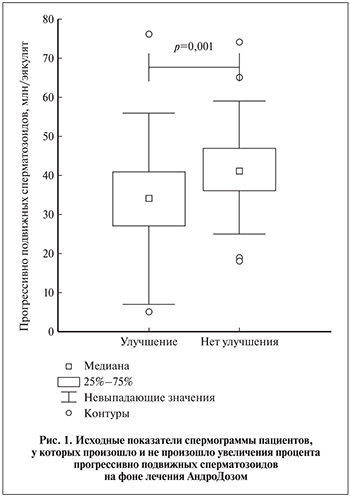
Ретроспективное сравнение показателей спермограммы до лечения показало, что у пациентов с дальнейшим улучшением общее количество прогрессивно подвижных сперматозоидов было исходно более низким, чем у пациентов без улучшения (р=0,001; рис. 1). Однако доверительные интервалы обеих подгрупп с улучшением и без улучшения более чем наполовину перекрывались, что затрудняет определение «точки раздела» и делает невозможным предсказание эффекта в каждом конкретном случае.
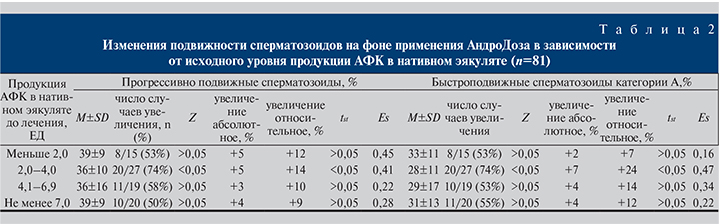
Улучшение подвижности на фоне лечения фазно зависело от содержания в сперме АФК (табл. 2). Статистически значимое увеличение подвижности имело место в подгруппе пациентов с умеренным повышением продукции АФК в нативной сперме (2–4 ЕД): +5% прогрессивно подвижных сперматозоидов (p<0,05) и +7% (p<0,05) для подвижных сперматозоидов категории А; для обеих категорий подвижности улучшение имело место в 74% случаев (p<0,05).
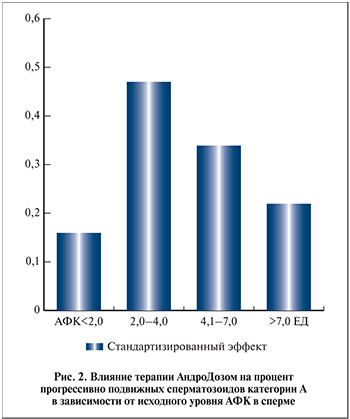
В подгруппе с меньшим уровнем АФК (<2 ЕД) увеличение прогрессивной подвижности имело место в 53% случаев и различия средних были статистически не значимыми (р>0,05). Аналогично изменения средних и доля пациентов с улучшением не были статистически значимыми и в подгруппах с существенно повышенными уровнями АФК (р>0,05). Стандартизованное различие (Es) для подвижных сперматозоидов категории А составило: 0,16 для подгруппы с АФК <2 ЕД, 0,47 при АФК 2–4 ЕД, 0,34 при АФК 4–7 ЕД и 0,22 при АФК >7 ЕД (рис. 2). На основании представленных данных можно заключить, что при низких уровнях АФК эффект лечения, оцениваемый по изменению процента подвижных сперматозоидов категории А, фактически отсутствовал, а в группах с повышенным уровнем АФК был слабым.
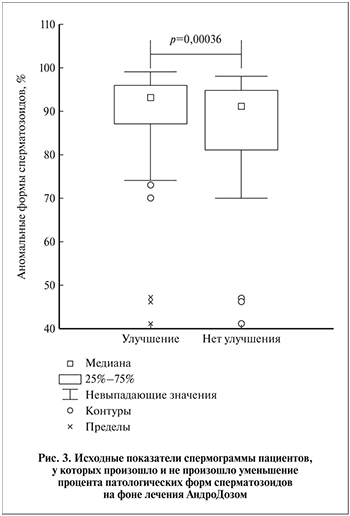
Изменения объема эякулята, концентрации и морфологии сперматозоидов в среднем по группе были статистически не значимыми (р>0,05; табл. 1). Но уменьшение процента патологических форм имело место при исходно более выраженной тератозооспермии (рис. 3).
 Обсуждение. Эффективность эмпирического лечения по поводу идиопатического мужского бесплодия по-прежнему спорный вопрос [3–11].
Обсуждение. Эффективность эмпирического лечения по поводу идиопатического мужского бесплодия по-прежнему спорный вопрос [3–11].
В нашем исследовании поставлена задача оценить эффективность коммерчески выпускаемых комплексов нутриентов для лечения идиопатической астено-, и/или тератозооспермии и установить предикторы эффективности подобного лечения. Для этой цели был использована отечественная БАД «АндроДоз», содержащая в суточной дозировке (4 капсулы по 410 мг): L-аргинин (720 мг), L-карнитин (240 мг), L-карнозин (92 мг), коэнзим Q10 (10 мг), глицирризиновая кислота (6 мг), цинк (4,8 мг), витамин Е (3,2 мг), витамин А (0,36 мг), селен (0,034 мг), что составляет от 12 до 80% рекомендуемого уровня суточного потребления для данных веществ.
Установлено, что в течение 3-месячного приема данного комплекса нутриентов в среднем по группе (n=102) отмечено статистически значимое увеличение доли прогрессивно подвижных сперматозоидов за счет увеличения доли быстро подвижных сперматозоидов (категория А) и уменьшения – с непоступательным движением (категория С). Положительная динамика подвижности имела место примерно в 60% случаев и чаще наблюдалась при исходно более низкой доле прогрессивно подвижных форм. Следовательно, данный комплекс может применяться для лечения идиопатической астенозооспермии.
В нашем исследовании не выявлено увеличения концентрации и улучшения морфологии сперматозоидов на фоне лечения в целом по группе, однако уменьшение процента патологических форм имело место при исходно более выраженной тератозооспермии (рис. 3). Это дает основание применять данную БАД и при тератозооспермии.
В то же время наши данные показали, что, несмотря на установленные статистически значимые изменения некоторых показателей спермограммы, результат лечения весьма слабый: стандартизованный эффект (стандартизованное различие) составляет всего 0,27 для процента прогрессивно подвижных сперматозоидов, 0,25 для подвижных сперматозоидов категории А и меньше 0,2 для других показателей спермограммы. В абсолютных значениях в среднем по группе доля прогрессивно подвижных сперматозоидов через 3 мес. лечения выросла всего на 4%. При этом ни один из стандартных показателей спермограммы ни по отдельности, ни в комплексе не обладал значимой предсказательной способностью. В настоящем исследовании на основании стандартной спермограммы нельзя было определить, будет ли происходить улучшение качества спермы в процессе лечении, или нет. Какие-либо позитивные изменения спермограммы имели место в 60% случаев.
Значимым предиктором эффективности применения «АндроДоз» для лечения идиопатической астенотератозооспермии, по нашим данным, явился уровень продукции АФК в нативной сперме. Наиболее заметный эффект лечения имел место при умеренно повышенных уровнях АФК, несколько меньший – при существенно повышенных и минимальный – при низких значениях (табл. 2). Стандартизованный эффект с ростом АФК для подвижных сперматозоидов категории А составил 0,16; 0,47; 0,34 и 0,22 соответственно, т.е. отличался для разных групп до 3 раз, но во всех случаях был слабым.
Данные закономерности вполне соответствуют нашему пониманию влияния таких комплексов нутриентов на мужскую фертильность. L-аргинин, L-карнитин, L-карнозин, коэнзим Q10, глицирризиновая кислота, цинк, селен, витамины Е и А – компоненты БАД «АндроДоз» – в первую очередь являются общеизвестными антиоксидантами. Антиоксиданты препятствуют индуцированному свободными радикалами повреждению клеток путем предотвращения их образования, химического связывания или содействуют их разложению в организме [18–20]. Причем, по мнению E. G. Hughes et al. [22], комбинация антиоксидантов более эффективна. В то же время, как отмечают авторы мета-анализа [17], «антиоксиданты, возможно, могли быть эффективными в лечении субфертильных мужчин, но представление результатов исследований было слишком непоследовательным, чтобы быть уверенными в этих результатах» [17]. О явно недостаточной эффективности применения БАДов, предлагаемых различными фармфирмами, свидетельствуют данные рандомизированных и контролируемых исследований: улучшение подвижности сперматозоидов зафиксировано только в половине (3 из 6) подобных исследований [23–25], концентрация увеличилась только в 1 из 6 [26]. Плацебо-контролируемые исследования еще менее оптимистичны. В частности, сочетание витаминов С и Е при астенозооспермии не улучшило параметров спермы и 24-часовую выживаемость сперматозоидов [27]. Прием комплекса «FertilAid for men», содержащего набор витаминов и минералов-антиоксидантов, сопровождался увеличением общего числа подвижных сперматозоидов, причем с минимальным уровнем доказательности, но улучшения в количестве и морфологии сперматозоидов достигнуто не было [28], что полностью соответствует результатам нашей работы. Другой аналогичный комплекс «Menevit» повысил частоту наступивших беременностей после экстракорпорального оплодотворения интрацитоплазматической иньекцией сперматозоидода, но только в случае ОС и фрагментации ДНК, причем качество эмбрионов при этом не улучшилось [29]. Более оптимистичные результаты были недавно получены при использовании комплекса витаминов-антиоксидантов и высоких доз карнитинов: препарат «Proxeed Plus» улучшал прогрессивную подвижность в многоцентровом двойном слепом плацебо-контролируемом исследовании, проведенном в Сербии, Нидерландах и США [12]. В другой работе авторы отметили, что наблюдаемое повышение прогрессивной подвижности коррелировало с уровнем спермальных карнитинов [30]. Однако, по другим данным, «Proxeed Plus» улучшал общее количество подвижных сперматозоидов только у пациентов с повышенным базовым уровнем АФК [31], что полностью соответствует нашим данным.
Неэффективность комплекса нутриентов при низких, т.е. нормальных, уровнях АФК объяснима: в этом случае патогенетическим механизмом снижения фертильности является не ОС, который может быть скорригирован антиоксидантами. Но почему препарат слабо помогает при существенно повышенных уровнях АФК? Возможным объяснением является то, что в нашей выборке значительную долю (больше 80%) составляли пациенты с тератозооспермией, а в ряде исследований [32, 33] было показано, что в большинстве случаев тератозооспермия, ранее диагностированная как идиопатическая, на самом деле является следствием имеющихся генетических дефектов. При наличии генетических дефектов метаболическая терапия может оказаться явно недостаточной, а ОС – не причина, а сопутствующий диагноз или даже следствие генетически детерминированного апоптоза мужских гамет.
Следует отметить, что полученные нами данные хорошо согласуются с результатами описанных выше зарубежных исследований, но гораздо менее оптимистичны, чем выводы отечественных исследователей по применению различных БАДов, в т.ч. «АндроДоза». Согласно многоцентровым исследованиям, выполненным несколько лет назад под руководством А. А. Камалова, улучшение показателей спермограммы при назначении «АндроДоза» происходило в 87,6% наблюдений [34], что ближе всего к результатам, полученным нами позже и представленным в этой статье. Однако выполненное тогда исследование основано на небольшой выборке пациентов, что может объяснить имеющиеся различия. М. Алчинбаев и соавт. [35] пишут о положительном эффекте лечения «АндроДозом» в 92% случаев, Е. Дендеберов и И. Виноградов [36] указывают, что применение «АндроДоза» через 3 мес. привело к увеличению объема эякулята на 45,7%, концентрации сперматозоидов на 18,5%, общей подвижности на 33,7%, активной подвижности на 38,4% и количества морфологически нормальных форм на 50% [36]. Данные А. Проскурина и соавт. [37] еще более оптимистичны: увеличение объема в 1,95 раза, подвижности в 7,43, концентрации в 1,53 и процента нормальных форм в 6,75 (?!) раза от исходных значений. Мы допускаем, что на результаты лечения в этих случаях могли оказать влияние некие, неясные из публикаций, факторы: иные критерии включения/невключения, различия нозологии, периоды наблюдения, неточности статистического анализа и другие объективные и субъективные факторы. Но в любом случае, данные последних работ вызывают большие сомнения: на сегодняшний день не существует способов лечения, способных увеличить долю нормальных форм на 50–675% [3–9].
Представленные результаты пока не позволяют делать какие-либо окончательные выводы, поскольку, несмотря на, казалось бы, достаточную выборку (n=102), статистическая мощность выполненного исследования оказалась весьма низкой (0,4). Для минимально необходимой рекомендуемой мощности в 80% (0,8) и минимального уровня значимости в 0,05 при максимально достигнутой в нашем исследовании Es=0,27 необходимый объем выборки должен составить не менее 350 человек; для подгруппы с умеренными уровнями АФК, наиболее чувствительной к подобной терапии, объем выборки должен составлять 130 человек.
Кроме того, исследование являлось открытым и неконтролируемым, период наблюдения составил всего 3–3,5 мес. и данные о беременностях получены не были, что существенно снижает его научную значимость.
Тем не менее проведенная работа позволяет сформулировать несколько предварительных выводов, поскольку уточняет показания к терапии нутриентами мужского идиопатического бесплодия в форме астено-, и/или тератозооспермий.
Выводы
- Комплекс нутриентов в суточной дозе L-аргинин – 720 мг, L-карнитин – 240 мг, L-карнозин – 92 мг, коэнзим Q10 – 10 мг, глицирризиновая кислота – 6 мг, цинк – 4,8 мг, витамин Е – 3,2 мг, витамин А – 0,36 мг, селен – 0,034 мг (БАД «АндроДоз») через 3 мес. лечения повышает процент прогрессиво подвижных сперматозоидов и подвижных категории А у 59% мужчин с идиопатическим бесплодием в форме астено- и/или тератозооспермии в среднем на 4%; концентрация и морфология сперматозоидов при этом значимо не меняются.
- Улучшение чаще наблюдается при сниженной подвижности и выраженной тератозооспермии, но показатели спермограммы не обладают предсказательной способностью.
- Улучшение подвижности сперматозоидов на фоне лечения фазно зависит от уровня ОС и наиболее значимо при умеренно повышенных уровнях АФК; стандартизованный эффект с ростом АФК для подвижных сперматозоидов категории А составил 0,16; 0,47; 0,34 и 0,22 соответственно (т.е. отличался при разных уровнях АФК до 3 раз), но при этом во всех случаях остается статистически слабым.
- Требуется продолжение контролируемых исследований большей статистической мощности.



