Введение. Согласно актуальным рекомендациям Российского общества урологов, мультипараметрическая магнитно-резонансная (мпМР)/ультразвуковая (УЗ) фьюжн биопсия показана только пациентам с отрицательной первичной биопсией в анамнезе [1]. Европейская ассоциация урологов (EAU) с 2019 г. рекомендует предварительное проведение мпМРТ перед биопсией всем пациентам с подозрением на рак простаты [2]. Как следствие – разработан так называемый MRI pathway, подразумевающий выполнение мпМРТ перед МР-прицельной биопсией [3]. Данный подход на треть снижает [4] количество первичных биопсий и гипердиагностику клинически незначимого ISUP1 (International Society of Uropatologists) рака простаты [5]. При обнаружении подозрительного очага PI-RADS (Prostate Imaging Reporting and Data System) ≥3 баллов прицельная биопсия под МР-контролем может проводиться тремя методами: 1) «in-bore» (биопсия выполняется непосредственно в МР-томографе в режиме реального времени); 2) мпМР/УЗ фьюжн биопсия; 3) когнитивная биопсия.
В ряде исследований доказана сопоставимая выявляемость клинически значимого рака простаты (ISUP ≥2) у пациентов, которым МР-прицельная биопсия выполняется впервые. Так, в отношении первичной биопсии Zhang et al. описывают сравнимые результаты выявляемости клинически значимого рака при когнитивной и «in-bore»-биопсии (23,5 и 29,5%; p=0,371) [6]. В исследовании PAIREDCAP не наблюдается различий в выявляемости клинически значимого рака между мпМР/УЗ фьюжн и когнитивной биопсиями (38,1 и 33,3%; p=0,08) [7]. Аналогичные результаты для повторной биопсии представлены в исследовании FUTURE: не обнаружено разницы в выявлении клинически значимого рака при «in-bore», мпМР/УЗ фьюжн и когнитивной биопсиях (33,0%, 43,0 и 33,0% соответственно; p>0,9) [8]. Тем не менее «in-bore»-биопсия не получила широкого распространения в клинической практике ввиду ее продолжительности (в среднем 35–55 мин) и необходимости в дополнительном оборудовании [9]. В связи с этим мпМР/УЗ фьюжн и когнитивная биопсии остаются более предпочтительными методами МР-прицельной биопсии. мпМР/УЗ фьюжн и когнитивную биопсии возможно выполнять как трансперинеально, так и трансректально. Выявляемость клинически значимого рака при выполнении МР-прицельных биопсий не зависит от доступа (65,7 и 75,5%: p=0,40) [10]. Однако EAU отдает предпочтение трансперинеальному доступу ввиду более низкого риска инфекционных осложнений [11]. Следует отметить, что риск инфекционных осложнений статистически значимо не различается между трансперинеальной и трансректальной МР-прицельной биопсией (p=0,46) [12]. Таким образом, с учетом сопоставимых данных выявляемости клинически значимого рака простаты, низкого профиля осложнений, а также большой доступности трансректальная когнитивная биопсия, возможно, является наиболее предпочтительным методом МР-прицельной биопсии.
Цель исследования – сравнение выявляемости клинически значимого рака простаты при выполнении трансперинеальной мпМР/УЗ фьюжн и трансректальной когнитивной биопсий.
Материалы и методы. Проспективное исследование проводилось с октября 2020 по январь 2022 г. в Институте урологии и репродуктивного здоровья человека Сеченовского Университета. Критерии включения: повышение ПСА >2 нг/мл и/или наличие подозрительного очага при пальцевом ректальном исследовании (ПРИ) и/или при трансректальном ультразвуковом исследовании (ТРУЗИ) и PI-RADSv2.1 ≥ 3 по результатам мпМРТ. Критерии исключения: ранее выявленный рак простаты; острые воспалительные заболевания простаты за последние 3 мес.; терапия по поводу гиперплазии простаты (ингибиторы 5-α редуктазы) за последние 6 мес.; экстракапсулярное распространение; предстательная железа большого объема (≥80 см3); противопоказания к проведению мпМРТ.
Расчет размера выборки, необходимой для получения статистически достоверных данных о сравнении выявляемости клинически значимого рака (ISUP ≥2) между мпМР/ УЗ фьюжн и когнитивной биопсиями, осуществлялся при помощи 10%-ного критерия non-inferiority. Принимая во внимание данные литературы, частота выявления клинически значимого рака ISUP ≥2 в среднем составляет 35% для мпМР/УЗ фьюжн биопсии и 30% для когнитивной биопсии. Таким образом, необходимая выборка включает 96 пациентов.
Первичная конечная точка – выявляемость клинически значимого рака простаты (ISUP ≥2). Вторичные конечные точки – общая выявляемость рака простаты, выявляемость клинически незначимого рака простаты, гистологическая эффективность (количество положительных биоптатов, площадь поражения каждого биоптата) и количество недиагностированного клинически значимого рака простаты.
Всем пациентам перед биопсией проведены ТРУЗИ (Flex Focus 500, внутриполостной биплановый датчик, 12-4 МГц) простаты и мпМРТ (Siemens Magneton Skyra 3T, протокол – Т2-взвешенное изображение (Т2ВИ), диффузно-взвешенное изображение (ДВИ), измеряемый коэффициент диффузии (ИКД) – карта, Т1-взвешенное изображение (Т1ВИ), динамическое контрастное усиление [ДКУ]). Изменения предстательной железы оценивались по системе PI-RADS v2.1 [13]. Процедура забора гистологического материала выполнена в течение 1 дня в несколько этапов. Первым этапом «расслепленный» уролог выполняет трансперинеальную мпМР/УЗ фьюжн и сатурационную биопсии (>20 биоптатов). Далее «ослепленный» уролог выполняет трансректальную когнитивную биопсию. Сатурационная биопсия являлась референсным тестом для оценки МР-прицельных методов биопсии простаты. Биоптаты, полученные в процессе каждого из видов биопсий, помещаются отдельно друг от друга. Исследование одобрено локальным этическим комитетом (ЛЭК) Сеченовского Университета (протокол № 28–20 от 07.10.2020). Все пациенты подписывают форму информированного добровольного согласия на участие в исследовании.
Анализ данных выполнен с использованием статистической программы SPSS v.23.0 (IBM Corp., Armonk, NY, USA). Исследование проведено в связанных выборках. Сравнение категориальных переменных осуществлено с использованием критерия χ2 и критерия МакНемара, а непрерывных переменных – с помощью критерия Уилкоксона. Статистически значимая величина p<0,05. Результаты исследования представлены согласно START-критериям [14].
Результаты. В исследование включены 96 пациентов. Из них 68 (72,0%) выполнена первичная биопсия, 27 (28,0%) – повторная. Медиана возраста – 63 года (IQR 59; 86), объема простаты – 47 см3 (IQR 39; 63), ПСА – 6,82 нг/мл (IQR 5,2; 9,5), плотности ПСА – 0,13 нг/мл/см3 (IQR 0,1; 0,2). Семейный анамнез по раку простаты отягощен у 7 (7,3%) пациентов; подозрительный очаг по результатам ПРИ выявлен у 16 (19,8%) . Общая характеристика пациентов представлена в табл. 1.

При сравнении мпМР/УЗ фьюжн и когнитивной биопсий не обнаружено статистически достоверных различий в отношении выявляемости клинически значимого (ISUP≥2; 32,3 и 25,0% соответственно; p=0,264) и клинически незначимого рака простаты (ISUP 1; 25,0 и 26,0%; p=0,869). Общая выявляемость рака простаты при выполнении мпМР/УЗ фьюжн и когнитивной биопсиями также сопоставима (57,3 и 51,0%; p=0,385).
Не обнаружено убедительных данных в отношении гистологической эффективности между мпМР/УЗ фьюжн и когнитивной биопсией: количество положительных биоптатов – 34,1 и 31,1% соответственно (p=0,415). Одновременно с этим не обнаружено статистически значимой разницы в отношении площади поражения образцов (53,1 и 47,7%; p=0,387). Также не обнаружено статистической разницы в объеме недиагностированного клинически значимого рака (5,2 и 5,2%; p=0,839). После получения результатов обоих методов МР-прицельной биопсии простаты радикальная простатэктомия выполнена 20 пациентам. Верное определение суммы баллов по Глисону между мпМР/УЗ фьюжн и когнитивной биопсией статистически значимо не различается (p=0,851) при сравнении с результатами гистологического исследования после простатэктомии (табл. 2).
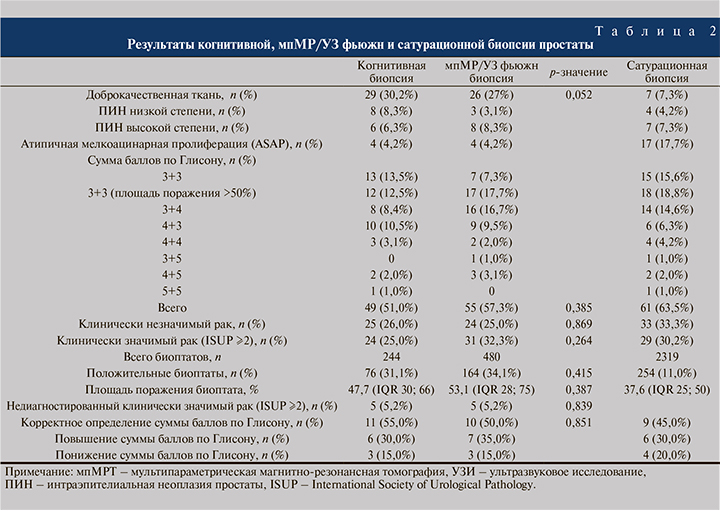
Обсуждение. Выявляемость клинически значимого, клинически незначимого рака простаты (ISUP≥2), как и общая выявляемость, сопоставимы между биопсиями. В отношении гистологической эффективности также не обнаружено статистически значимой разницы между видами биопсии.
Предположительно при выполнении мпМР/УЗ фьюжн биопсии возможно более точно попасть в подозрительный очаг, нежели при выполнении когнитивной биопсии. Stabile et al. демонстрируют более высокую вероятность выявления клинически значимого рака (ISUP≥2) в отношении мпМР/ УЗ фьюжн биопсии по сравнению с когнитивной биопсией (57,0 и 36,0% соответственно; p=0,002) [15]. Однако в ряде исследований продемонстрированы сравнимые результаты выявляемости клинически значимого рака простаты. Например, Kaufmann et al. отмечают бóльшую общую выявляемость рака простаты в отношении трансректальной мпМР/УЗ фьюжн биопсии по сравнению с трансперинеальной когнитивной (52,42 и 28,95; p=0,04) биопсией, но при этом они отмечают сопоставимую выявляемость клинически значимого рака (35,62 и 23,68%; p=0,27) [16]. В свою очередь Oberlin et al. не обнаруживают статистически существенной разницы в выявляемости клинически значимого рака (ISUP≥2) между трансректальной мпМР/УЗ фьюжн и трансректальной когнитивной биопсиями (48,0 и 61,5% соответственно; p=0,07) [17]. Сравнимые результаты выявляемости клинически значимого рака подтверждаются и в мета-анализе Watts et al. (35,1 и 34,2% соответственно; p=0,32) [18]. Кроме того, трансперинеальная мпМР/УЗ фьюжн и трансперинеальная когнитивная биопсии характеризуются сопоставимой выявляемостью клинически незначимого рака (ISUP 1) (6,0 и 8,0% соответственно; p<0,001) [19]. Однако в исследовании Oderda et al. обнаружена бóльшая выявляемость клинически незначимого рака при выполнении мпМР/УЗ фьюжн биопсии по сравнению с когнитивной биопсией (48,1 и 0% соответственно; p=0,0001) [20]. Существенная разница в представленных результатах может объясняться малой выборкой пациентов. В ряде работ, вошедших в мета-анализ Watts et al., продемонстрирована сопоставимая общая выявляемость рака простаты между мпМР/УЗ фьюжн и когнитивной биопсией (53,4 и 49,1%; p=0,3) [18]. Кроме того, есть данные, свидетельствующие о более высокой общей выявляемости рака простаты при помощи мпМР/УЗ фьюжн биопсии по сравнению с когнитивной [17, 21]. Однако в этих работах не продемонстрировано различий в выявляемости клинически значимого рака. Бóльшая общая выявляемость рака простаты в группе мпМР/УЗ фьюжн, вероятнее всего, связана с выявляемостью клинически незначимого рака.
Риск пропустить клинически значимый рак, как правило, сопоставим между когнитивной и мпМР/УЗ фьюжн биопсиями. Например, в исследовании Monda et al. когнитивная биопсия пропускает до 10% клинически значимого рака, а мпМР/УЗ фьюжн биопсия до 5,5% (p=0,172) [22]. В свою очередь Valerio et al. показывают, что когнитивная биопсия не выявляет 20% клинически значимого рака, а мпМР/УЗ фьюжн биопсия – 16%. В случае когда оба вида биопсии выполняются последовательно, вероятность пропустить клинически значимый рак снижается до 8% [19]. EAU рекомендует совмещать МР-прицельную биопсию со стандартной из 12 точек или сатурационной биопсией c целью снижения количества недиагностированного клинически значимого рака простаты [11]. МР-прицельная биопсия не диагностирует клинически значимый рак преимущественно из-за неточной интерпретации данных МРТ, как следствие – недостаточной сегментации железы на МР-снимках и неточной регистрации пораженного участка непосредственно во время мпМР/УЗ фьюжн биопсии [23]. В случае с когнитивной биопсией значительную роль в пропуске клинически значимого рака играет опыт хирурга. Опытный врач (стаж от 15 лет) обнаружит раковый очаг в 86,1% случаев, в то время как молодой специалист (стаж от 2 лет) – в 69,4% [24]. В исследовании Stabile et al. выявляемость клинически значимого рака хирургом увеличилась вдвое (с 30,0 до 57,0%) после выполнения 60 когнитивных биопсий [15]. Так как хирург при проведении когнитивной биопсии ориентируется только на УЗ-изображение, он с большей вероятностью может пропустить небольшие очаги. Oderda et al. демонстрируют растущую общую выявляемость рака простаты в зависимости от размера очага на МР-изображении: <7 мм – 14,3%, 7–10 мм – 28,5%, >10 мм – 41,6% [20]. Что касается когнитивной биопсии, корреляции между выявляемостью клинически значимого рака и размером очага не показано [10].
МР-прицельные виды биопсий характеризуются сравнимой гистологической эффективностью. В упомянутом исследовании FUTURE количество обнаруженных положительных биоптатов не различается между видами биопсий (31,3 и 33,3% соответственно) [8]. Valerio et al. обращают внимание на сопоставимую максимальную длину пораженного участка между мпМР/УЗ фьюжн и когнитивной биопсиями (6 мм [IQR 4;8] и 5,5 мм [IQR 3;8] соответственно; p=0,78) [19]. При этом соотношение общего количества биоптатов к биоптатам с клинически значимым раком больше для когнитивной биопсии по сравнению с мпМР/УЗ фьюжн (3,6 и 2,8 соответственно; p<0,001).
Как трансректальный, так и трансперинеальный доступ – допустимые варианты проведения МР-прицельной биопсии. Трансперинеальная мпМР/УЗ по сравнению с трансректальной биопсией позволяет с большей вероятностью обнаружить клинически значимый рак простаты (ISUP≥2) из передних отделов железы (86,7 и 46,7% соответственно; p=0,0001) [25]. Впрочем, в мета-анализе Loy et al. не обнаружено преимуществ в выявляемости клинически значимого рака между трансректальной и трансперинеальной мпМР/ УЗ фьюжн биопсией [26]. При обзоре литературы не найдено данных по сравнению трансректальной и трансперинеальной когнитивной биопсии в отношении выявляемости клинически значимого рака простаты.
Данное исследование не лишено ограничений. Каждая предшествовавшая биопсия могла влиять на результаты последующих. С целью уменьшить это воздействие биопсии выполнялось двумя хирургами. «Ослепленный» хирург проводил когнитивную биопсию уже после мпМР/УЗ фьюжн и сатурационной биопсий, благодаря чему не мог видеть, откуда взяты прицельные биоптаты. Таким образом, воздействие предшествовавших биопсий на последующие минимизировано. Еще одним ограничением исследования можно считать малую выборку пациентов, подвергшихся простатэктомии для сравнения результатов предоперационной биопсии с гистологическим заключением после операции. Тем не менее оно несло дополнительную ценность.
Заключение. Выявляемость клинически значимого, клинически незначимого рака простаты, как и общая выявляемость при сравнении когнитивной и мпМР/УЗ фьюжн биопсии сопоставимы. Гистологическая эффективность одинакова между видами МР-прицельной биопсии. Полученные результаты свидетельствуют о том, что как когнитивная, так и мпМР/УЗ фьюжн биопсия являются точным методом диагностики клинически значимого рака простаты, в связи с чем необходимо их более широкое внедрение в клиническую практику.



