Одним из основных критериев, определяющих выбор хирургического метода лечения доброкачественной гиперплазии предстательной железы (ДГПЖ), является объем гиперплазированной ткани. В клинической практике малым считается объем простаты от 30 до 40 см3, средним – от 40 до 80 см3, крупным – более 80 см3, гигантским – превышающий 250 см3 [1, 2]. В соответствии с отечественными и европейскими рекомендациями хирургическим стандартом при крупных размерах ДГПЖ остается открытая операция или равноценная ей по эффективности трансуретральная энуклеация гольмиевым или тулиевым лазером [1–4]. Применение трансуретральной резекции простаты и ее модификаций, включая биполярную технику их выполнения, из-за недостаточной доказательной базы пока ограничено средним размером гиперплазии железы [4, 5].
Вместе с тем за последние несколько лет научный архив значимо пополнился результатами исследований эффективности биполярной или, чаще называемой в последнее время, плазменной трансуретральной энуклеации (ПТУЭП) по сравнению с травматичными открытыми вмешательствами при крупных размерах ДГПЖ [6–8]. Немало сообщений свидетельствуют о возможном увеличении верхней границы объема простаты при наличии большого опыта выполнения трансуретральной энуклеации до 150 см3 [9–13]. В частности, в нашей клинике (Урологический центр Дорожной клинической больницы на ст. Н. Новгород ОАО РЖД, далее ДКБ) при размерах простаты свыше 80 см3 и в отсутствие противопоказаний к эндоскопическому лечению практикуется выполнение ПТУЭП. Адекватность выбора данного оперативного метода доказана на значительном клиническом материале, накопленном с 2008 г. (свыше 1000 случаев). В 2015 г. нами было опубликовано сообщение об успешно проведенной плазменной трансуретральной энуклеации у пациента с объемом простаты 440 см3 [14]. Однако, как показала практика, данный объем не является пределом возможностей для ПТУЭП.
Представляем описание успешного применения данного хирургического метода при ДГПЖ объемом 530 см3, осложненной конкрементами в мочевом пузыре.
П а ц и е н т Ч. 78 лет поступил в урологическую клинику ДКБ с жалобами на учащенное мочеиспускание малыми порциями днем и до 6 раз за ночь. Со слов пациента, эти жалобы беспокоили в течение 1 года, тогда же впервые обратился к урологу по месту жительства. В течение года принимал тамсулозин с незначительным положительным эффектом. Ухудшение состояния наступило в течение последнего месяца. По результатам амбулаторного обследования (УЗИ: объем железы определить сложно из-за больших размеров; ПСА 7,9 нг/мл; урофлоуметрия: обструктивный тип мочеиспускания) установлен диагноз ДГПЖ и рекомендовано плановое хирургическое лечение в стационаре.
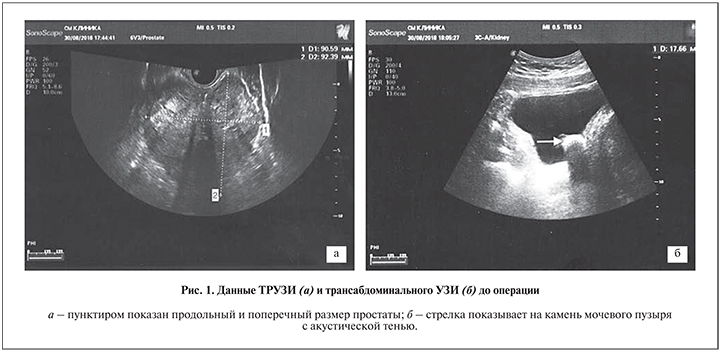
При поступлении: состояние удовлетворительное, органы и системы без патологии. Сопутствующее заболевание – гипертоническая болезнь II стадии, 1–2-й ст., риск 3, в связи с чем рекомендована предоперационная консультация кардиолога. Урологический профиль: per rectum – простата увеличена значительно, консистенция тугоэластическая, безболезненная, однородная, асимметричная; срединная борозда не определяется, слизистая прямой кишки подвижная; при урофлоуметрии выявлены признаки инфравезикальной обструкции с максимальной скоростью потока мочи (Qmax) 8,6 мл/с; оценка симптомов нарушения мочеиспускания по шкале IPSS составила 29 баллов, качества жизни по шкале QoL – 5 баллов; по данным трансректального (ТРУЗИ) и трансабдоминального УЗИ размер железы около 90×92×84 мм, капсула не утолщена, структура выраженно неоднородная за счет крупных зон фиброза, кальцинатов и кистозной перестройки (рис. 1); объем остаточной мочи 200 мл при наполнении 380 мл, содержимое – неоднородное, анэхогенное с изоэхогенной взвесью, в просвете мочевого пузыря определяются гипо- и гиперэхогенные образования, одно – однородное с четкими контурами размером 35×48×35 мм, второе – конкремент с плотной акустической тенью размером до 18 мм. Рекомендовано МРТ-исследование.
Результаты МРТ: предстательная железа овоидной конфигурации, в размерах значительно увеличена (99×112×95 мм), объем 527 см3, зональная анатомия нарушена, граница между центральной и периферическими зонами отсутствует, почти весь объем занимают разрастания, типичные для доброкачественной гиперплазии, с различными по структуре участками кровоизлияний до 10 мм и кальцинатами, капсула железы на всем протяжении четкая, мочевой пузырь деформирован предстательной железой, в области устьев мочеточников определяются конкременты овальной формы размером 17×12 и 20×11 мм.
Анализы крови, мочи без особенностей. Рентгенография грудной клетки: гипертрофия левого желудочка, возрастные изменения. Данные ЭКГ: нарушение внутрижелудочковой проводимости.
 На 3-й день госпитализации пациенту выполнена операция методом ПТУЭП. Для хирургических манипуляций использовали систему PLASMA (TURis), включающую плазменный резектоскоп 26 Fr фирмы «Olympus», ВЧ-генератор ESG-400 для подачи энергии на плазменные электроды, применяемые для рассечения, – Plasma-Needle (электрод типа «игла»), для энуклеации – Plasma-TUEBLoop и для резекции – Plasma-LargeLoop (большой петлевой электрод). В качестве ирригационной жидкости использовали физиологический раствор, подогретый до 37°С.
На 3-й день госпитализации пациенту выполнена операция методом ПТУЭП. Для хирургических манипуляций использовали систему PLASMA (TURis), включающую плазменный резектоскоп 26 Fr фирмы «Olympus», ВЧ-генератор ESG-400 для подачи энергии на плазменные электроды, применяемые для рассечения, – Plasma-Needle (электрод типа «игла»), для энуклеации – Plasma-TUEBLoop и для резекции – Plasma-LargeLoop (большой петлевой электрод). В качестве ирригационной жидкости использовали физиологический раствор, подогретый до 37°С.
Описание операции: ПТУЭП, контактная гольмиевая лазерная цистолитотрипсия.
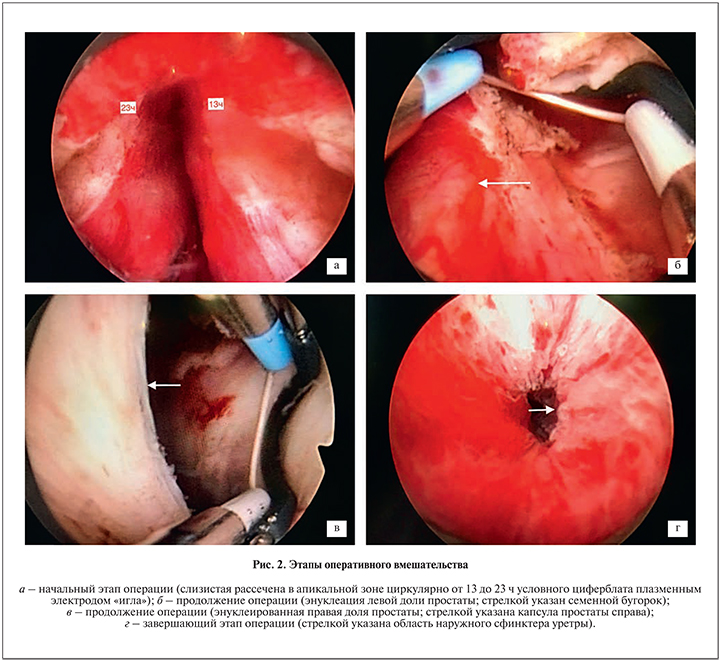
Под спинальной анестезией резектоскоп введен в простатический отдел уретры. За значительно увеличенными долями предстательной железы камни в мочевом пузыре визуализировать не удалось, поэтому цистолитотрипсию решено выполнять после энуклеации. Плазменным электродом типа «игла» проведено рассечение слизистой в апикальной зоне с 13 до 23 ч условного циферблата проксимально, обходя семенной бугорок (рис. 2, а). С помощью плазменного электрода для энуклеации начато выделение аденомы простаты в параколликулярной зоне от 6 ч условного циферблата справа и слева до 13 и 23 ч с последующей энуклеацией ближе к передней поверхности в направлении шейки мочевого пузыря. Апикальная зона по передней поверхности между 13 и 23 ч максимально сохранена на 1–1,5 см в сторону шейки мочевого пузыря для предотвращения недержания мочи в послеоперационном периоде.
Ввиду больших размеров аденомы выделить ее единым блоком было невозможно, поэтому сначала ее энуклеировали полностью по передней поверхности и насколько возможно по боковым и задней областям (рис. 2, б). Слизистая шейки мочевого пузыря рассечена по передней полуокружности. Выделенная часть аденомы для уменьшения размера и возможности проведения последующей энуклеации измельчена большой плазменной петлей для резекции. Эвакуатором удалены фрагменты в объеме 220 см3.
 Следующим этапом энуклеирована оставшаяся часть аденомы с сохранением «мостика» по задней поверхности простаты ближе к шейке мочевого пузыря для предотвращения миграции в просвет мочевого пузыря (рис. 2, в). Затем после измельчения оставшейся части с одновременным контролем гемостаза эвакуировано еще 310 см3 фрагментов. Время, затраченное на выполнение ПТУЭП, составило 140 мин, израсходовано 53 л физиологического раствора.
Следующим этапом энуклеирована оставшаяся часть аденомы с сохранением «мостика» по задней поверхности простаты ближе к шейке мочевого пузыря для предотвращения миграции в просвет мочевого пузыря (рис. 2, в). Затем после измельчения оставшейся части с одновременным контролем гемостаза эвакуировано еще 310 см3 фрагментов. Время, затраченное на выполнение ПТУЭП, составило 140 мин, израсходовано 53 л физиологического раствора.
На последнем этапе операции проведена контактная гольмиевая лазерная цистолитотрипсия. Гольмиевым лазером выполнена фрагментация двух конкрементов размером до 1,5 см каждый, фрагменты эвакуированы. Продолжительность цистолитотрипсии составила 20 мин. После этого установлен катетер Фолея № 22 Fr, баллон наполнен в просвете мочевого пузыря до 90 мл с легким эластическим натяжением на 3 ч. Гемодинамических нарушений во время операции не отмечено. Контроль наружного сфинктера уретры показал отсутствие интраоперационных повреждений, что важно для удержания мочи в послеоперационном периоде (рис. 2, г). Установлена промывная система на 6 ч, жидкость чистая.
Для оценки интраоперационной кровопотери мы проводили исследования промывной жидкости во время операции. Для определения степени интраоперационной кровопотери проводилось исследование гемоглобина в промывной жидкости по фотоэлектроколориметрическому методу. Расчет выполнялся по следующей формуле:
Абсолютный объем кровопотери V = НЬ.пж. х V.пж./НЬ.кр.
НЬ.пж. = концентрация гемоглобина (г/%) в промывной жидкости. V.пж = объем промывной жидкости в мл.
НЬ.кр. = концентрация гемоглобина (г/дл) в крови, взято перед или во время операции.
Гистологическое заключение: железисто-стромальная гиперплазия предстательной железы. Признаки хронического воспаления.
Послеоперационный период протекал гладко, без осложнений, проводилась антибактериальная, противовоспалительная, гемостатическая, инфузионная и антикоагулянтная терапия. Уретральный катетер удален на 2-е сутки, восстановлено самостоятельное мочеиспускание. Пациент удерживал мочу, периодически отмечая незначительное подкапывание мочи (использовал 2 прокладки). Выписан из клиники на амбулаторное лечение через 2 сут. после операции в удовлетворительном состоянии.
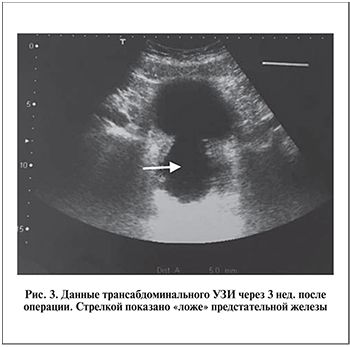
На контрольном обследовании через 3 нед. после операции осложнений органического и функционального характера не выявлено, удержание мочи полное, частота дневных мочеиспусканий до 8 раз, ночных – до 2 раз, Qmax повысилась до 20,4 мл/с, объем остаточной мочи снизился до 80 мл, суммарный индекс по шкале IPSS до 16 баллов, по шкале QoL до 2 баллов. Данные трансабдоминального УЗИ: очаговых образований в области энуклеации предстательной железы не выявлено, процесс постепенного сокращения ложа удаленной железы, шейка мочевого пузыря открыта (рис. 3). Данные УЗИ мочевого пузыря: картина псевдодивертикулеза, взвеси в мочевом пузыре, при опорожненном мочевом пузыре стенка утолщена с отеком, трабекулярность выражена. Дилатации чашечно-лоханочной системы при УЗИ почек и надпочечников не выявлено. В анализе мочи: протеинурия (1,20 г/л), бактериурия (нитритобразующие бактерии), эритроцитурия (50–60–70 в поле зрения), лейкоцитурия (все поля зрения). В анализе крови: незначительное снижение содержания эритроцитов (3,43х1012/л) и гематокрита (31%), повышение СОЭ (60 мм/ч).
Выявленные отклонения в урологическом статусе соответствуют обычному течению послеоперационного процесса, обследование рекомендовано повторить через 3 нед. после антибактериального и противовоспалительного лечения. Тем не менее в целом послеоперационный результат следует считать положительным, поскольку осложнений, связанных непосредственно с оперативным лечением, у пациента не наблюдалось.
Заключение. В представленном наблюдении общий объем удаленной аденоматозной ткани составил 530 см3 (рис. 4), общее время симультанного хирургического вмешательства – 160 мин (из них на ПТУЭП потрачено 140 мин), объем интраоперационной кровопотери – 260 мл. Трудности выполнения операции заключались в поэтапной энуклеации и эвакуации большого объема гиперплазированной ткани простаты.
По сравнению с результатами классической энуклеации, позволившей удалить ДГПЖ объемом 440 см3, о чем мы сообщали в публикации 2015 г. [13], в данном клиническом наблюдении время оперативного вмешательства (без учета времени цистолитотрипсии) было меньше на 1 ч, кровопотеря изменилась незначимо (+150 мл).
Преимущество методики заключается в возможности удаления аденомы гигантского размера со значительным сокращением операционного времени без значимого увеличения интраоперационной кровопотери и без осложнений интра- и послеоперационного периода. Ввиду малочисленности вариантов ДГПЖ подобных размеров в клинической практике статистически обосновать альтернативность применения метода ПТУЭП взамен травматичных открытых операций пока сложно. В то же время полученный однозначно положительный результат свидетельствует о появлении в арсенале эндохирургических методов лечения ДГПЖ крупных размеров нового перспективного способа выполнения энуклеации простаты, который можно рекомендовать к широкому внедрению в урологическую практику.



