Кафедра урологии (зав. каф. – д.м.н., проф. Б. К. Комяков) ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И. И. Мечникова» Минздрава России, Санкт-Петербург, Россия
Цель: установить частоту поражения предстательной железы переходно-клеточным раком и первичной аденокарциномой у больных раком мочевого пузыря после радикальной цистэктомии.
Материалы и методы. С 1995 по 2016 г. радикальная цистэктомия с удалением мочевого пузыря, околопузырной клетчатки, предстательной железы, семенных пузырьков, регионарной тазовой лимфаденэктомией выполнена 283 мужчинам. Простатосберегающая цистэктомия проведена 45 (13,7%) пациентам. Полностью предстательная железа оставлена у 21 (6,4%) мужчины, верхушка простаты сохранена у 24 (7,3%) пациентов.
Результаты и обсуждение. Распространение переходно-клеточного рака мочевого пузыря на предстательную железу имело место у 50 (15,2%) больных. У 12 (3,6%) пациентов верифицирована первичная аденокарцинома простаты. Клинически значимый рак простаты был диагностирован у 4 (33,3%) пациентов.
Заключение. Считаем, что высокий онкологический риск простатосберегающей цистэктомии, несмотря на ее небольшие функциональные преимущества, диктует необходимость удаления простаты при хирургическом лечении рака мочевого пузыря.
радикальная цистпростатэктомия
рак мочевого пузыря
простатосбережение
Введение. Радикальная цистпростатэктомия (РЦПЭ) является стандартным методом лечения мышечно-инвазивного уротелиального рака мочевого пузыря (РМП) у мужчин [1–7]. За последние десятилетия техника РЦПЭ за счет внедрения нервосберегающей модификации [8, 9] расширенной тазовой лимфодиссекции [1, 4, 10, 11] и ортотопической деривации мочи претерпела значительные изменения. В отношении тщательно отобранных пациентов применяется простатосберегающий способ РЦПЭ, при котором улучшается континенция и сексуальная функция. Однако отдаленные онкологические результаты данных операций остаются противоречивыми [12–16]. При патоморфологическом исследовании после РЦПЭ в предстательной железе (ПЖ) часто выявляется уротелиальный рак или аденокарцинома простаты. Частота случайно выявленного рака ПЖ в гистологических препаратах колеблется от 2 до 60% [13, 17, 18], а переходно-клеточного рака ПЖ – от 12 до 48% [17, 19, 20].
Цель: установить частоту поражения ПЖ переходно-клеточным раком и первичной аденокарциномой у больных РМП после РЦПЭ.
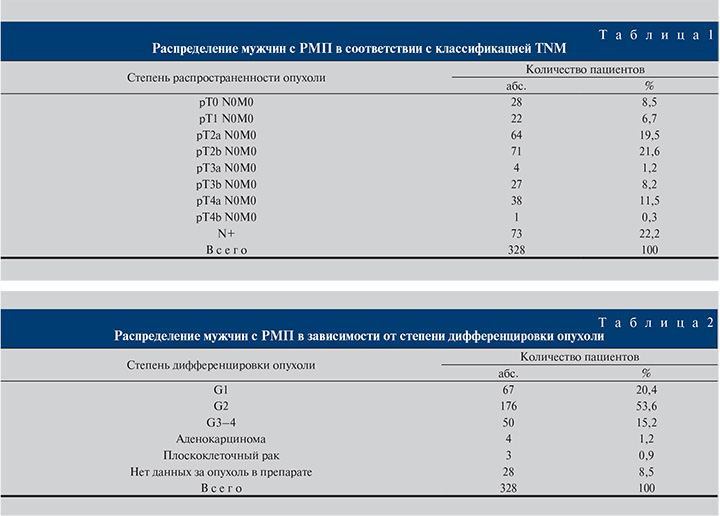
Материалы и методы. Нами проведено ретроспективное исследование на основании материала 328 радикальных цистэктомий (РЦ) по поводу РМП, выполненных мужчинам в период с 1995 по 2016 г. Возраст пациентов колебался от 22 до 82 лет (57±3,7 года). Распределение мужчин в соответствии с классификацией TNM представлено в табл. 1.
Ортотопическая цистопластика была выполнена 236 (71,8%) больным, из них 16 (4,8%) – гастроцистопластика (ортоГЦП), 196 (59,7%) – илеоцистопластика (ортоИЦП), 24 (7,3%) – сигмоцистопластика (ортоСЦП), гетеротопическая – 9 (2,7%), пересадка мочеточников в сигмовидную кишку – 40 (12,1%) и уретерокутанеостомия – 43 (13,1%).
Органоограниченная опухоль (≤pT2N0M0) была диагностирована у 185 (56,4%) больных. У 70 (21,3%) пациентов новообразование прорастало в паравезикальную клетчатку или в соседние органы. В 73 (22,2%) наблюдениях выявлены метастазы в регионарных лимфатических узлах (табл. 1).
Из большинства прооперированных нами мужчин 243 (74%) страдали высоко- или умереннодифференцированным переходно-клеточным РМП (табл. 2).
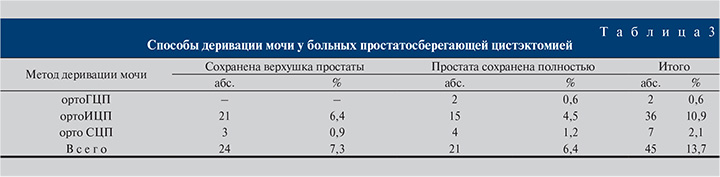
Радикальная цистпростатэктомия с удалением мочевого пузыря (МП), околопузырной клетчатки, ПЖ, семенных пузырьков, регионарной тазовой лимфаденэктомией выполнена 283 (86,3%) мужчинам, простатосберегающая цистэктомия – 45 (13,7%). Полностью ПЖ оставлена у 21 (6,4%) пациента, верхушка простаты – у 24 (7,3%) (табл. 3). Срезы препарата ПЖ готовили с интервалом 2–3 мм. Способы деривации мочи у больных после простатосберегающей цистэктомии представлены в табл. 3.
Алгоритм, используемый нами для отбора кандидатов для простатосберегающей цистэктомии, представлен в табл. 4.
Каждые 6 мес в течение первых двух лет, а затем ежегодно проводилось контрольное обследование, включившее лабораторные исследования, определение уровня ПСА крови, УЗИ и СКТ брюшной полости и малого таза, экскреторную урографию, динамическую сцинтиграфию, остеосцинтиграфию. Оценивали функциональное состояние верхних мочевыводящих путей и мочевого резервуара, степень метаболических нарушений, а также онкологический статус больных.
Результаты и обсуждение. Распространение переходно-клеточного РМП на ПЖ имело место у 50 (15,2%) больных. У 12 (3,6%) пациентов верифицирована первичная аденокарцинома ПЖ. Уротелиальный рак ПЖ может быть результатом прямой инвазии РМП (продолженный рост) или быть первичной опухолью самой простаты (непродолженный рост). В большинстве случаев распространение переходно-клеточного рака на ПЖ было результатом прямой инвазии. Стромальная инвазия выявлена у 46 (92%) больных. У 4 (8%) пациентов не было связи между первичным РМП и очагами уротелиального рака в ПЖ.

Важным вопросом остается клиническая значимость случайно верифицированной аденокарциномы ПЖ. При этом к существенным факторам относятся размер опухоли ≥0,5 мл [21] и оценка по шкале Глисона ≥5 [22]. Основываясь на этих критериях, клинически значимый рак ПЖ был диагностирован у 4 (33,3%) наших больных. По данным литературы, клинически значимый рак ПЖ верифицируется в 18–62% случаев после РЦПЭ [13, 17, 19].
По данным [23], средний уровень ПСА в группе больных с инцидентальным раком ПЖ составил 2,84 нг/мл, в контрольной группе – 2,91 нг/мл. Более того, в группе больных инцидентальным раком ПЖ уровень ПСА крови не отражал индекс Глисона и стадию pT. Результаты этого исследования не подтверждают первостепенной роли предоперационного уровня ПСА крови у таких пациентов.
Заключение. Результаты собственных исследований и данные литературы свидетельствуют о существенном риске поражения ПЖ переходно-клеточным раком или наличии сопутствующей аденокарциномы ПЖ у больных после РЦПЭ по поводу РМП. Считаем, что высокий онкологический риск простатосберегающей цистэктомии, несмотря на ее небольшие функциональные преимущества, диктует необходимость полного удаления ПЖ при хирургическом лечении РМП.
1 Komyakov B.K., Sergeev A.V., Fadeev V.A. Lymph node dissection in radical cystectomy. Voprosy onkologii. 2010;56(5):508–513. Russian (Комяков Б.К., Сергеев А.В., Фадеев В.А. Лимфодиссекция при радикальной цистэктомии. Вопросы онкологии. 2010;56(5):508–513).
2 Komyakov B.K., Fadeev V.A., Sergeev A.V. Cystectomy and replacement of the urinary bladder in women. Zhurnal akusherstva i zhenskikh boleznei. 2011;LX(2):48–50. Russian (Комяков Б.К., Фадеев В.А., Сергеев А.В. Цистэктомия и замещение мочевого пузыря у женщин. Журнал акушерства и женских болезней. 2011;LX(2):48–50).
3 Komyakov B.K., Guliev B.G., Sergeev A.V. et al. Survival of patients with bladder cancer after radical cystectomy. Onkourologiya. 2016;1(12):40–46. Russian (Комяков Б.К., Гулиев Б.Г., Сергеев А.В. и соавт. Выживаемость больных раком мочевого пузыря после радикальной цистэктомии. Онкоурология. 2016;1(12):40–46).
4 Krasnyi S.A., Sukonko O.G., Rolevich A.I. Results of treatment of bladder cancer patients with regional lymph node metastases. Onkourologiya. 2007;3:35–41. Russian (Красный С.А., Суконко О.Г., Ролевич А.И. Результаты лечения больных раком мочевого пузыря с метастазами в регионарных лимфоузлах. Онкоурология. 2007;3:35–41).
5 Krasnyi S.A., Sukonko O.G., Polyakov S.L. et al. Predictors of early severe complications of radical cystectomy. Onkourologiya. 2010;4:42–47. Russian (Красный С.А., Суконко О.Г., Поляков С.Л. и соавт. Предикторы ранних тяжелых осложнений радикальной цистэктомии. Онкоурология. 2010;4:42–47).
6 Hautmann R.E., de Petriconi R.C., Volkmer B.G. Lessons learned from 1 000 neobladders; the 90-day complications rate. J Urol. 2010;184: 990–994.
7 Hautmann R.E., de Petriconi R.C., Volkmer B.G. 25 years of experience with 1000 neobladders; long-term complications. J Urol. 2011;185:2207–2212.
8 Kessler T.M., Burkhard F.C., Perimenis P. et al. Attempted nerve sparing surgery and age have a significant effect on urinary continence and erectile function after radical cystoprostatectomy and ileal orthotopic bladder substitution. J Urol. 2004;172:1323–1327.
9 Shoenberg M.P., Walsch P.C., Breazeale D.R. et al. Local recurrence and survival following nerve sparing radical cystoprostatectomy for bladder cancer: 10-year follow up. J Urol. 1996. Vol. 155. P. 490–494.
10 Abol-Enein H., Tilki D., Mosbah A. et al. Does the extent of lymphadenectomy in radical cystectomy for bladder cancer influence disease-free survival? A prospective single – center study. Eur.Urol. 2011; 60:572–577.
11 Roth B., Burkhard F.C. The Role of lymphadenectomy in radical cystectomy. Eur. Urol. 2010;9:19–24.
12 Brausi M., Gavioli M., Viola M. Radical cystectomy and orthotopic neobladder with prostate and seminal sparing in young patients with transitional cell carcinoma (TCC) of the bladder. Eur. Urol. 2005;4(Suppl.):61–66.
13 Damiano R., Di Lorenzo G., Cantiello F. et al. Clinicopathological features of prostate adenocarcinoma incidentally discovered at the time of radical cystectomy: an evidence – based analysis. Eur. Urol. 2007;52:648–657.
14 Ong C.H., Schmitt M., Thalmann G.N., Studer U.E. Individualized seminal vesicle sparing cystoprostatectomy combined with ileal orthotopic bladder substitution achieves good functional results. J Urol. 2010;183:1337–1342.
15 Revelo M.P., Cookson M.S., Chang S.S. et al. Incidence and location of prostate and urothelial carcinoma in prostates from cystoprostatectomies: implications for possible apical sparing surgery. J Urol. 2004;171:646–651.
16 Rozet F., Lesur G., Cathelineau X. et al. Oncological evaluation of prostate sparing cystectomy: the montsouris long-term results. J Urol. 2008;179:2170–2175.
17 Saad M., Abdel-Rahim M., Abol-Enein H., Ghoneim M.A. Concomitant pathology in the prostate in cystoprostatectomy specimens: a prospective study and review. BJUI. 2008;102:1544–1550.
18 Winkler M.H., Livni N., Mannion E.M., Houdra D., Christmas T. Characteristics of incidental prostatic adenocarcinoma in contemporary radical cystoprostatectomy specimens. BJUI. 2007;99:554–558.
19 Pettus J.A., Al-Ahmadie H., Barocas D.A. et al. Risk assessment of prostatic pathology in patients undergoing radical cystoprostatectomy. Eur Urol. 2008;53:370–375.
20 Shen S.S., Lerner S.P., Muezzinoglu B., Truong L.D., Amiel G., Wheeler T.M. Prostatic involvement by transitional cell carcinoma in patient with bladder cancer and its prognostic significance. Hum. Pathol. 2006;37:726–734.
21 Stamey T.A., Freiha F.S., McNeal J.E. et al. Localized prostate cancer. Relationship of tumor volume to clinical significance for treatment of prostate cancer. Cancer. 1993;71(Suppl. 3):933–938.
22 Epstein J.I., Chan D.W., Sokoll L.J. et al. Nonpalpable stage T1c prostate cancer: prediction of insignificant disease using free/total prostate specific antigen levels and needle biopsy findings. J Urol. 1998;160:2407–2411.
23 Ruffion A., Manel A., Massoud W. et al. Preservation of prostate during radical cystectomy: evaluation of prevalence of prostate cancer associated with bladder cancer. Urology. 2005;65:703–707.
А в т о р д л я с в я з и: А. В. Сергеев – д.м.н., профессор кафедры урологии ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И. И. Мечникова» МЗ РФ, Санкт-Петербург, Россия; e-mail:
urolsergeev@gmail.com





