Синдром Дауна (ДС), или трисомия по хромосоме 21 является одной из наиболее часто встречающихся хромосомных болезней. Частота ДС среди новорожденных составляет 1:700–1:800 [1] и не имеет существенной временной, этнической или географической разницы при одинаковом возрасте родителей. Частота рождения детей с ДС коррелирует с возрастом матери и в меньшей мере с возрастом отца [2]. Цитогенетические варианты ДС различны, но основную часть случаев (около 95%) составляет регулярная трисомия 21, при этом около 90% случаев ДС возникают в результате нерасхождения хромосом в мейозе у матери [3]. Транслокационная форма ДС составляет около 4% случаев, мозаичная – 2% [4].
Спектр клинических проявлений трисомии 21 может выраженно варьировать. У большинства пациентов наблюдают задержку умственного развития и характерные дисморфии (круглое уплощенное лицо, монголоидный разрез глаз, деформированные ушные раковины и другие врожденные пороки развития) [5]. При мозаичной форме трисомии 21 клинические проявления могут значимо варьироваться: от сравнимых с таковыми у лиц с регулярной формой ДС до почти нормального фенотипа [6]. Пациенты с мозаичной формой трисомии 21 имеют более сохранный интеллект и лучше социализированы [7].
До недавнего времени продолжительность жизни пациентов с трисомией 21 была невелика. Врожденные пороки (сердца, желудочно-кишечного тракта и др.), нарушения постнатального развития, сниженный клеточный и гуморальный иммунитет могут приводить к ранней смерти таких пациентов. Благодаря успехам современной медицины в развитых странах средняя продолжительность жизни при ДС в настоящее время увеличилась и достигает 50–60 лет, а использование новых методов обучения позволило некоторым взрослым пациентам социально адаптироваться и вести самостоятельную жизнь, овладевать несложными профессиями, создавать семьи [8]. В связи с этим становится актуальным изучение состояния репродуктивной системы, гаметогенеза и фертильности пациентов с ДС, а также их нарушений. Исследования, посвященные состоянию репродуктивной системы мужчин с ДС, немногочисленны, число обследованных пациентов невелико, а результаты противоречивы. В статье представлены данные литературы по состоянию репродуктивной системы и фертильности у мужчин с трисомией 21, а также случаи беременности и рождения детей от пациентов с ДС.
Состояние репродуктивной системы у мужчин с синдромом Дауна
Органы мочеполовой системы
Данные о состоянии органов репродуктивной системы мужчин с синдромом Дауна противоречивы. Некоторые авторы отмечают у мужчин с ДС повышенную частоту нарушений мочеполовой системы [9]. В ряде исследований у пациентов с ДС выявлен сниженный объем яичек [10– 12], в то время как другие авторы сообщают о нормальных размерах тестикул [13–15]. При обследовании 53 пациентов мужского пола с ДС, включавшем детей и взрослых, выявлено, что все пациенты старше 15 лет находились на VI–V стадиях полового развития по Таннеру [16], при этом средняя длина пениса и объем яичек у них были ниже нормы [17]. В другом обследовании подростков и молодых мужчин с ДС, проведенном в динамике, у большинства пациентов отмечена задержка полового развития и ни один из пациентов не достиг V стадии по Таннеру, средний объем яичек у мальчиков с ДС также был ниже нормы [11]. В выборке мужчин с ДС разных возрастных групп (от 15 до 58 лет) уменьшенный размер яичек наблюдали у всех пациентов [10, 12], при этом у взрослых пациентов с ДС размер тестикул был сопоставим с таковым у пациентов с синдромом Клайнфельтера [10].
Однако, по данным некоторых исследователей, мужчины с ДС могут иметь и нормальные размеры половых органов. Так, при обследовании 6 взрослых мужчин с ДС в возрасте от 21 года до 29 лет объем яичек пациентов с ДС не отличался от такого у пациентов с задержкой умственного развития и нормальным мужским кариотипом (46,XY) [14]. По данным обследования 46 подростков и молодых мужчин с ДС, длина и окружность полового члена, а также объем яичек статистически не отличались от таковых у здоровых подростков, при этом развитие подмышечного и лицевого оволосения несколько отставало [15].
Следует отметить, что при сравнении средних показателей необходимо учитывать индивидуальные различия. Например, в исследовании Hasen et al. (1980) показано, что, хотя средний объем тестикул у пациентов с ДС (19,4±4,6 мл) сопоставим с нормой, у трети пациентов отмечен сниженный объем яичек [18]. В работе Attia et al. (2015) сниженный объем яичек встречался в 23,8% случаев [19].
Согласно некоторым исследованиями, у пациентов с ДС чаще, чем в общей популяции, встречается крипторхизм [20]. Известно, что ретенция тестикул сопровождается нарушением развития герминативного эпителия, и чем дольше яички находятся вне мошонки, тем более в них выражены морфологические изменения. Показано, что при гистологическом исследовании биопататов тестикул мужчин с дефектами опущения яичек в анамнезе, у 2/3 пациентов обнаруживают синдром «только клетки Сертоли», или мейотический блок сперматогенеза [21]. На модельных животных показано, что ранняя орхипексия может предотвращать дегенерацию половых клеток и сохранять сперматогенез [22].
У мужчин с ДС повышен риск развития рака яичка [23, 24]. Предполагают, что избыток гонадотропных гормонов и повышенная экспрессия онкогена ETS2, локализованного на хромосоме 21 (локус 21q22.2), вызванная увеличением дозы (трипликацией) данного гена, могут вызывать у пациентов с ДС предрасположенность к развитию герминогенных опухолей [23].
Уровень гормонов
Большинство исследований свидетельствует, что пациенты мужского пола с ДС имеют повышенные уровни фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов и нормальный уровень тестостерона (Т) [14, 17, 18]. Некоторые авторы сообщают о сниженном уровне тестостерона [12, 19]. В работе Campbell et al. повышенный уровень ЛГ выявлен только у пациентов старше 30 лет, и было показано, что с возрастом уровень ЛГ и ФСГ повышается [10]. Однако другие авторы указывают, что уровни ФСГ, ЛГ и Т у мальчиков-подростков с ДС такие же, как у здоровых подростков во время полового созревания [15]. Так, концентрация всех трех гормонов в сыворотке крови увеличивалась с 10 до 18 лет, затем несколько снижалась, что также наблюдается и у здоровых подростков [15]. Ряд исследований показывает, что у некторых мужчин с ДС наблюдается нормальное половое созревание, однако с возрастом яички подвергаются атрофии [25].
Известно, что процесс сперматогенеза инициируют и регулируют гормоны гипоталамо-гипофизарно-гонадной оси, при этом ФСГ преимущественно воздействует на клетки Сертоли, ЛГ – на клетки Лейдига [26]. Выраженное повышение уровня ФСГ в сыворотке крови свидетельствует о нарушении сперматогенеза [27]. Так как продукция тестостерона зависит от объема тестикулярной ткани, существенное значение имеют размер яичек, наличие или отсутствие гипоплазии тестикул, степень ее выраженности. У пациентов с ДС показана отрицательная корреляция между уровнем гонадотропинов и объемом яичек [11, 18]. Нормальная концентрация тестостерона в крови при значительно повышенных уровнях ЛГ и ФСГ свидетельствует о первичном поражении гонад и недостаточной функции клеток Лейдига [10, 17]. Вероятно, поражение гонад при этом может прогрессировать с возрастом [17], так как многие авторы сообщают, что в детском и подростковом возрасте у пациентов с ДС клетки Лейдига функционируют нормально [17, 28].
Половая активность
Интерес к противоположному полу и вопросам секса у пациентов с ДС снижен по сравнению со здоровыми сверстниками. У них встречается как неспособность достигать эрекции (эректильная дисфункция), так и нарушение эякуляции [29]. Кроме этого часто мужчины с ДС воздерживаются от половых отношений из-за своей неосведомленности в вопросах половой жизни [30]. Согласно исследованию Attia et al. (2015), половое созревание у пациентов с ДС наступает позже, чем у здоровых мужчин. Только около половины (57,1%) пациентов с ДС в возрасте 21–28 лет были сексуально активны, мастурбировали, испытывали влечение к другому полу и желание вступить в брак [19]. Есть основания полагать, что сексуальная активность пациентов с ДС связана не только с уровнем гормонов, но и с состоянием сердечно-сосудистой системы. Известно, что эректильную дисфункцию рассматривают как ранний маркер сердечно-сосудистых заболеваний [31, 32]. В литературе описан фертильный мужчина с трисомией 21, который не имел каких-либо нарушений со стороны сердечно-сосудистой системы [33]. Фенотипические проявления ДС могут быть не столь выражены или отсутствовать при мозаичной форме трисомии 21. Мужчины и женщины с мозаичной формой ДС чаще, чем пациенты с регулярной трисомией 21, вступают в брак и/или заводят детей. Так, согласно регистрам данных о рождении и актов гражданского состояния Дании, 15% пациентов с мозаичной формой ДС состояли в браке и 7% имели детей, в то время как для пациентов с регулярной трисомией 21 эти показатели составляли по 1% [34].
Состояние сперматогенеза, данные сперматологических исследований
Получение эякулята от пациентов с ДС в связи с рядом причин (умственная отсталость, эректильная дисфункция и др.) представляет определенную трудность, поэтому сперматологические исследования единичны, а выборки пациентов немногочисленны. Так, в работе Stearns et al. (1960) из 21 мужчины с ДС только 9 смогли сдать эякулят, 2 пациента не смогли достичь эрекции, а 10 не смогли эякулировать. Из тех, кто сдал материал, у 4 человек диагностировали азооспермию, у 5 – олигозооспермию с концентрацией сперматозоидов от 2,6 до 18,3 млн/мл и средним объемом эякулята 1 мл [29]. При этом имеются сообщения об отсутствии у некоторых пациентов с трисомией 21 тяжелых форм патозооспермии вплоть до наличия нормозооспермии [35].
Несколько работ описывают состояние сперматогенеза при трисомии 21 по данным биопсии. Согласно имеющимся данным, гистологическая картина тестикулярных биоптатов у мужчин с ДС вариабельна в отношении поражения герминативного эпителия. При анализе извитых семенных канальцев у пациентов с ДС описаны как нарушения сперматогенеза – мейотический блок [36, 37] и гипосперматогенез [38], так и нормальный сперматогенез [13]. Пациентов, которым выполнен анализ биоптатов, крайне мало: в двух работах обследовано по одному пациенту [36, 37], в одной – два [13] и в одной – три пациента [38]. Необходимо отметить, что биопсия яичка является инвазивной процедурой и в настоящее время проводится строго по медицинским показаниям. Выполнение биопсии яичка с диагностической или научной целью пациентам, не имеющим тяжелых форм нарушений репродуктивной системы [13], не соответствует современным правовым и этическим нормам.
Поскольку нарушение сперматогенеза может быть вызвано различными факторами и одной из частых генетических причин азооспермии являются микроделеции Y-хромосомы, некоторые авторы исследовали их у мужчин с ДС. Так, для 22 пациентов с ДС проведен поиск микроделеций в локусе AZF и делеции не были обнаружены, однако, к сожалению, анализ эякулята в данной работе не проводили [39]. Не было найдено делеций локуса AZF и у пациента с мозаичной формой трисомии 21, имевшего азооспермию [40].
Случаи доказанной фертильности у мужчин с регулярной формой ДС
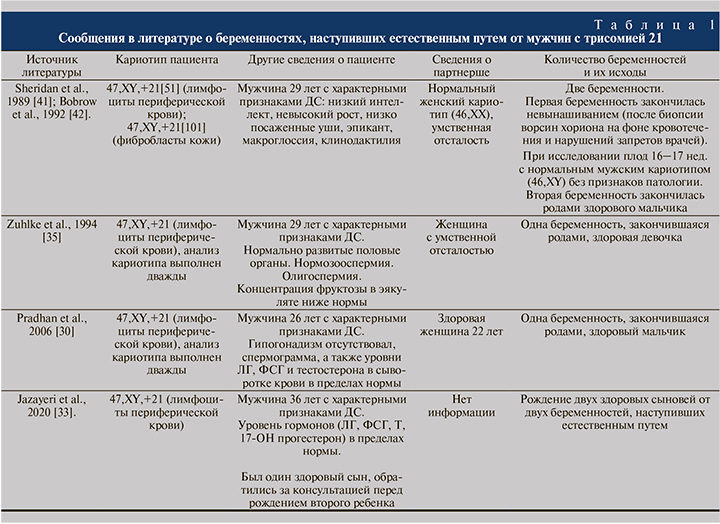
Многие работы показывают нарушение фертильности у мужчин с ДС, при этом в научной литературе сообщают о шести случаях беременности, наступившей естественным путем от четырех мужчин с регулярной формой ДС [30, 33, 35, 41, 42] (табл. 1). У мужчин с ДС, беременность от которых наступила естественным путем, выявлены нормозооспермия и отсутствие признаков гипогонадизма [30, 35], нормальные уровни ЛГ, ФСГ и тестостерона [30, 33]. Во всех случаях отцовство пациентов с ДС доказано молекулярно-генетическими методами доступными на момент исследования. От двух мужчин зачатие наступало дважды. У партнерши одного из них первая беременность завершилась невынашиванием, вторая – рождением здорового ребенка [41, 42]. У второго мужчины родились два здоровых сына [33]. Случаи беременности от двух других мужчин с ДС также завершились рождением здоровых детей [30, 35]. Согласно регистрам данных о рождении и актов гражданского состояния Дании, в стране с 1980 по 2008 гг. зарегистрировано 8 случаев рождения детей от 6 мужчин с ДС, из них 5 мужчин имели регулярную форму трисомии 21, один – мозаичную. Случаев рождения детей от мужчин с транслокационной формой ДС зарегистрировано не было. Все рожденные дети были здоровыми [34]. Поскольку информация о рождении детей получена из регистра, сведения о способе зачатия отсутствуют. Можно предполагать, что имели место либо преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А), либо пренатальный скрининг с выполнением инвазивной диагностики. Следует отметить достаточно быстрое наступление беременности у партнерш некоторых мужчин с ДС. Так, в работе Zuhlke et al. (2008) указано, что беременность наступила после двух незащищенных половых актов, в работе Pradhan et al. (2006) – через 3 мес. половой жизни без предохранения. Первая беременность от мужчины с ДС из сообщений Sheridan et al. (1989) и Bobrow et al. (1992) наступила у партнерши в первом же цикле после отказа от приема оральных контрацептивов, а самопроизвольный аборт произошел через 9 нед. после процедуры биопсии ворсин хориона на фоне маточного кровотечения и непрекращающейся сексуальной активности пары вопреки рекомендациям врачей. При этом, по данным цитогенетического исследования, у плода был нормальный мужской кариотип и у него не было обнаружено каких-либо врожденных пороков развития [41].
Имеется сообщение о рождении здорового ребенка после экстракорпорального оплодотворения (ЭКО/ICSI) ооцитов здоровой женщины сперматозоидами пациента с регулярной формой трисомии 21 [43, 44]. Особое внимание авторы обращают на то, что предимплантационное генетическое тестирование на анеуплоидии (ПГТ-А), выполненное на образцах трофэктодермы, выявило в 12 из 13 (92%) бластоцист нормальный кариотип [43]. Описан также случай рождения ребенка с нормальным кариотипом с помощью ЭКО/ICSI от пациента с мозаичной формой ДС и глобулозооспермией [45] (табл. 2).

Несмотря на то, что теоретический риск рождения ребенка с трисомией 21 от пациентов с ДС составляет 50% и от фертильных женщин могут родиться как больные ДС, так и здоровые дети [41], во всех описанных в литературе случаях беременности от мужчин с регулярной формой трисомии 21 кариотип у потомства был нормальным. Данный феномен, несомненно, требует детального изучения. Возможными объяснениями могут быть как малый объем выборки, искажающий истинную картину, так и биологические механизмы, препятствующие созреванию мужских гамет с аномальным набором хромосом, а также вызывающие коррекцию трисомии у эмбриона на ранних стадиях развития. По-видимому, механизмы удаления анеуплоидных половых клеток в процессе сперматогенеза более эффективны, чем при оогенезе. Показано, что числовые аномалии хромосом встречаются в сперматозоидах в 10–20 раз реже, чем в ооцитах [46]. Однако цитогенетические исследования на сперматозоидах мужчин с ДС, согласно имеющимся у нас сведениям, не проводили. Можно предполагать, что рождение здоровых детей от пациентов с ДС может быть связано с коррекцией анеуплоидии в герминативных клетках. Возможна гибель анеуплоидных половых клеток в процессе сперматогенеза. Например, показано, что у мужчин с кариотипом 47,XYY соотношение гамет с одной половой хромосомой (23,X или 23,Y) было близко к норме и составило около 50%, а частота сперматозоидов с дисомией XY значительно ниже ожидаемой [47, 48]. У пациента с кариотипом 47,XХY доля диплоидных сперматозоидов также составила менее 1% [48]. Эти данные свидетельствуют, что у мужчин с аномалиями половых хромосом в кариотипе гаметы подвергаются действию механизмов селективного отбора, направленного против сперматозоидов с хромосомным дисбалансом. Можно предположить, что аналогичный отбор проходят и половые клетки мужчин с ДС, однако данная гипотеза нуждается в проверке.
Вероятно, что на статус фертильности, состояние сперматогенеза, выраженность патозооспермии и уровень анеуплоидии сперматозоидов влияет генотип пациентов с ДС/ трисомией 21. Известно, что из-за генетической обусловленности фенотипы больных регулярной трисомией 21 могут значительно различаться и включать как тяжелые формы, так и формы с благоприятным для жизни прогнозом. Кроме этого наблюдают выраженные различия между пациентами с регулярной и мозаичной формами ДС. Не найдено сообщений об отцовстве пациентов с транслокационной формой трисомии 21, что может быть обусловлено как малым числом таких пациентов, так и особенностями их сперматогенеза и высоким уровнем анеуплоидии в гаметах. Можно предполагать, что у пациентов с транслокационной формой трисомии 21 встречается только азооспермия или тяжелая олигозооспермия вследствие нарушений мейоза.
Следует также отметить, что в литературе описано несколько случаев рождения детей с регулярной формой ДС от фенотипически нормальных отцов (без ДС) с низкоуровневым мозаицизмом по хромосоме 21, выявленным после рождения больного ребенка [49], а также рождение умственно отсталой дочери с мозаичной формой ДС от отца с мозаичной формой трисомии 21 [50] (табл. 3).
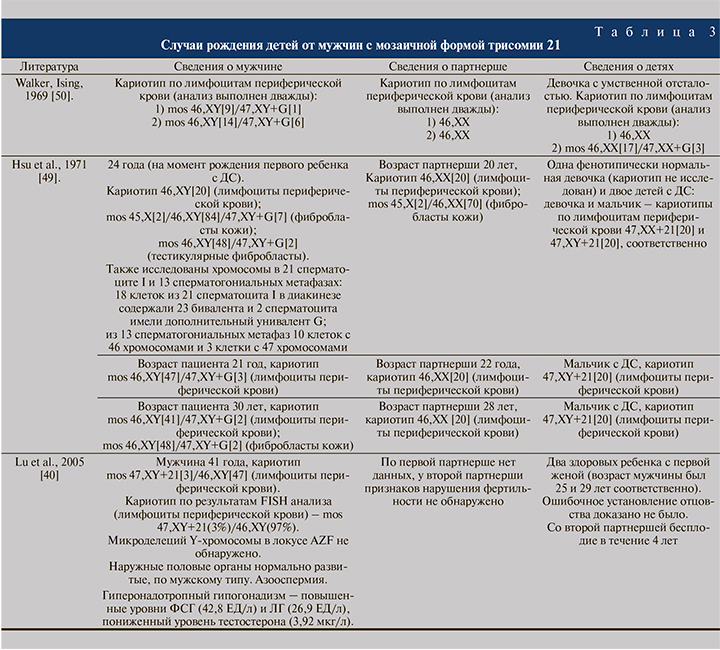
При анализе рождаемости от мужчин с трисомией 21 следует учитывать и медико-социальные факторы. Одной из причин редких сообщений об отцовстве пациентов с ДС может быть то, что в отличие от женщин, чье материнство всегда очевидно, отцовство мужчин с ДС может быть не установлено. Мужчины с ДС и тяжелой формой умственной отсталости не могут полноценно выполнять родительские функции, поэтому не исключено, что их партнерши могут быть не заинтересованы в официальном оформлении отцовства или не способны это сделать в силу умственной отсталости. Многие аспекты нарушения фертильности и сперматогенеза при ДС до настоящего времени остаются неясны. Несмотря на сообщения о рождении здоровых детей от мужчин с ДС, не следует недооценивать риск рождения ребенка с трисомией 21. Случаи рождения больных детей от мужчин с ДС имели место (табл. 3), и, вероятно, не все описаны в литературе.
Синдром Дауна характеризуется множественными врожденными аномалиями, в том числе нарушением развития и функции органов репродуктивной системы. У большинства мужчин с ДС отмечают первичное бесплодие вследствие азооспермии или олигозооспермии. Негативными факторами, влияющими на фертильность, при этом могут быть гипергонадотропный гипогонадизм и другие гормональные изменения, а также связанные с ними нарушение сперматогенеза, снижение сексуальной активности и либидо, отсутствие эрекции и эякуляции. Мужчины с ДС с сохранным или частично сохранным сперматогенезом могут быть фертильны. В связи с тем, что мнение о стерильности мужчин с ДС широко распространено, необходимо информирование врачей различных специальностей о возможной сохранности репродуктивной функции пациентов с ДС. Мальчики-подростки и мужчины с ДС нуждаются в обязательном наблюдении уролога-андролога. Пациенты, их родители и опекуны должны быть проинформированы о возможности наступления беременности и способах контрацепции. Этические проблемы рождения и воспитания детей от пациентов с ДС требуют отдельного рассмотрения.



