Мочекаменная болезнь (МКБ; уролитиаз) – полиэтиологическое заболевание, характеризующееся образованием одного или нескольких камней в почках и/или других отделах мочевых путей.
Люди страдают этим заболеванием с древнейших времен. Первый документально подтвержденный случай МКБ относится к эпохе додинастического Египта. С 1960-х гг. отмечается практически постоянный рост заболеваемости и распространенности МКБ во всем мире. По данным Министерства здравоохранения Российской Федерации, абсолютное число зарегистрированных пациентов с МКБ в РФ в 2016 г. составило 877 022 человека, показатель числа зарегистрированных больных на 100 тыс. всего населения – 598,5 [1]. Имеющиеся данные [2] свидетельствуют о том, что с 2003 по 2016 г. общее число пациентов с МКБ в России увеличилось на 37%, прирост же показателя на 100 тыс. населения составил 35%. В США, согласно данным National Health and Nutrition Examination Survey, по состоянию на 2012 г. нефролитиаз диагностирован у 10,6% мужчин и 7,1% женщин. Частота этого заболевания с 1994 г. увеличилась на 59% у мужчин и на 58% у женщин [3]. Большинство специалистов придерживаются гипотезы о связи данного факта с увеличением продолжительности и изменением образа жизни, приводящих к повышению встречаемости различных метаболических расстройств, сопровождающихся нарушением фосфорно-кальциевого и пуринового обмена. Немаловажное место отводится также высокобелковой диете с избыточным количеством натрия, характерной для большинства высокоиндустриальных стран, снижению количества употребляемой жидкости и кальция [4].
В общей урологической заболеваемости МКБ занимает 3-е место после воспалительных заболеваний мочевых путей и болезней простаты, в 2015 г. в Российской Федерации на долю МКБ пришлось 22% случаев обращения пациентов за урологической помощью. В структуре «госпитализированной» урологической заболеваемости доля МКБ достигает 30–40% [5].
Уратный нефролитиаз (УН) – один из видов МКБ, характеризующийся образованием в почках камней, состоящих из мочевой кислоты (МК) или ее солей: безводная МК, дигидрат МК, урат натрия, урат аммония. В подавляющем большинстве случаев уратные конкременты состоят из безводной МК или дигидрата МК. Камни, состоящие из урата аммония, в индустриально развитых странах встречаются менее чем в 1% случаев [6–8], их возникновение связано с наличием инфекции мочевых путей, мальабсорбцией (воспалительные заболевания кишечника, наличие илеостомы, злоупотребление слабительными), гипокалиемией или недоеданием. Однако в развивающихся странах существуют районы, эндемичные по образования камней, состоящих из урата аммония, в мочевом пузыре у детей [9]. С учетом различия в патогенезе в настоящее время большинство авторов не относят камни, состоящие из урата аммония, к уратным.
Доля УН в структуре МКБ варьируется от 0,95% в Индии [10] до 37,7% в Иране [11]. Для лиц, проживающих в индустриально развитых странах, производные МК являются 2–3-м по встречаемости камнеобразующим веществом. Во Франции уратные камни обнаруживаются в 7,8% случаев у мужчин и в 4,9% случаев у женщин [12], в США – в 8% случаев всех пациентов, которым впервые был выполнен анализ конкремента, при этом у мужчин – практически в 2 раза чаще, чем у женщин (10,3 и 5,5% соответственно) [13], в Германии – у 11,7% мужчин и у 7% женщин [14].
Необходимо отметить, что в отличие от конкрементов другого химического состава, которые преимущественно встречаются в возрасте 40–49 лет у мужчин и 30–39 лет у женщин [12], показатель встречаемости УН находится в прямой зависимости от возраста [3, 12, 13]. У пациентов моложе 30 лет на долю уратных конкрементов приходится менее 2%, этот показатель возрастает до 11,6% к 50–59 годам, достигает 20,3% в возрасте 60–69 лет, составляет 29,4% в возрасте 70–79 лет и превышает 40% у мужчин в возрасте старше 80 лет. У женщин также отмечается прирост встречаемости УН от 0% в возрасте 10–19 лет до 27,3% у пациенток старше 90 лет [12].
Кроме того, выявлена четкая взаимосвязь между частотой развития УН и избыточной массой тела. Доля уратных камней у мужчин повышается с 7,1 до 11,3 и 28,7% при сравнении пациентов с нормальным ИМТ (˂25 кг/м2), избыточной массой тела и лиц, страдающих ожирением (ИМТ ≥30 кг/м2).
У женщин те же показатели составляют 6,1, 12,7 и 17,1% соответственно. Полученные данные свидетельствуют: ИМТ и возраст – независимые факторы риска развития УН. В возрастной категории младше 60 лет частота УН в большей степени связана с ИМТ, в то же время в более старшей возрастной группе риск возникновения уратных конкрементов повышается прямо пропорционально возрасту [15]. Повышение частоты выявления уратных конкрементов также отмечается при метаболическом синдроме (34%) [16], сахарном диабете 2 типа (36%) [17] и подагре (52,2%) [18].
Мочевая кислота – это гетероциклическое соединение, имеющее химическую формулу С5H4N4O3, которое у человека служит конечным продуктом катаболизма пуриновых нуклеотидов. В обобщенном виде каскад биохимических реакций, приводящих к образованию МК, представлен на рис. 1 [19].
Первооткрывателем МК является шведский химик Carl Wilhelm Scheele, который в 1776–1780 гг. впервые выявил это вещество в составе мочевых камней, назвал его каменной кислотой и описал в своей статье «Examen chemicum calculi urinarii» [20–23]. Несколько позднее французские ученые Antoine François de Fourcroy и Louis-Nicolas Vauquelin, исследовав более 600 мочевых камней, извлеченных из людей и животных, выявили, что все они в той или иной концентрации включают в свой состав вещество, описанное С. Scheele. Именно A. Fourcroy предложил термин «мочевая кислота», используемый и по сей день [23]. Эмпирическую формулу МК установил в XVIII в. немецкий химик Justus von Liebig, а правильную структуру – другой немецкий ученый, Hermann Emil Fischer.

Существует три основных источника пуриновых нуклеотидов в организме человека: пурины, синтезируемые de novo; освобождающиеся при тканевом распаде и поступающие с пищей [24]. В нормальных условиях продукция МК составляет 300–400 мг/сут, на долю пуриновых нуклеотидов, потребляемых с пищей, приходится менее 50% [23]. Из организма человека МК выводится преимущественно почками (70%) и в меньшей степени – через желудочно-кишечный тракт.
Почечный транспорт МК реализуется через четыре этапа: фильтрация, реабсорбция, секреция и постсекреторная реабсорбция [25, 26]. За исключением 5%, связанных с белками, плазменные ураты полностью фильтруются в клубочках. 98–100% отфильтрованной МК реабсорбируются в проксимальных почечных канальцах, 50% подвергаются последующей секреции. Постсекреторная реабсорбция может происходить как в конечных отделах проксимальных почечных канальцев, так и в дистальных трубочках. В конечном итоге почками экскретируется менее 20% отфильтрованной в клубочках МК.
Еще Гиппократ и Гален обратили внимание на наличие у больных артралгиями и подагрическими тофусами камней в почках и мочевом пузыре и предполагали патогенетическую связь этих заболеваний. В XVII в. основоположник английской медицины Thomas Sydenham впервые предположил, что к образованию камней в почках ведет увеличение экскреции с мочой камнеобразующих веществ. В своей статье «Tractatus de podagra et hydrope» он писал: «Подагра ведет к образованию камней в почках либо вследствие того, что пациент обязан долго лежать на спине, либо потому, что органы секреции прекратили свою корректную функцию, либо из-за того, что камень образован из части того же болезненного вещества» [18].
 В 1967 г. A. Gutman впервые научно обосновал взаимосвязь развития уратного нефролитиаза с гиперурикемией, гиперурикозурией и низким pH мочи у пациентов с подагрой [27]. Данные этого исследования очень быстро приобрели популярность, и на протяжении длительного времени развитие УН напрямую связывали с нарушением пуринового обмена, а наиболее значимым фактором риска развития уратного нефролитиаза считалась гиперурикозурия, связанная с повышенным потреблением в пищу пуринов [11].
В 1967 г. A. Gutman впервые научно обосновал взаимосвязь развития уратного нефролитиаза с гиперурикемией, гиперурикозурией и низким pH мочи у пациентов с подагрой [27]. Данные этого исследования очень быстро приобрели популярность, и на протяжении длительного времени развитие УН напрямую связывали с нарушением пуринового обмена, а наиболее значимым фактором риска развития уратного нефролитиаза считалась гиперурикозурия, связанная с повышенным потреблением в пищу пуринов [11].
К этиопатогенетическим факторам, повышающим риск развития УН, были отнесены следующие состояния и заболевания [23]:
- врожденные:
- заболевания, сопровождающиеся гиперпродукцией МК (дефицит гипоксантингуанинфосфорибозилтрансферазы – синдром Леша–Нихана, суперактивность фосфорибозилпирофосфатсинтетазы, дефицит глюкозо-6-фосфатазы – болезнь Гирке);
- дефекты почечного транспортера МК (наследственная гипоурикемия с гиперурикозурией);
- приобретенные:
- снижение объема выделяемой мочи (дегидратация, хроническая диарея);
- заболевания и состояния, сопровождающиеся повышенным поступлением/образованием МК в организме (миело- и лимфопролиферативные заболевания, другие злокачественные новообразования, особенно в период химио- и лучевой терапии, болезни крови – гемолитическая анемия, истинная полицитемия, диета, богатая белками животного происхождения);
- прием лекарственных средств с урикозурическим действием (пробеницид, высокие дозы ацетилсалициловой кислоты, радиоактивные вещества).
В 2000-х гг. основы патогенеза УН претерпели значительные изменения. Причиной послужили многочисленные исследования, свидетельствующие об отсутствии корреляции между гиперурикозурией и вероятностью развития уратных конкрементов [28–30], а также патогенетическое обоснование взаимосвязи стойко кислой pH мочи с дефектом аммониогенеза, характерного для большинства заболеваний, сопровождающихся высоким риском развития УН [31].
В настоящее время наиболее важными эндогенными предпосылками образования уратных камней по мере значимости считаются стойко кислая pH мочи, гиперурикозурия и снижение темпов диуреза.
Современная медицина располагает большим арсеналом консервативных, оперативных и комбинированных методов лечения нефролитиаза.
Выбор метода лечения при МКБ зависит от многих факторов, которые условно можно разделить на четыре группы:
- связанные с камнем (локализация, размеры, состав, наличие и длительность обструкции);
- клинические (выраженность симптоматики, ожидания пациента, инфекционные осложнения, ожирение, коагулопатия, артериальная гипертония, единственная почка);
- анатомические (подковообразная почка, стеноз лоханочно-мочеточникового сегмента, эктопия почки);
- технические (наличие оборудования, специалиста и стоимость лечения).
В век современных технологий основное место в лечении МКБ отводится таким малоинвазивным хирургическим методам, как дистанционная, чрескожная и ретроградная контактная литотрипсия. Лишь в отдельных ситуациях остаются актуальными лапароскопические и открытые литотомии.
При УН ограничения вышеуказанных методов лечения обусловлены рентгеннегативностью данных конкрементов, что затрудняет как фокусировку ударной волны при дистанционной литотрипсии, особенно при локализации конкрементов в мочеточнике, так и контроль эффективности выполненных вмешательств.
В то же время уратный уролитиаз является единственной формой МКБ, при которой возможна консервативная литолитическая терапия, позволяющая избегать оперативного лечения. Еще в 1955 г. H. Eisenberg предложил хорошо переносимую пациентами смесь цитрата натрия, калия и лимонной кислоты, которую можно было бы принимать для лечения УН [32]. Результаты первых клинических исследований, сообщающих об эффективности цитратной терапии в лечении уратных камней почек, представлены в 1970-х гг. [33, 34]. В 1995 г. Ю. А. Пытелем и И. И. Золотаревым опубликована монография, обобщающая знания по патогенезу, диагностике и лечению УН, остающаяся актуальной и по сей день [4].
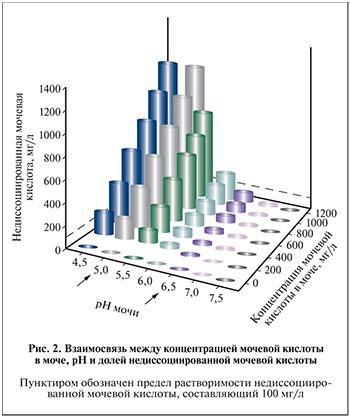
Возможность применения цитратных препаратов для растворения МК обусловлена особенностями этого вещества. По своим химическим свойствам МК является слабой органической двухосновной кислотой с pKa1 5,4. При pH 7,4, характерном для крови, практически вся МК находится в форме кислого урата натрия, который обладает хорошей растворимостью. В моче уровень pH может варьироваться в широких пределах. Смещение pH в кислую сторону приводит к резкому увеличению пропорции недиссоциированной МК, обладающей плохой растворимостью. Зависимость концентрации недиссоциированной МК от pH мочи представлена на рис. 2 [35].
Поддержка кислотно-щелочного равновесия – одна из основных функций почек. Этот процесс осуществляется за счет регулируемого выделения с мочой ионов HCO3, H+ и нелетучих кислот. Очевидно, что pH окончательной мочи зависит от количества в ней ионов водорода.
В норме интенсивность канальцевой секреции ионов H+ практически полностью соответствует фильтрации ионов HCO3- с небольшим избытком первых, необходимым для удаления из организма нелетучих кислот. Основной механизм коррекции почками кислотно-щелочного равновесия заключается в неполном титровании H+ и HCO3- с удалением избыточно содержащихся ионов с мочой. Необходимо отметить, что лишь небольшое количество ионов H+ выделяется в окончательную мочу в свободном состоянии. Основное количество ионов водорода связывается в канальцах с буферными системами, что позволяет поддерживать pH мочи стабильным без выраженного в случае необходимости увеличения диуреза.
В моче существует две основные буферные системы, способные связывать избыток протонов и поддерживать pH мочи: фосфатная и аммониевая.
pК фосфатной буферной системы составляет 6,8. При таком значении pH мочи, являющемся физиологическим, создаются наиболее благоприятные условия для ее функционирования в почечных канальцах. Однако с учетом небольшой емкости данной буферной системы при ацидозе и тенденции к смещению pH в кислую сторону основную роль в элиминации ионов водорода берет на себя аммониевый буфер.
Действие аммониевого буфера условно можно разделить на два этапа:
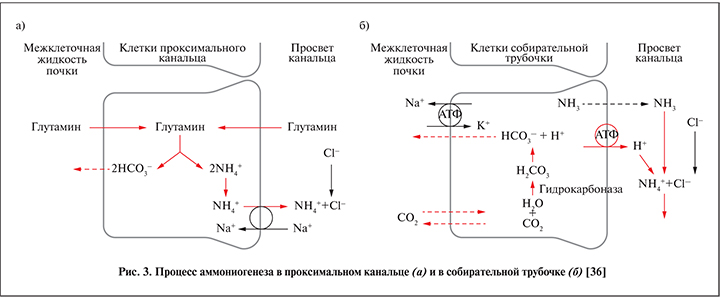
- В клетках проксимальных канальцев происходит расщепление глутамина, синтезированного в печени. В результате этой реакции образуется эквивалентное количество ионов аммония и бикарбоната. Первые секретируются в просвет почечных канальцев, вторые реабсорбируются в плазму, восстанавливая дефицит оснований.
- В собирательных трубочках диффундирующий в их просвет аммиак реагирует с избытком ионов водорода, полученный в результате аммоний экскретируется с мочой.
Этапы аммониогенеза в схематическом виде представлены на рис. 3 [36].
Одной из наиболее важных характеристик аммониевого буфера является его большая емкость. Именно эта система ответственна за поддержание кислотно-щелочного равновесия при хроническом ацидозе за счет повышенного выделения ионов аммония.
В 2002 г. K. Sakhaee впервые убедительно показал, что у пациентов с нормоурикозурическим УН имеется дефект почечного аммониогенеза, который может способствовать поддержанию стойко кислой pH мочи [31]. Схожие изменения выявлены у пациентов с метаболическим синдромом [37] и сахарным диабетом 2 типа [38], риск развития УН у которых повышен. Однако в эксперименте доказано, что выраженность этого дефекта у пациентов, не страдающих МКБ, ниже [39]. Взаимосвязь этих заболеваний может быть обусловлена влиянием инсулина на продукцию ионов аммония в проксимальных почечных канальцах, доказанным in vitro [40, 41]. Подтверждают этот факт и результаты исследования N. Abate, опубликованные в 2004 г., согласно которым выявлено, что при инсулинорезистентности отмечается стойко кислая pH мочи и именно инсулинорезистентность вносит существенный вклад, но не до конца объясняет кислую pH мочи у пациентов с УН [37].
Причины и уровень нарушения, приводящие к дефекту аммониогенеза, на сегодняшний день еще окончательно не установлены. Результаты исследований на животных и клеточных культурах позволяют предположить, что причиной дефекта аммониогенеза и экскреции аммония служит почечный стеатоз проксимальных канальцев [42, 43].
Действие цитратных смесей при УН обусловлено смещением pH мочи в щелочную сторону, что приводит к переходу МК в форму хорошо растворимого кислого урата натрия и литолизу имеющегося конкремента.
Механизм подщелачивающего действия обусловлен двумя факторами:
- Цитраты в организме метаболизируются в бикарбонат и выступают в качестве системных подщелачивающих средств;
- Выделяясь в неизменном виде с мочой, цитраты становятся дополнительной буферной системой, способствующей связыванию избытка ионов водорода и смещению pH в щелочную сторону.
В настоящее время применение цитратных препаратов рекомендовано в качестве терапии «первой линии» при лечении пациентов с уратными камнями почек на фоне ненарушенного или восстановленного оттока мочи [8]. Помимо высокой эффективности и незначительной стоимости данный вид лечения характеризуется низкой частотой развития осложнений, что особенно актуально для пациентов с УН, которые, как правило, относятся к старшей возрастной категории с большим спектром интеркуррентных заболеваний. В то же время указания о целесообразности проведения литолиза при уратных камнях мочеточников в современных клинических рекомендациях отсутствуют, о возможности данной терапии сообщается лишь в единичных публикациях [44–48]; предоставленные данные носят противоречивый характер. Имеются также свидетельства более высокой вероятности отхождения рент-
геннегативных камней нижней трети мочеточника при терапии α-адреноблокаторами в случае дополнительного назначения цитратных препаратов [49].
На сегодняшний день в Российской Федерации зарегистрирован цитратный препарат Блемарен® компании «Эспарма ГмбХ». Каждая таблетка данного лекарственного средства содержит 1197 мг лимонной кислоты, 967,5 мг калия гидрокорбаната и 835,5 мг натрия цитрата.
Согласно рекомендациям, показаниями к применению Блемарена® являются:
- растворение уратных камней и предупреждение их образования;
- растворение смешанных уратно-оксалатных камней (при содержании оксалатов менее 25%);
- подщелачивание мочи у лиц, получающих цитостатики или препараты, повышающие выведение мочевой кислоты.
Противопоказаниями к назначению препарата служат:
- гиперчувствительность;
- острая и хроническая почечная недостаточность;
- метаболический алкалоз;
- инфекции мочевыводящих путей, вызванные микроорганизмами, расщепляющими мочевину;
- рН мочи выше 7;
- необходимость соблюдения строгой бессолевой диеты (например, при тяжелых формах артериальной гипертензии).
Блемарен® необходимо принимать 3 раза в сутки после приема еды с обязательным предварительным измерением pH мочи, осуществляемым посредством специальных индикаторных полосок, прилагаемых к препарату. Доза подбирается таким образом, чтобы рН мочи в утреннее, дневное и вечернее время составляла 6,8–7,2, так как именно эти значения рН наиболее оптимальны для растворения уратных камней (более сильное подщелачивание мочи может приводить к образованию нерастворимых фосфатных камней).
Контроль эффективности осуществляется не ранее, чем через 1 мес. Учитывая рентгеннегативный характер данных конкрементов, наиболее оптимальным методом оценки является компьютерная томография без контрастного усиления.



