Введение. Среди исследователей продолжает доминировать следующая точка: моча человека служит стерильной средой, и отрицательный результат культурального исследования мочи свидетельствует о «здоровье» мочевого тракта [1–3]. В то же время в последнее десятилетие формируется новая парадигма, согласно которой моча каждого человека имеет свой индивидуальный спектр микробиоты и виробиоты [4, 5]. Этому способствует ряд факторов, в частности применение расширенного спектра методик культурального исследования мочи, MALDI-TOF масс-спектрометрии, молекулярно-биологических и метагеномных подходов, таких как ПЦР с обратной транскриптазой или в режиме реального времени, 454 пиросеквенирования гена 16S-рРНК и др. [6, 7].
Исследования микробиома и микробиоты мочи показали, что в мочевом тракте присутствуют разнообразные бактериальные сообщества, в том числе Lactobacillus spp., Bifidobacterium spp., Actinomyces spp., Enterococcus spp., Streptococcus spp., Corynebacterium spp., E. coli, Staphylococcus spp., Aerococcus spp., Gardnerella spp., Ureaplasma spp., Actinobaculum spp. и др. [8, 9]. D. E. Nelson и et al. [10] в моче сексуально активных мужчин обнаружили различные таксоны микроорганизмов, в частности Sneathia spp., Gemella spp., Aerococcus spp., Anaerococcus spp., Prevotella spp. и Veillonella spp., которые имели корреляцию с микробным спектром при инфекциях, передающихся половым путем (ИППП). Вместе с тем данные литературы о вирусных уропатогенах разрозненны и не систематизированы. Время от времени появляются сообщения о наличии аденовирусов, герпесвирусов, ВК- и JC-полиомавирусов в моче лиц с ослабленным иммунитетом и после трансплантации костного мозга при развитии у них геморрагического цистита [11, 12]. В ряде работ обсуждается роль вирусов папилломы человека (HPV), аденовирусов, а также вирусов простого герпеса 1-го и 2-го типов (HSV 1, 2) в генезе рецидивирующей инфекции нижних мочевыводящих путей [13–15]. Для понимания роли вирусных и бактериальных патогенов при инфекционно-воспалительных поражениях органов мочевой системы необходимы знания о бактериальном и вирусном спектрах мочи здоровых людей.
Цель исследования: определить встречаемость представителей условно-патогенной бактериальной флоры и вирусных патогенов в моче здоровых людей с установлением взаимосвязи между ними.
Материалы и методы. Обследованы 40 здоровых сексуально активных женщин (n=19) и мужчин (n=21) в возрасте от 20 до 25 лет (средний возраст – 22,4±1,2 года). Критерии включения в исследование: возраст до 25 лет, отсутствие гинекологических заболеваний (в группе женщин), урологических заболеваний в обеих группах; формально нормативные показатели общего анализа крови и мочи, согласие на участие в исследовании. Наличие ИППП как в анамнезе, так и на момент исследования, отсутствие инфекционных, генетических, соматических заболеваний, различных факторов риска (радиоактивное облучение и т.д.), патологических изменений почек и мочевой системы, внутренних половых органов при УЗИ, прием различных препаратов (антибиотиков, кортикостероидов), а также противозачаточных (в группе женщин) за 2 мес. до забора мочи – все это было критериями невключения в исследование. Из исследования также исключали мужчин с ранее диагностированным крипторхизмом и орхитом.
На исследование забирали среднюю порцию утренней мочи после соответствующей гигиенической процедуры при самостоятельном мочеиспускании обследуемых в стерильный пластиковый контейнер («HiMedia»). Пробы мочи кодировали идентификационным номером и разделяли на 3 аликвоты: 1 – для проведения общего анализа мочи, 2 – для бактериологического исследования мочи, 3 – для проведения ПЦР. Бактериологическое исследование мочи проводили в соответствии с Клиническими рекомендациями («Бактериологический анализ мочи», 2014) [16]. Помимо питательных сред, регламентированных Клиническими рекомендациями, использовали дополнительные хромогенные среды «HiMedia» для культивирования факультативно-анаэробных (ФАБ) и неклостридиальных анаэробных бактерий (НАБ). Соответственно, использовали аэробные и анаэробные условия культивирования. Идентификацию выделенных микроорганизмов проводили по общепринятым признакам (морфотинкториальным, культуральным, биохимическим).
Определение вирусов осуществляли методом ПЦР с детекцией в режиме реального времени. ДНК выделяли сорбционным методом с использованием набора АмплиПрайм ДНК-сорб-В («НекстБио») из образцов мочи с предварительным концентрированием (центрифугирование 5 мин при 10000 g). Для выявления ДНК герпесвирусов человека типов 1, 2, 4, 5, 6, 7, 8 использовали наборы реагентов, такие как АмплиСенс® EBV (вирус Эпштейна–Барр)/CMV (цитомегаловирус)/HHV6-cкрин-FL (ФБУН ЦНИИЭ Роспотребнадзора), HSV1/HSV2/CMV ГерпесКомплекс, набор реагентов для выявления ДНК вируса герпеса человека 8-го типа (HHV8) («ДНК-технология»), Human Herpes virus 7 GenPak DNA-Fluo PCR test (НПФ «Генлаб»). С целью определения ДНК вируса папилломы человека (HPV 6, 11, 16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) использовали набор реагентов HPV квант-21 (ДНК-технология), ДНК Parvovirus B19 – набор АмплиСенс® Parvovirus B19-FL (ФБУН ЦНИИЭ Роспотребнадзора). Работы проводили в соответствии с методическими рекомендациями и инструкциями к перечисленным наборам реагентов, методическими указаниями МУ 1.3.2569-09 [17].
Статистическую обработку данных осуществляли с использованием пакета SPSS 23.0. Проводили расчет частот обнаружения микроорганизмов в абсолютных величинах и в процентном отношении, а также использовали описательную статистику (средние значения, медианы, моды, стандартные отклонения, минимальные и максимальные значения). Средние значения выделенных из мочи микроорганизмов представлены в виде квартилей. Для изучения связи частот обнаружения микроорганизмов с полом обследованных, а также микробов и вирусов использован коэффициент взаимной сопряженности (КВС). Значимость связей оценивали с помощью критерия χ2 на общепринятом уровне (p<0,05 и p<0,01).
Результаты. Во всех 40 случаях в моче обнаружена нормативная лейкоцитурия. Результаты бактериологического исследования мочи у здоровых мужчин и женщин во всех случаях выявили аэробно-анаэробные ассоциации.
В кластере аэробных таксонов (табл. 1) микробиоты доминировали коагулазоотрицательные стафилококки (CNS) и Corynebacterium spp. (72,5 и 55% соответственно). Спектр CNS был представлен пятью видами: S. epidermidis (30%), S. haemolyticus (27,5%), S. warneri (25%), S. saprophyticus и S. lentus (по 15%). Enterococcus spp. регистрировали в моче в 32,5% случаев. Чаще из мочи выделяли E. faecalis (27,5%), в единичных случаях – E. faecium (5%). Семейство Enterobacteriaceae было представлено 4 таксонами: E. coli (10%), Klebsiella spp., Proteus spp. (по 5%), Enterobacter spp., Citrobacter spp. (по 2,5%). Таким образом, суммарно энтеробактерии определялись в моче у 25% здоровых мужчин и женщин.

В кластере анаэробных бактерий в моче преобладали Eubacterium spp. (60%), и практически у половины здоровых лиц были выявлены Lactobacillus spp. и Peptococcus spp. (по 42,5%).Средний уровень бактериурии для подавляющего большинства родов микроорганизмов составил 102 КОЕ/мл, за исключением Citrobacter spp. и Prevotella spp. (≥103 КОЕ/мл). Однако для 7 таксонов верхний квартиль показателя бактериурии был ≥103 КОЕ/мл (табл. 2).

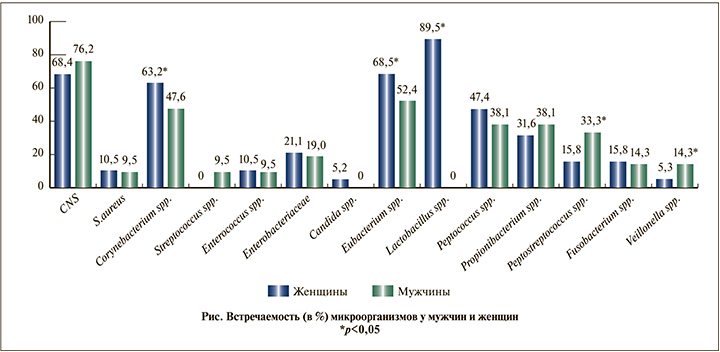
При анализе частот обнаружения различных таксонов микробиоты установлено, что у женщин достоверно чаще (p<0,05) в моче регистрировали Corynebacterium spp., Eubacterium spp. и Lactobacillus spp. (см. рисунок).
У мужчин в моче значимо (p<0,05) чаще присутствовали Peptostreptococcus spp., Veillonella spp.
У здоровых людей в моче были обнаружены HHV6 (10%), HPV18 и парвовирусы B19 (по 2,5%). Необходимо отметить, что изучаемые вирусы чаще регистрировали у мужчин, в частности HPV18 и парвовирус В19 – только у мужчин, HHV6 – чаще у мужчин (7,5%), чем у женщин (2,5%).
Был проведен анализ с целью выявления связи наличия определенных таксонов микроорганизмов, верифицированных в моче, с полом обследованных. Значимые связи установлены для E. faecalis (КВС=0,360, p=0,04) и Lactobacillus spp. (КВС=0,450, p=0,04), которые чаще обнаруживали в моче здоровых женщин.
Интересным представлялся вопрос о взаимосвязи между частотами обнаружения бактерий и вирусов в моче. Значимые взаимосвязи получены для трех таксонов: Bacteroides spp., Bifidobacterium spp., Prevotella spp. (КВС=0,356, p<0,05) с HPV18, HPV6 и парвовирусом В19.
Таким образом, при наличии в моче Bacteroides spp., Bifidobacterium spp., Prevotella spp. определялись HPV6, HPV18 и парвовирусы B19 (16,7%). Соответственно, в 83,3% случаев данные вирусы обнаруживали в отсутствие в моче вышеперечисленных таксонов микроорганизмов.
Обсуждение. Биотопы макроорганизма, в частности кожные покровы, ротовая полость, кишечник, мочевой пузырь, влагалище и др., а также различные биологические среды, в том числе моча, характеризуются уникальными микро- и виробиотой [5, 18]. В процессе эволюции между ними сложились определенные взаимоотношения, которые играют важную роль в поддержании здоровья человека, в формировании врожденного, гуморального и клеточного иммунитета, а при их нарушении возникают различные патологические состояния [19, 20]. Для характеристики качественного и количественного состава микробиома и/или микробиоты, а также вирома мочи исследователи используют такие методы, как секвенирование генома методом дробовика; 454 пиросеквенирования гена 16S рРНК или 16S рДНК; ПЦР в режиме реального времени и расширенные методики культивирования в аэробных и анаэробных условиях [7, 21, 22]. В нашей работе при использовании расширенного культурального исследования в моче здоровых мужчин и женщин обнаружено 27 родов и/или видов микроорганизмов с доминированием CNS (72,5%), Corynebacterium spp. (55%), Eubacterium spp. (60%). С помощью ПЦР средней порции мочи у мужчин и женщин обнаруживали HPV18, парвовирус В19 и HHV6, которые встречались в 2,5 и 10% случаев соответственно.
В проведенных нами ранее исследованиях мы также обнаруживали вирусо-бактериальные ассоциации, где наряду с НАБ и CNS в моче здоровых людей у женщин определяли ДНК HPV и HSV2, у мужчин – только HPV [23], в моче пациентов с неосложненной рецидивирующей инфекцией нижних мочевых путей – ДНК EBV, HPV53, CMV и HHV6 [24].
Наличие в моче вирусных агентов у здоровых лиц без нарушения иммунитета было продемонстрировано в ряде исследований. N. Arora et al. [25] показали, что у здоровых молодых серопозитивных женщин ДНК CMV встречалась в образцах как мочи, так и крови в 83 и 52% случаев соответственно. H. Boukoum et al. [26] в моче иммунокомпетентных здоровых людей ДНК BK- и JC-полиомавируса обнаруживали в 6 и 13% случаев соответственно. В работе S. H. Lee et al. [27] при использовании ПЦР в режиме реального времени показано, что в контрольной группе здоровых людей вирурия, вызванная полиомавирусами, встречалась чаще (90,3%), чем у пациентов с гематурией. При метагеномном секвенировании генов 16S рДНК A. Moustafa et al. [28] обнаружили гендерные различия в микробиомах мочи: у женщин преобладали Lactobacillus spp. и Prevotella spp., у мужчин наибольшее число прочтений последовательностей соответствовало Enterococcus spp. и Pseudomonas spp. Также они идентифицировали 6 различных вирусов (HPV, вирус контагиозного моллюска, HHV6, Anellovirus, ВК и JC-полиомавирусы) в образцах мочи как здоровых людей, так и лиц с проявлениями ИМП. T. M. Santiago-Rodriguez et al. [5], используя вирусную метагеномику и количественную ПЦР, показали, что виром мочи наряду c бактериофагами в литическом цикле на 95% представлен генотипами HPV низкого риска. При использовании полногеномного секвенирования мочи пациентов после трансплантации почки с последующим биоинформационным анализом полученных данных A. Rani et al.. [29] наряду с ВК-полиомавирусом определяли подтипы Anelloviridae в 53% случаев, затем адено- и папилломавирусы, которые встречались в 37 и 33% наблюдений соответственно, представители семейства Herpesviridae – у 15% пациентов. Проведя метагеномное секвенирование микробиома мочи, используя инструмент virMine для биоинформационного анализа, A. Garretto et al. [30] показали, что в моче 10 здоровых женщин и 20 женщин с гиперактивным мочевым пузырем присутствовали различные бактериофаги и эукариотический JC-полиомавирус.
В нашем исследовании при анализе взаимосвязи между показателями встречаемости бактерий и вирусов обнаружено, что в отсутствие Bacteroides spp., Bifidumbacterium spp. и Prevotella spp. HHV6, парвовирус В19 и HPV18 встречались чаще, чем при наличии указанных микроорганизмов.
Полученные данные могут свидетельствовать: между определенными членами микро- и виробиоты могут существовать реципрокные взаимоотношения, которые опосредуются иммунными реакциями организма хозяина, что может усиливать или ослаблять вирулентные свойства патогенов. Например, пробиотические бактерии L. casei и L. reuteri могут эффективно подавлять репликацию ротавирусов в энтероцитах человека [31]. Присутствующая в моче микробиота, возможно, стимулирует в уротелиальных клетках синтез дефензинов, которые обладают противовирусной активностью и тем самым сдерживают численность вирусной популяции. В экспериментальном исследовании на культуре клеток Hela показано, что альфа-дефензин-5 человека может подавлять репликацию адено-, папиллома- и полиомавирусов [32]. W. Gao et al. [33], проанализировав микробиом влагалища 70 здоровых женщин, установили, что Lactobacillus gasseri значительно чаще встречалась у женщин с HPV, подчеркнув, что вагинальная микробиота более сложно устроена у HPV-позитивных женщин.
Ограничением исследования можно считать небольшой объем выборки пациентов и узкий спектр изучаемых вирусов, что в последующем может быть скорректировано расширением методики вирусологического анализа.
Заключение. Микробиота мочи в норме здоровых женщин и мужчин имеет различия: у мужчин в моче отсутствуют Lactobacillus spp. и Candida spp., у женщин – Streptococcus spp. В моче здоровых людей регистрируют HHV6, HPV18, парвовирусы B19, причем чаще у мужчин. Данные о виро- и микробиоте мочи у здоровых людей могут пролить свет на патогенез инфекций мочевых путей различной локализации и разработать направленные подходы к персонализированной терапии данной группы заболеваний.



