Мочекаменной болезнью (МКБ) страдает от 1 до 15% населения, при этом в 70% случаев основной минералогической фазой камней являются гидраты оксалата кальция [1–4]. Применяемые в клинике методы диагностики МКБ редко позволяют установить причины камнеобразования, поскольку анализ ключевых биохимических показателей мочи, таких как ионы кальция, оксалат- и особенно цитрат-ионы, обычно не проводится. Несмотря на то что важность определения суточной экскреции цитратов для успешного лечения МКБ подтверждена множеством исследований [4–6], уровень цитрат-ионов в моче у пациентов определяется крайне редко. При этом известно, что от 20 до 70% пациентов с мочевыми камнями страдают гипоцитратурией [5, 6]. Более того, проведенные нами недавно исследования с участием 30 пациентов с кальций-оксалатным уролитиазом показали, что гипоцитратурия (суточная экскреция цитратов меньше 2,5 ммоль [6]) имеет место почти в 90% наблюдений [7], в то время как гипероксалурия (суточная экскреция оксалатов больше 0,5 ммоль [6]) – лишь в 30%. Очевидно, что нормализация суточной экскреции цитратов, особенно у пациентов с рецидивирующими кальциевыми камнями, должна быть неотъемлемой частью и целью метафилактического лечения.
Приводим собственное клиническое наблюдение.

П а ц и е н т к а И. 29 лет. Из анамнеза известно, что за последние 3 года было три эпизода камнеобразования. Выписана из стационара в январе 2014 г. после удаления камня из нижней трети мочеточника; по данным рентгенологических и ультразвуковых исследований в обеих почках оставалось 3 резидуальных фрагмента размером от 3 до 7 мм. Проведенный количественный рентгенофазовый анализ камня (дифрактометр Bruker D 8 Advance, медное излучение λ=0,71 нм) показал, что исследуемый образец состоит из смеси гидратов оксалата кальция (дигидрат 87 и моногидрат 11 масс.% соответственно) и небольшой примеси в виде 2 масс.% дигидрата мочевой кислоты (рис. 1). Основным компонентом камня является дигидрат оксалата кальция, что обычно бывает при ощутимом пересыщении мочи в присутствиии ингибиторов камнеобразования, приводящем к быстрому росту конкремента [8]. Наиболее вероятной причиной образования таких конкрементов считается гиперкальциурия [8, 9]. Таким образом, для выявления метаболических нарушений необходимо было определить суточную экскрецию ионов кальция и магния, оксалат- и цитрат-ионов, мочевой кислоты, а также исследовать рН-профиль мочи, поскольку камень содержал дигидрат мочевой кислоты [10]. Содержание ионов кальция, магния и мочевой кислоты определяли по стандартным методикам на базе лаборатории «СИТИЛАБ». Оксалаты и цитраты определяли ферментативным методом с использованием аттестованных в Минздраве РФ наборов, производимых ООО «Импакт» (Москва), с точностью±10%. Измерения рН мочи проводили непосредственно после мочеиспускания с помощью карманных рН-метров рН-009(I) (RoHS) с точностью±0,1, которые были откалиброваны по стандартным буферным растворам.
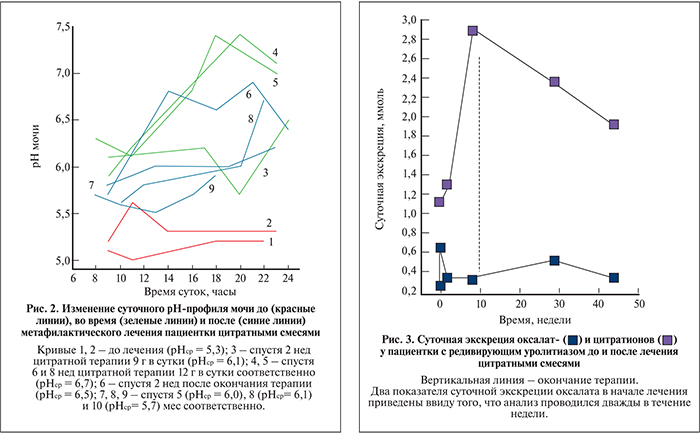
Анализ рН-профиля мочи показал, что у пациентки имел место выраженный мочекислый диатез (суточный профиль рН≤5,8 [4]). Именно это и послужило причиной совместного осаждения гидратов оксалата кальция и дигидрата мочевой кислоты, несмотря на то что суточная экскреция уратов много ниже порогового значения (см. таблицу). За исключением низкой экскреции цитратов, остальные биохимические показатели мочи соответствовали норме. Следовательно, гиперкальциурия как главная причина образования камней из дигидрата оксалата кальция [8, 9] в данном случае не нашла подтверждения. Результаты расчета индекса пересыщения мочи AP[CaOx] [11] и сопоставление ее с произведением растворимости оксалата кальция [12] указывают на существенное ее пересыщение и риск выпадения гидратов оксалата кальция вследствие недостаточного диуреза и низкого содержания цитратов. Назначенная для ощелачивания мочи и повышения экскреции цитратов терапия цитратными смесями (Блемарен) в количестве 9 г в сутки позволила через 2 нед повысить значения рН-мочи (рис. 2) и незначительно повысить суточную экскрецию цитратов (см. табл. и рис. 3). Повышение суточной дозы до 12 г и увеличение длительности приема позволиличерез 8 нед сместить рН-профиль мочи в нейтральную область, в 2,5 раза повысить содержание цитратов в моче и снизить значение AP[CaOx]. Выполненное спустя 10 нед УЗИ показало, что терапия на фоне усиленного питьевого режима (диурез – 2–2,5 л) позволила пациентке полностью избавиться от резидуальных фрагментов в обеих почках.

Как видно на рис. 3, прекращение метафилактического лечения обусловило постепенное уменьшение суточной экскреции цитратов, при этом экскреция оксалатов определялась исключительно особенностями диеты. Из таблицы видно, что даже спустя 8 мес величина AP[CaOx] была в 2 раза меньше исходного значения, указывая на снижение риска камнеобразования. Тем не менее проведенное спустя еще 2 мес УЗИ выявило наличие в обеих почках трех новых конкрементов размером 3–4 мм. Исследование мочи показало дальнейшее снижение суточной экскреции цитратов, уменьшение суточного диуреза (плотность мочи – 1,023 г/см3). Анкетирование выявило также частые нарушения диеты. Пациентке вновь был назначен 8-недельный курс цитратной терапии (9 г в сутки), «Цистон» по стандартной схеме, предписано соблюдать усиленный питьевой режим и строгую гипооксалатную диету. По окончании лечения УЗИ почек выявило лишь один конкремент диаметром 2–3 мм.
Заключение. Проведенные нами ранее [8] и представленные в настоящей работе исследования показывают, что у пациентов с рецидивирующим кальций-оксалатным уролитиазом следует:
- при биохимическом исследовании мочи определять суточную экскрецию цитратов;
- в случае выявления гипоцитратурии назначать курсовую терапию цитратными смесями длительностью не менее 8 нед;
- при обнаружении в камне минорных компонентов (мочевая кислота и ее производные, гидроксилапатит) исследовать рН-профиль мочи;
- соблюдать гипооксалатную диету и тщательно следить за поддержанием диуреза не менее 2–2,5 л;
- один раз в полгода проводить УЗИ почек.
Работа поддержана РФФИ, проект 15-44-03016-рег.



