Введение. Простатит – одна из наиболее распространенных нозологий в урологической практике и самое распространенное урологическое заболевание среди мужчин моложе 50 лет: 35–50% мужчин хотя бы один раз в жизни сообщали о симптомах нижних мочевых путей (СНМП), характерных для простатита; у 8–11% европейцев и 3–16% американцев простатит является рецидивирующим заболеванием. Распространенность хронического простатита (ХП), по данным российских авторов, еще выше – до 40% [1–8].
Характерными для простатита являются боли различной локализации и нарушения мочеиспускания: ослабление струи мочи, поллакиурия, ноктурия. Анализ международной базы данных по простатиту показал, что боль при этом локализуется в промежности (63%), яичках (58%), при эякуляции (45%), в лобковой области (42%) и на кончике пениса (32%); почти в половине (43%) наблюдений имеет место дизурия. В целом на различные проблемы с мочеиспусканием жалуются 50–60% пациентов с ХП [5]. Нередко при ХП имеют место уменьшение продолжительности полового акта и преждевременная эякуляция (ПЭ) [9]. Простатит как заболевание одной из дополнительных половых желез, согласно классификации ВОЗ, может стать причиной мужского бесплодия [10]. На фоне ХП происходит существенное снижение качества жизни, сопоставимое с таковым при стенокардии, инфаркте миокарда, болезни Крона и сахарном диабете [11]. Снижение качества жизни пропорционально интенсивности боли, числу ее локализаций и частоте обострений; наиболее неприятные ощущения доставляет боль при эякуляции. К независимым факторам снижения качества жизни при ХП относятся ПЭ, эректильная дисфункция (ЭД) и бесплодие [2–4].
Этиопатогенез ХП в течение многих лет остается предметом дискуссий. В ходе многочисленных исследований установлено, что активность воспалительного процесса в простате слабо коррелирует с клинической картиной заболевания. Активное воспаление в простате, сопровождающееся увеличением количества лейкоцитов в секрете простаты и сперме, может не сопровождаться клиническими проявлениями. И наоборот, выраженная клиническая симптоматика ХП может иметь место в отсутствие какого-либо воспалительного процесса в железе [1, 4–8, 12].
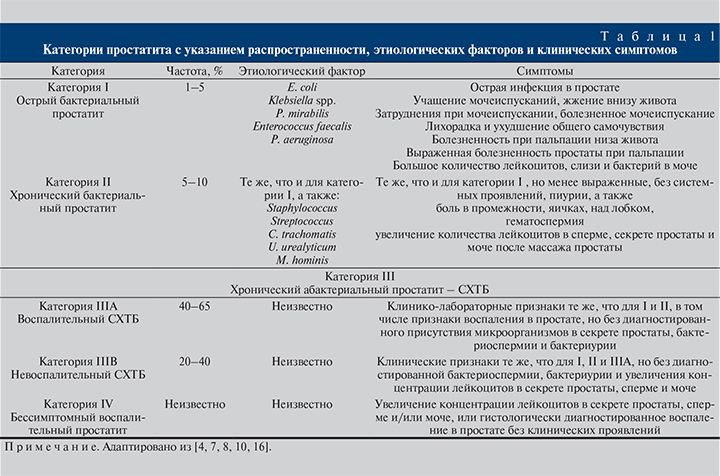
Используемая в настоящее время классификация простатита предложена Американским национальным институтом здоровья и Национальным институтом диабета, пищеварения и болезни почек (NIH NIDDK) в 1995 г. (NIDDK Workshop Committee, 1995). Она основана на разделении всех форм простатита в зависимости от наличия или отсутствия бактериального агента, наличия лейкоцитов в секрете простаты, а также клинических проявлений.
В зависимости от длительности симптомов простатит характеризуется как острый или как хронический, если симптомы сохраняются в течение как минимум 3 мес. Согласно этой классификации, выделяют четыре категории простатита: острый бактериальный (категория I), хронический бактериальный (ХБП; категория II), хронический простатит/синдром хронической тазовой боли (ХП/СХТБ; категория III) и бессимптомный простатит (категория IV) [1, 4, 6–8]. Каждая из этих категорий имеет различный профиль СНМП (табл. 1).
Границы между различными формами простатита размыты. Точность диагноза определяется глубиной и полнотой обследования. Нарушение дренажной функции простаты, закупорка протоков ацинусов железы гнойным секретом, снижение выделенного объема секрета после массажа простаты в отсутствие увеличения в нем количества лейкоцитов «симулируют» ХП категории IIIВ. Восстановление оттока секрета в результате лекарственных и физиотерапевтических воздействий позволяет установить воспалительную природу ХП (категория IIIА), а применение адекватных методов выявления инфекций (не только посев, но и методы амплификации генов) – его истинную инфекционную природу (ХП категории II).
Проникновение микроорганизмов в простату при ХП категорий I, II и IV возможно восходящим путем через уретру или лимфатическим – трансректально [13, 14]. Рецидивы инфекционного воспалительного ХП могут быть следствием персистенции микроорганизмов в железе, передачи половым путем и реинфекции из очага, которым является кишечник. Имеются данные о развитии патогенности E. coli и способности преодолевать анатомические и иммунные барьеры у здоровых молодых мужчин без урологических факторов риска за счет изменения филогенетического фона и накопления репертуара внекишечных патогенных вирулентных генов; при этом устойчивость к антибиотикам дает небольшое дополнительное преимущество для штаммов E. coli в отношении этих здоровых амбулаторных пациентов [13]. Антисептические свойства секрета простаты могут быть важным фактором, предотвращающим рецидив [15].
Факторы риска ХП категорий I, II и IV включают увеличение простаты и урологические вмешательства, такие как трансректальнная биопсия простаты [6–8]. Нарушения пищеварения в виде диареи и запоров, связанные с этим нарушением барьерной функции прямой кишки, некоторые авторы рассматривают в качестве провоцирующего фактора ХП [14].
Отсутствие выявляемых микроорганизмов при ХП категории IIIА не гарантирует его неинфекционный характер: некоторые внутриклеточно персистирующие микроорганизмы (C. trachomatis, U. urealyticum, M. hominis и др.) и анаэробы невозможно обнаружить при стандартном посеве. В связи с этим антибиотикотерапия в половине случаев оказывается эффективной для устранения воспаления при «неинфекционном» ХП [4, 6, 16]. Вопрос о том, нужно ли считать воспалительный и невоспалительный типы ХП/СХТБ (категории IIIА и В) не различными заболеваниями, а одним, но с разными проявлениями, еще не решен. Недавно была показана возможность различить типы IIIA и IIIB по результатам измерения концентраций провоспалительного интерлейкина-8 в сперме [10].
По данным недавно проведенного исследования (более 1500 обследованных в двух когортах), к факторам риска ХП/СХТБ относятся особенности питания и образа жизни: ночная работа, курение, употребление алкоголя, острая пища, употребление малого количества жидкости и большой интервал между мочеиспусканиями, избыточная сексуальная активность, искусственное пролонгирование полового акта, стрессы [17].
Сравнение тяжести клинических симптомов при ХП в зависимости от наличия или отсутствия в предстательной железе инфекции (когорта из 914 пациентов) показало, что более тяжелые клинические симптомы имели место у больных инфекцией (медиана NIH 24 против 20); кроме того, кривые распределения NIH-CPSI были сдвинуты в сторону более тяжелых симптомов [18].
Несмотря на широкое распространение классификации NIH NIDDK, она не является повсеместно признанной. Существует и другой, более новый, принцип классификации – система, основанная на клиническом фенотипе ХП/СХТБ, – UPOINT. Мнемоника UPOINT расшифровывается как мочевая (Urinary), психосоциальная (Psychosocial), органоцентрическая (Organ-centric), инфекция (Infection), неврогенная/системная (Neurogenic/systemic), болевая (Tenderness – боль при прикосновении) [2, 16, 19]. UPOINT используется для классификации мужчин с ХП/СХТБ, чтобы определить их уникальный клинический фенотип, который затем может быть использован для направления терапии. Было показано, что число положительных доменов UPOINT строго коррелирует с тяжестью и длительностью симптомов простатита, оцененного по NIH-CPSI. Отражением пересмотра традиционных представлений о этиопатогенезе ХП служит тот факт, что в последнем Guidelines EAU (2016) вопросы, касающиеся бактериального простатита, болевого синдрома простаты (prostate pain syndrome) и СНМП, представлены в различных разделах. При этом подчеркивается, что «философия лечения хронической боли в области таза основана на биопсихосоциальной модели» [20]. Авторы руководства отмечают, что монотерапия редко бывает эффективной. Фармакологические и нефармакологические вмешательства могут включать психо-, физиотерапию, лекарственные средства и более инвазивные вмешательства. Применение классификации UPOINT и выделение клинического фенотипа ХП/СХТБ пациентов позволяют применять мультимодальную патогенетическую терапию для каждого из 6 определенных доменов, что приводит к значительному улучшению клинических симптомов у 75–84% пациентов [3, 16, 19]. «Несмотря на то что "золотого" стандарта лечения не существует, междисциплинарный подход с мультимодальной терапии дает пациенту с ХП/СХТБ лучший шанс облегчения симптомов», – пишет С. Smith, автор недавнего обзора «Male chronic pelvic pain: An update» [2].
Обследование пациентов с подозрением на простатит должно проводиться в соответствии с алгоритмом, рекомендованным Европейской ассоциацией урологов [8] и Стандартом первичной медико-санитарной помощи при хроническом простатите (Приложение к приказу Министерства здравоохранения РФ № 775н от 09.11.2012) [21].
Клиническое обследование включает оценку состояния с применением опросника Chronic Prostatitis Symptom Index (NIH-CРSI), который позволяет оценивать боль (локализацию, интенсивность, частоту и продолжительность) и СНМП (обструктивные/связанные с мочеиспусканием и раздражающие/связанные с накоплением мочи), а также наличие других симптомов (например, повышение температуры, другие болевые синдромы) и влияние этих симптомов на жизнедеятельность, а также качество жизни (GR:В). Необходимо выяснить наличие сопутствующих заболеваний других систем организма, наличие в анамнезе перенесенных заболеваний и операций (особенно урологических), травм, медикаментозной терапии и аллергий. Специфические заболевания с подобными симптомами должны быть исключены (GR:А). Использование NIH-CРSI важно, так как это позволяет пациенту описать лечащему врачу свое восприятие интенсивности болевого синдрома или симптомов. Шкала NIH-CРSI также может быть использована для измерения изменений симптомов с течением времени и оценки эффективности лечения [1, 2, 4–7]. Целесообразно проводить скрининг пациентов на уровень тревожности или стресса с использованием психологической системы «желтых флажков» и/или опросника для оценки здоровья пациента (PHQ-9) и/или опросника по генерализованному тревожному расстройству (GAD-7) [4].
Лабораторные исследования при простатите, согласно Guidelines EAU, включают [8]:
- общий анализ и посев мочи;
- исключение инфекций, передаваемых половым путем (ИППП): C. trachomatis, U. urealyticum, M. hominis и др.;
- урофлоуметрию (УФМ) и определение остаточной мочи;
- 4-стаканную пробу (по Meares и Stamey);
- микроскопию секрета простаты или первой порции мочи, полученной после массажа простаты;
- культуральные исследования секрета простаты, мочи, полученной после массажа простаты, и/или спермы.
Выделенный бактериальный штамм считается возбудителем заболевания, если концентрация колониеобразующих единиц (КОЕ) в секрете простаты или в моче, полученной после массажа простаты, превышает концентрацию в средней или первой порции мочи в 10 и более раз [6–8].
Как правило, культуральный метод позволяет выявлять микроорганизм, рассматриваемый в качестве этиологического агента ХБП. Однако ряд возбудителей ИППП, которые также могут играть роль в развитии ХП, внутриклеточные. Их невозможно определять рутинно, так как для их роста требуется специальная среда (например, для C. trachomatis – культура клеток). В связи с этим у сексуально активных мужчин с признаками простатита при негативных результатах бактериологического исследования (посева) показано применение методов амплификации нуклеиновых кислот (например, полимеразной цепной реакции) с целью выявления ИППП [22, 23].
Ультразвуковое исследование не входит в рекомендации EAU, однако публикации последних лет свидетельствуют о том, что оно позволяет [12, 24]:
- выявлять фиброз и кальцинацию простаты, что важно учитывать при лечении;
- диагностировать нарушение дренажной функции семенных пузырьков, что часто связано с болевой симптоматикой;
- устанавливать нарушения кровообращения в простате и малом тазу, играющие существенную роль в патогенезе ХП/СХТБ;
- выявлять очаги, подозрительные в плане малигнизации (одновременное определение ПСА важно для пациентов старше 50 лет с потенциально повышенным риском рака простаты).
Рабочая группа EAU под председательством М. Grabe подчеркивает [8], что руководящие принципы, касающиеся простатита, не должны содержать минимальный набор дифференциально-диагностического обследования. Опытный уролог должен решить, какие исследования важны для каждого конкретного пациента. Составной частью дифференциальной диагностики можно считать пробное лечение антибиотиками при наличии признаков воспаления.
Лечение. Лечение с доказанной эффективностью существует только для ХП категории II, т.е. ХП, вызванном установленными инфекциями. В этом случае эффективна антибиотикотерапия (GR:А) [1–8]. Рекомендуемые антибиотики при ХП категории II, а также их преимущества и недостатки охарактеризованы во многих руководствах: Российском [1], Европейском [8], Британском [4], Канадском [16] и др. При назначении антибиотикотерапии следует принимать к сведению результаты бактериальных посевов и чувствительность штаммов микроорганизмов с учетом любых лекарственных взаимодействий и/или противопоказаний (GR:В).
Фторхинолоны, такие как Сiprofloxacin и Levofloxacin, считаются препаратом выбора из-за благоприятных фармакокинетических свойств (GR:В), как правило, их хорошим профилем безопасности и антибактериальной активностью в отношении грамотрицательных возбудителей, включая P. aeruginosa [1, 4, 8]. Кроме того, levofloxacin активен в отношении грамположительных и атипичных патогенов, таких как хламидии и генитальные микоплазмы (GR:B). Он также удобен в применении ввиду высокой биодоступности и комплаентности – достаточно принимать 1 раз в сутки в дозе 500–750 мг в зависимости от массы тела мужчины. Среди побочных эффектов антибиотиков этой группы: фототоксичность, влияние на сухожилия и ЦНС, обратимое ухудшение показателей спермограммы [25].

В мае 2016 г. Управление по контролю за пищевыми продуктами и лекарственными средствами (US FDA) опубликовало официальное обращение, в котором призывает ограничивать применение системных фторхинолонов для лечения ряда инфекций, в том числе неосложненных инфекций мочевых путей. Ограничение связано с тем, что риск серьезных побочных эффектов, вызванных приемом фторхинолонов, превышает предполагаемую пользу от лечения этими препаратами описанных категорий пациентов. US FDA подчеркивает, что фторхинолоны допустимо применять, только когда нет других альтернативных препаратов [26].
Если обнаружены или подозреваются внутриклеточные возбудители (Chlamydia, Mycoplasma spp., U. urealyticum), следует назначать тетрациклины или макролиды (GR:B) [1, 4, 8].
Рекомендуемая доза доксициклина моногидрата (Юнидокс Солютаб®) – 100 мг 2 раза в сутки. Другие тетрациклины в настоящее время практически не применяются из-за возможных побочных эффектов.
Макролиды также эффективны в отношении хламидий в большей степени, чем другие группы, в отношении грамположительных бактерий, несколько в меньшей – в отношении грамотрицательных. Рекомендуемая доза джозамицина (Вильпрафен®) – 500 мг 3 раза в сутки.
Положительному опыту применения этих тетрациклинов и макролидов при ХП недавно было посвящено отечественное многоцентровое исследование TAURUS [27].
При подозрении на наличие сопутствующей гонококковой инфекции необходимо добавить цефтриаксон (1 г в сутки внутривенно или внутримышечно) или цефиксим 400 мг однократно [8].
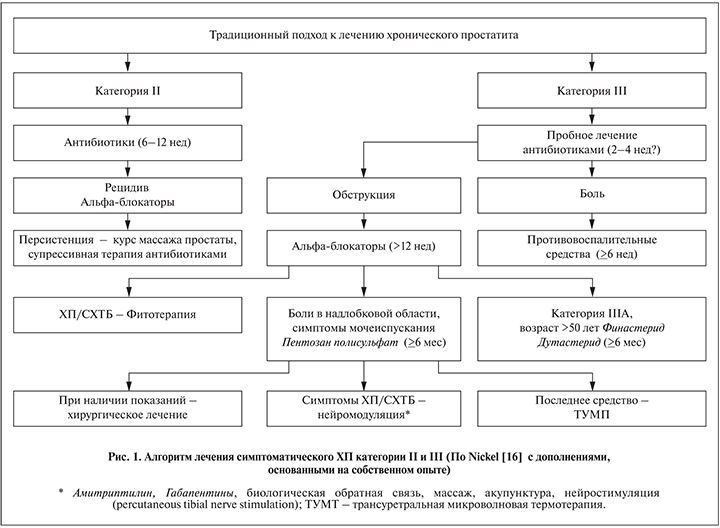
В соответствии с рекомендациями Guidelines EAU при лечении ХП антибиотики следует принимать в течение 4–6 нед после постановки диагноза [8]. При этом необходимы относительно высокие дозы препаратов и предпочтительна пероральная терапия (GR:B). Согласно рекомендациям Американской и Канадской урологических ассоциаций, прием антибиотиков следует продолжать 6–12 нед (рис. 1) [16].
Применение α-адреноблокаторов, снижающих тонус шейки мочевого пузыря и протоков простаты, также рекомендуется (GR:А) [1, 4, 8, 21]. Тамсулозин (Омник®) следует принимать по 0,4 мг 1 раз в сутки, альфузозин (Дальфаз®) – по 10 мг 1 раз в сутки, желательно утром после еды. При сходном лечебном эффекте препараты имеют особенности: тамсулозин практически не влияет на артериальное давление, а альфузозин никогда не вызывает ретроградной эякуляции. Клинические доказательства преимущества их сочетаний с антибиотиками пока находятся в стадии изучения [2–4].
По мнению некоторых авторитетных отечественных и зарубежных урологов [1, 16], при рецидивирующих формах ХБП возможно применение лечебного пальцевого массажа простаты (см. рис. 1). Систематический обзор 4 исследований (195 пациентов) выявил статистически значимое снижение общего балла и баллов доменов по шкале NIH-CPSI в группе комбинированной терапии антибиотиками и массажем (3 раза в неделю в течение 1 мес), однако авторы отметили низкое качество имеющихся данных – отсутствие рандомизированных плацебо-контролируемых исследований [28]. Очевидно, поэтому в Руководстве EAU массаж простаты как способ лечения отсутствует [8]. Авторы Британского руководства [4] отмечают, что недостаточно данных, позволяющих рекомендовать массаж предстательной железы в качестве лечения ХБП и ХП/СХТБ, кроме как в контексте клинического исследования (GR:B). Противопоказанием к массажу простаты считают фиброз и конкременты простаты, истинную кисту простаты, любые подозрения на злокачественную трансформацию, относительным противопоказанием – отсутствие выделения секрета после массажа и, наоборот, обильное его вытекание.

Лечение простатита категории III/СХТБ рекомендуют начинать с курса антибиотиков продолжительностью 2–4 нед (см. рис. 1). Почти в половине случаев это приводит к снижению количества лейкоцитов в секрете простаты и сперме, что свидетельствует о том, что кажущийся «стерильным» ХП на самом деле вызван некими микроорганизмами, не выявляемыми в стандартном посеве. Согласно данным больших многоцентровых исследований, выполненных недавно в Корее и Китае, такими патогенами являются Chlamydia, Mycoplasma spp. и U. urealyticum [14, 17]. Наши собственные данные подтверждают эту точку зрения [15].
Согласно Рекомендациям EAU [8], один курс применения антибактериальной терапии (хинолоны или тетрациклины) в течение минимум 6 нед рекомендуется для нелеченых пациентов с длительностью болевого синдрома меньше 1 года (GR:А). Для этой группы мужчин также рекомендованы α-адреноблокаторы (GR:А), высокие дозы Pentosan polysulfat (GR:А) и нестероидные противовоспалительные средства (НПВС), при этом следует учитывать долгосрочные побочные эффекты (GR:В). Пациентам с болевым синдромом простаты и признаками психологического дистресса одновременно рекомендовано психологическое консультирование (GR:В) [8].
Мета-анализ применения α-адреноблокаторов, антибиотиков и противовоспалительных средств, выполненный А. Thakkinstian и соавт. [29] (19 исследований/1669 человек), показал значительное улучшение симптомов по сравнению с плацебо со средними различиями общего CPSI – от -10,8 (95% ДИ – от -13,2 до -8,3, р<0,001), -9,7 (95% ДИ – от -14,2 до -5,3, р<0,001) и -1,7 (95% ДИ – от -3,2 до -0,2, р=0,032) соответственно, тогда как α-адреноблокаторы плюс антибиотики привели к наибольшей разности CPSI (-13,6, 95% ДИ – от -16,7 до -10,6; р<0,001). Авторы делают следующий вывод: α-адреноблокаторы, антибиотики и/или противовоспалительные средства полезны для некоторых пациентов с ХП/СХТБ и комбинированная терапия предпочтительна.
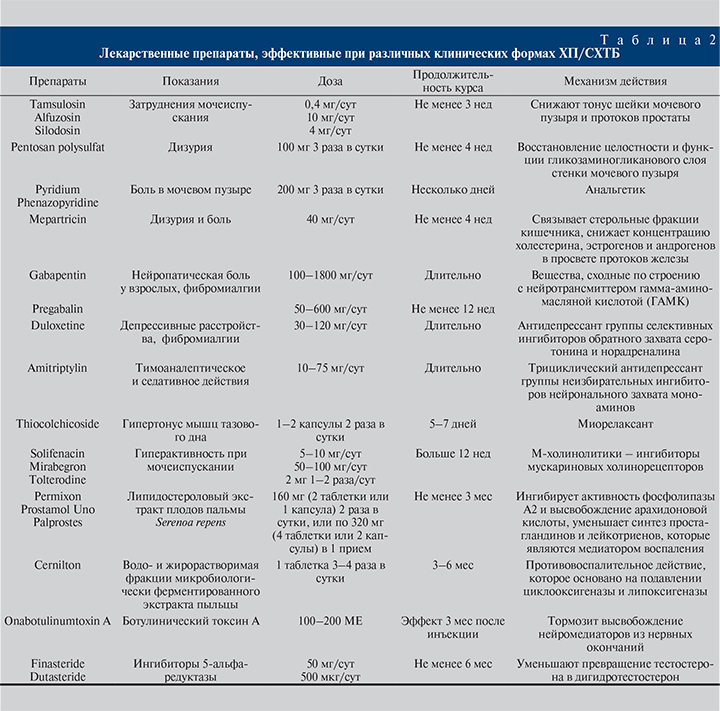
Для лечения ХП/СХТБ кроме антибиотиков α-адреноблокаторов и НПВС могут применяться препараты других групп (см. рис. 1; табл. 2): Pentosan polysulfat, Pyridium (Рhenazopyridine), Mepartricin, Gabapentin, Pregabalin, Duloxetine, Amitriptylin, кверцитин, экстракты пыльцы, экстракты Serenoa repens. В частности, по данным мета-анализа [30], терапия, включающая Doxazosin+Ibuprofen+Thiocolchicoside, привела к клиническому и статистически значимому снижению общего балла NIH-CPSI. Тот же эффект был получен при комбинации данного лечения с аэробными физическими нагрузками и иглоукалыванием.
Результаты небольших (n<40) пилотных исследований свидетельствуют о некотором облегчении симптомов после трансуретральной игольной аблации [31] или трансуретральной микроволновой термотерапии [32], однако, прежде чем делать определенные выводы в отношении клинической эффективности таких хирургических вмешательств, необходимо провести рандомизированные контролируемые исследования.
Лечение ХП на основе классификации UPOINT
Лечение пациентов с ХП/СХТБ с использованием классификации UPOINT более эффективно [3, 16, 19, 33], что подтверждает собственный опыт. За последние 5 лет, руководствуясь принципами данной классификации, пролечено более 350 пациентов: примерно в 70% наблюдений в простате имел место воспалительный процесс (в 1/3 случаев бактериальный, в 2/3 – небактериальный), в остальных случаях процесс был невоспалительного характера; возраст пациентов варьировался от 20 до 70 лет (38±6 лет). В большинстве случаев выявлены сопутствующие нарушения: бесплодие, ЭД, ПЭ. Эффективность лечения составила около 80%. Одновременное использование нескольких препаратов и нелекарственных воздействий пока не позволяет обеспечивать строгую стратификацию и проводить сравнительный анализ, но дает достаточно оснований оценивать эффективность существующих методов лечения ХП и формулировать некоторые практические рекомендации, основанные на опубликованных данных и полученном опыте (см. рис. 2).
Общие рекомендации. На первом этапе необходимо сообщить пациентам об исходных причинах ХБП и ХП/СХТБ. Объяснение может включать описание строения органов таза, цикла хронической боли и возможных путей передачи боли (нейропатический или ноцицептивный). Во время первого визита с пациентом необходимо обсудить вопросы дифференциальной диагностики, такие как рак органов мочевыделительной системы и бесплодие, описать полный анамнез пациента и дать информацию о предстоящих обследованиях. Как положительные, так и отрицательные результаты диагностических тестов, подтверждающие бактериальную этиологию заболевания, следует сообщать пациенту, проинформировав его о влиянии таких результатов на будущее лечение.
«Мочевой» тип. Устранение мочевых симптомов начинается с диетического питания, что подразумевает отказ от острой пищи, кофеина и алкоголя. Дополнительные методы лечения (см. табл. 2) – препараты, снижающие тонус шейки мочевого пузыря (α-адреноблокаторы) и подавляющие императивные позывы (м-холиноблокаторы). При выборе α-адреноблокатора предпочтение следует отдавать более селективным представителям класса, что наряду с высокой эффективностью обеспечивает низкий процент побочных реакций, особенно со стороны сердечно-сосудистой системы. М-холиноблокаторы также различаются по степени селективности в отношении воздействия: солифенацин более селективно, чем толтеродин и оксибутинин, взаимодействует с м-холинорецепторами мочевого пузыря, поэтому ниже частота побочных эффектов (сухость во рту), что важно при длительной терапии. Комбинированное лечение α-адреноблокатором и м-холиноблокатором может рассматриваться как вариант терапии пациентов с умеренными и тяжелыми СНМП с преобладанием симптомов наполнения, особенно если монотерапия оказалась недостаточно эффективной [34]. Если облегчение симптомов опорожнения СНМП или других симптомов ХБП или ХП/СХТБ не наступило в течение 4–6 нед, лечение следует прекращать и назначать другой вид лечения.
Пациентам с увеличенным объемом простаты на фоне доброкачественной гиперплазии полезны ингибиторы 5α-редуктазы. Показано, что дутастерид в дозе 500 мкг/сут показал значимо большее снижение интрапростатического рефлюкса и нарушений опорожнения в клинической картине ХП/СХТБ по сравнению с плацебо у мужчин старше 50 лет (исследование Reduce) [35]. Курс лечения не менее 6 мес. В качества анальгетика при данном типе ХП может применяться Pyridium (phenazopyridine).
«Психосоциальный» тип требует применения психотерапии, желательно профессиональной. Методы включают управляемое воображение, прогрессивное обучение релаксации, самовнушение, когнитивно-поведенческую терапию, использование биологической обратной связи (БОС). В трех небольших (n=19–31) пилотных исследованиях [36–38] было продемонстрировано, что программа тренировки мышц тазового дна с помощью БОС значительно снижает степень тяжести симптомов у пациентов с ХП/СХТБ.
J. Cohen и соавт. [30] в систематическом обзоре и мета-анализе результатов лечения ХП/СХТБ отмечают статистически значимый эффект при использовании плацебо, при этом эффективность увеличилась с течением времени. Немаловажную роль играет реакция близких на болезнь – «заботливые реакции» увеличивают негативное влияние боли на инвалидность пациента, в то время как «отвлекающие реакции» имеют противоположный эффект. Исследования показывают, что урологи должны поощрять пациентов участвовать во всех видах повседневной деятельности, когда это возможно [39].
«Органоспецифический» тип требует избегать диетических триггеров, перечисленных ранее. Поскольку большинство симптомов локализуется в мочевом пузыре, конкретные способы лечения дизурии могут быть рассмотрены (Pentosanpolysulfate, Hydroxyzine, intravesical therapies).
Значительное улучшение было показано при введении Onabotulinumtoxin A (onaBoNT) трансуретрально в боковые доли простаты. Наиболее заметные изменения после onaBoNT-лечения регистрировали в домене боли и визуальной аналоговой шкале (снижение на 80 и 82% соответственно через 6 мес наблюдения) [40].
Фитофармацевтическими являются экстракты натурального происхождения, используемые в качестве лекарственных средств или нутриентов. Cernilton – водо- и жирорастворимая фракции микробиологически ферментированного экстракта пыльцы ржи, применяется в лечении ХП/ СХТБ в течение более 25 лет. Точный механизм действия препарата неизвестен, но в исследованиях in vitro показано выраженное противовоспалительное действие, основанное на подавлении циклооксигеназы и липоксигеназы [41]. Значительные различия между другим экстрактом пыльцы (Prostat/Poltit) и плацебо были выявлены в небольшом (n=60) исследовании, в котором, однако, не использовали валидированный инструмент для балльной оценки симптомов [42]. Липидостероловый экстракт плодов пальмы Serenoa repens входит в состав многих препаратов (Permixon, Prostamol Uno, Palprostes, Profluss), ингибирует активность фосфолипазы А2 и высвобождение арахидоновой кислоты, тем самым уменьшает синтез простагландинов и лейкотриенов, которые являются медиатором воспаления; в течение первых недель терапии уменьшает проницаемость капилляров и сосудистый стаз, уменьшает отечность и воспалительный процесс в простате, устраняет компрессию шейки мочевого пузыря и мочевыводящего канала, улучшая показатели уродинамики [43, 44]. Результаты недавнего мета-анализа этих исследований показывают, что фитотерапия обеспечивает благоприятный эффект по сравнению с плацебо (ОШ – 1,6; 95 % ДИ – 1,1–2,4) [6].
«Инфекционный» тип. Если пациент никогда ранее не получал длительный курс антибиотиков (не менее 30 дней), их назначение является первым шагом.
В большинстве случаев лечение должно быть направлено одновременно против инфекции, воспаления и нарушений опорожнения, поэтому при терапии необходимо сочетать антибиотики, противовоспалительные препараты и α-адреноблокаторы. Такая схема лечения ХП/СХТБ получила обозначение «три А»: antibiotics & anti-inflammatory & alpha-blockers. По данным Кокрановского обзора [45], в котором авторы анализировали данные 18 исследований (в общей сложности 2196 рандомизированных пациентов), все хинолоновые антибиотики (ciprofloxacin, levofloxacin, lomefloxacin, ofloxacin, prulifloxacin) показали сходную микробиологическую и клиническую эффективность, выраженность побочных эффектов. Альтернативными антимикробными агентами для лечения ХП категории II, вызванного традиционными патогенами, являются co-trimoxazole и tetracyclines. При интерпретации результатов культуральных исследований эякулята необходимо учитывать возможность наличия атипичных микроорганизмов. При хламидийной инфекции препаратом выбора являются doxycycline и azithromycin [46, 47]. При этом ряд мета-анализов продемонстрировал преимущества doxycycline по сравнению с azithromycin. Так, по данным [48], эффективность doxycycline в лечении хламидийной инфекции составляет 99,6%, тогда как azithromycin – 82,9%. Ранее проведенные мета-анализы также свидетельствовали о большей эффективности doxycycline по сравнению с azithromycin в лечении урогенитального хламидиоза [49, 50]. Сравнительные исследования других препаратов показали, что при хламидийном простатите azithromycin был эквивалентен clarithromycin как микробиологически, так и клинически; ciprofloxacin показал худшие результаты по эрадикации и клиническому излечению без существенных различий в отношении побочных эффектов. При уреаплазменном простатите сравнение minocycline и azithromycin против doxycycline и ofloxacin показало аналогичные микробиологическую, клиническую эффективность и токсичность. При ХП, вызванном облигатными внутриклеточными патогенами, макролиды показали более высокие микробиологические и клинические показатели эффективности лечения по сравнению с фторхинолонами [45].
В зарубежных публикациях подчеркнута значимость низких уровней резистентности микоплазм к doxycycline и josamycin, – не превышают 6% при сохранении высокой резистентности к фторхинолонам [51] В другом сравнительном исследовании 92% штаммов U. urealyticum были чувствительными к джозамицину на фоне относительно низких показателей чувствительности к другим макролидам (к азитромицину 45%, эритромицину 48%, кларитромицину 63%) [52].
За последние годы активно обсуждают проблему растущей резистентности уропатогенов к антибиотикам различных групп: частота микробиологической эрадикации при ХБП составила 40–70% для ципрофлоксацина, 62–77% – для сочетания азитромицина и ципрофлоксацина, 77% – для доксициклина [4, 29, 45]. Антибиотики даже одной группы могут иметь различную эффективность: в сравнительном исследовании с участием пациентов с ХБП (n=408) было показано, что левофлоксацин более эффективен, чем ципрофлоксацин, с точки зрения частоты бактериальной эрадикации и клинического улучшения [53]. Следует помнить: ряд авторитетных источников, в том числе и Европейская урологическая ассоциация, Американская ассоциация по антимикробной терапии, выступают против широкого применения фторхинолонов, объясняя это прогрессирующим ростом числа резистентных штаммов E. coli; такая тенденция наблюдается и в нашей стране [54]. В связи с этим при возможности назначать нехинолоновые антибиотики лучше воздержаться от их использования. Трудно согласиться с мнением авторов канадского руководства [16], соласно которому при диагностике ХП достаточно микроскопического исследования на бактерии материала 2- и 4-стаканной пробы, а культуральные исследования спермы не нужны. Для выявления нетипичной флоры следует использовать методы амплификации генов (ПЦР и др.).
«Неврологический/системный» тип. Неврологи-ческие методы лечения включают использование препаратов, подавляющих нейропатическую боль, таких как Gabapentin, Pregabalin, Amitriptyline, Duloxetine (GR:В); лечение должно длиться не менее 6 нед (см. табл. 2) [4, 55]. Данные об эффективности лечения боли у пациентов с ХП/СХТБ с помощью НПВС противоречивы: в одном мета-анализе сообщалось, что НПВС (rofecoxib, celecoxib, corticosteroid) оказывали благоприятный эффект (n=190, ОШ – 1,8; 95% ДИ – 1,2–2,6) [6], другой продемонстрировал отсутствие значимых различий по эффективности между НПВС и плацебо [30].
«Болевой мышечно-спастический» тип. Пациенты с ХП/СХТБ часто имеют триггерные точки, которые воспроизводят характер и расположение их боли при пальпации. До сих пор не известно, что первично: являются ли эти скелетно-мышечные нарушения следствием расстройства функции мочевых путей, или, наоборот, являются основной ненормальностью, которая приводит к симптомам со стороны нижних мочевых путей? Физиотерапия все чаще включается в план ведения пациентов с ХП/СХТБ. Несмотря на неоднозначность и противоречивость полученных исследователями данных, есть основания считать перспективным использование электростимуляции, в особенности магнитной, как более безопасного и портативного метода лечения хронического болевого синдрома [56]. Имеется первый отечественный опыт применения для лечения ХП/СХТБ ударно-волновой терапии [57].
Исследования также посвящены применению при данном типе ХП/СХТБ инъекций onaBoNT-A в bulbospongiosus muscle и perineal body. Показано, что уже в первый месяц наблюдения значительно больший отклик в баллах GRA был отмечен в группе onaBoNT-A по сравнению с плацебо (30 против 13%). Хотя никаких существенных различий в изменении общего показателя CPSI отмечено не было, в группе onaBoNT-A имело место более выраженное снижение оценки CPSI по субдомену боли по сравнению с плацебо; лечение хорошо переносилось [58].
Важным компонентом лечения любой формы ХП является нормализация сексуальной жизни, что в свою очередь требует лечения других имеющихся заболеваний: сердечно-сосудистых, ожирения, сахарного диабета 2 типа, возрастного андрогенного дефицита и т.д. [59].
Следует помнить, что хронические боли в типичных для простатита местах могут быть связаны как с ХП/СХТБ, так и с другими причинами, такими как синдром раздраженного кишечника, фибромиалгии и синдром хронической усталости [60]. В связи с этим не следует любой болевой синдром в области малого таза мужчины до проведения обследования трактовать как исключительно урологический. Маркеры неврологических воспалительных и аутоиммунных заболеваний должны учитываться при параллельных изменениях симптомов после лечения. Ведение таких больных следует проводить коллегиально врачами различных специальностей: уролога, невропатолога, терапевта, психиатра, физиотерапевта, психолога, сексопатолога. На ранней стадии заболевания при невозможности такого консилиума и/или в случае выраженной болевой симптоматики опытный врач может начать лечение самостоятельно, используя при этом мультидисциплинарный подход, строго соблюдая рекомендованные производителями дозировки препаратов, проводя психотерапевтическую коррекцию и информируя пациента об ожидаемой эффективности лечения и его возможных побочных эффектах (пациенты могут считаться имеющими ранние стадии заболевания, если персистирующие, рецидивирующие симптомы имели место менее чем в течение 6 мес и антибиотикотерапия по этому поводу не проводилась [4]).
Важный вопрос: кто должен лечить пациентов с ХП/СХТБ? Учитывая все сказанное – сложность патогенеза, большое число клинических форм, труднопредсказуемость результатов, считаю, что вряд ли это сможет сделать врач общей практики, более успешно – опытный уролог, постоянно повышающий квалификацию в данном направлении. Оптимальным представляется коллегиальный мультидисциплинарный подход к выбору лекарственных и иных средств комплексной терапии.
Ошибки при лечении хронического простатита – как их избежать?
Существует Стандарт первичной медико-санитарной помощи при ХП [21], который может служить одновременно руководством к назначению лечения ХП и примером того, как лечить не нужно (табл. 3).
Ошибки при лечении простатита можно разделить на несколько основных групп.
- Выбор терапии без учета типа ХП: инфекционно-воспалительный или невоспалительный ХП/СХТБ, а также преобладающей симптоматики. Действующий Стандарт МЗ РФ включает лекарственные средства только четырех групп: антибиотики, α-адреноблокаторы, НПВС и блокаторы 5α-редуктазы, без уточнения показаний к их назначению. При этом хинолоны рекомендованы в 100% случаев (частота предоставления – 1,0), что неизбежно приведет к необоснованному назначению антибиотиков при невоспалительной форме ХП/СХТБ (почти половина случаев простатита). Другие группы препаратов (габапентены, антидепрессанты, фитопрепараты и др.), достаточно эффективные при простатическом болевом синдроме, в стандарте вообще отсутствуют.
- Неправильный выбор лекарственных препаратов для лечения ХП:
- Фосфомицин не включен в Международные рекомендации по лечению ХП [4, 8, 16, 30, 45], об этом пишут и отечественные авторы [61, 62], тем более в виде однократной дозы 3 г (время полувыведения фосфомицина при пероральном приеме составляет всего 4 ч), однако в стандарте рекомендован в данной дозировке 80% пациентов с ХП; применение фосфомицина для профилактики осложнений после биопсии простаты [63] и в особых случаях множественной антибиотикорезистентности [64] обсуждается.
- Нитрофураны плохо проникают в простату, также не включены в Международные рекомендации по лечению ХП [4, 8, 16, 30, 45] (стандарт рекомендует их 60% пациентов с ХП).
- В стандарте отсутствуют макролиды, рекомендованные EAU и другими международными и отечественными руководствами для лечения бактериального простатита [4, 8, 16, 45]. Следует помнить, что тетрациклины и макролиды имеют преимущества при лечении ХП, вызванного нетипичной микрофлорой (C. trachomatis, U. urealyticum, M. hominis).
- Терапия должна быть направлена одновременно против инфекции, воспаления и нарушений опорожнения, поэтому при терапии необходимо сочетание антибиотиков, противовоспалительных препаратов и α-адреноблокаторов. Такая схема лечения ХП получила обозначение «три А»: antibiotics&anti-inflammatory&alpha-blockers [4, 8, 16, 30, 45]. Согласно стандарту, α-адреноблокаторы показаны только в 60% случаев.
- Неправильная дозировка препаратов:
- Левофлоксацин в стандарте рекомендуют в дозе 1000 мг/сут, при том что в инструкции к препарату для лечения простатита рекомендовано принимать по 500 мг/сут; недавние отечественные исследования показали, что клиническая, лабораторная и бактериологическая эффективность левофлоксацина практически не повышается при увеличении дозировки препарата (500 и 750 мг) [65].
- Неправильная продолжительность курса лечения ХП:
- В стандарте левофлоксацин рекомендован на 5 дней, офлоксацин – на 15, ципрофлоксацин – на 30, при том что курс антибиотиков при инфекционно-воспалительном простатите должен продолжаться не менее 30 дней [4, 8, 16];
- Ничем не обоснована рекомендованная стандартом продолжительность применения НПВС: диклофенак – 10 дней, а кетопрофен – 20, при том что курс НПВС при ХП должен составлять 4–6 нед [4, 16].
- Ингибиторы 5α-редуктазы в стандарте рекомендовано назначать целый год, хотя, согласно исследованию REDUCE [35], их прием может быть клинически эффективным только в отношении пациентов в возрасте старше 50 лет с уровнем ПСА >2,5 нг/мл (для пациентов в возрасте от 50 до 60 лет) или >3,0 нг/мл (для пациентов в возрасте старше 60 лет).
Выводы
- Простатит – полиэтиологичное заболевание. Сходные симптомы могут быть вызваны различными причинами: воспалением в простате и иными причинами (сосудистые, неврологические, психосоциальные и др.).
- Диагностика ХП учитывает факторы, традиционно выходящие за рамки урологической практики, и должна опираться на междисциплинарный подход с привлечением специалистов различных специальностей: урологов, неврологов, терапевтов, психиатров и др. При выборе тактики лечения необходимо опираться на традиционную классификацию простатита NIH NIDDK (1995), но использование более современной классификации UPOINT позволяет добиваться лучших результатов.
- Лечение лучше проводить с помощью нескольких одновременных способов терапии, направленных на различные аспекты состояния. Варианты лечения ХП включают широкий спектр лекарственных средств и нелекарственных воздействий:
- антибиотики;
- α-адреноблокаторы;
- м-холинолитики;
- анальгетики;
- миорелаксанты;
- антидепрессанты;
- фитопрепараты;
- психологическое вмешательство;
- простатнаправленная терапия;
- акупунктура и различная физиотерапия тазового дна.
- Требуются дальнейшие исследования, чтобы более полно оценить возможности терапии различных форм ХП.



