Актуальность. Структурные изменения соединительной ткани слизистой оболочки влагалища зачастую служат причиной стрессового недержания мочи и возникновения паравагинальных дефектов [1, 2]. При этом уже известны определенные различия структуры коллагена в соединительной ткани слизистой влагалища у здоровых женщин и у пациенток со стрессовым недержанием мочи [3, 4]. Беременность и роды не могут не отражаться на состоянии и функции органов малого таза у женщин в послеродовом периоде. Степень тяжести и сроки возникновения стрессового недержания мочи находятся в прямой зависимости от состояния и структуры соединительной ткани [5].
Целью нашего исследования стало изучение морфологических и структурных изменений соединительной ткани слизистой оболочки влагалища и кожи промежности у женщин со стрессовой формой недержания мочи.
Материалы и методы. На клинических базах кафедры урологии с курсом ИДПО и кафедры акушерства и гинекологии № 2 с 2010 по 2013 г. под наблюдением находилась 71 пациентка репродуктивного возраста со стрессовым недержанием мочи (основная группа). Возраст пациенток составил 33 (31; 36) года. До оперативного лечения (уретропексия коллагеновым материалом) с диагностической целью с согласия пациенток был взят биоптат слизистой влагалища и кожи промежности (2–5 мм). Контрольную группу составили 80 женщин (средний возраст – 26 [22; 28] лет) без признаков недержания мочи до и во время беременности, у которых также был взят биоптат (2–5 мм) с краев разрыва (эпизиотомной раны) кожи промежности и слизистой влагалища после первых срочных родов.
 В основной группе чаще встречались женщины, имеющие в анамнезе 3 (19 [26,7%] пациенток) и 4 (16 [22,5% случаев]) беременности; в контрольной группе таких женщин было 9 (11,2%) (р=0,013) и 5 (6,25%) (р=0,004) соответственно. В основной группе имели в анамнезе прерывание беременности в виде хирургического аборта и спонтанного аборта с выскабливанием полости матки 12(16,9%) из 11(15,4%) женщин соответственно. При этом однократное прерывание беременности в основной группе было у 18 (25,3%) женщин, двукратное – у 11 (15,4%), трехкратное – у 2 (2,8%); в контрольной – у 57 (71,2%) (р=0,028), 21 (26,2%) (р=0,476) и 1 (1,25%) соответственно. В основной группе преждевременные роды были в 5 (7,04)% наблюдениях, быстрые – в 3 (4,23%) и стремительные – в 5 (7,04%); в контрольной группе – в 4 (5%) (р=0,427), 3 (3,7%) (р=0,394) и 3 (3,7%) (р=0,295) наблюдениях соответственно. Родоразрешение с применением вакуум-экстракции плода имело место у 9 (12,68%) повторнородящих женщин основной группы и у 1 (1,25%) – контрольной (р=0,0064). Среди первородящих повреждение мягких тканей родовых путей имели 48 (67,6%) женщин основной группы и 27 (33,7%) – контрольной. Нарушение целостности мягких тканей родовых путей в результате эпизиотомии имело место в 19 (26,7%) случаях в основной группе и в 5 (6,2%) – в контрольной (р=0,0006). Повреждение родовых путей в основной группе в результате перинеотомии было в 7 (9,8%) случаях, разрывы промежности II степени – в 4 (5,6%) и разрывы шейки матки – в 11 (15,4%), в контрольной группе – в 4 (5%) (р=0,202), 6 (7,5%) (р=0,447) и 6 (7,5 %) случаях (р=0,098) соответственно.
В основной группе чаще встречались женщины, имеющие в анамнезе 3 (19 [26,7%] пациенток) и 4 (16 [22,5% случаев]) беременности; в контрольной группе таких женщин было 9 (11,2%) (р=0,013) и 5 (6,25%) (р=0,004) соответственно. В основной группе имели в анамнезе прерывание беременности в виде хирургического аборта и спонтанного аборта с выскабливанием полости матки 12(16,9%) из 11(15,4%) женщин соответственно. При этом однократное прерывание беременности в основной группе было у 18 (25,3%) женщин, двукратное – у 11 (15,4%), трехкратное – у 2 (2,8%); в контрольной – у 57 (71,2%) (р=0,028), 21 (26,2%) (р=0,476) и 1 (1,25%) соответственно. В основной группе преждевременные роды были в 5 (7,04)% наблюдениях, быстрые – в 3 (4,23%) и стремительные – в 5 (7,04%); в контрольной группе – в 4 (5%) (р=0,427), 3 (3,7%) (р=0,394) и 3 (3,7%) (р=0,295) наблюдениях соответственно. Родоразрешение с применением вакуум-экстракции плода имело место у 9 (12,68%) повторнородящих женщин основной группы и у 1 (1,25%) – контрольной (р=0,0064). Среди первородящих повреждение мягких тканей родовых путей имели 48 (67,6%) женщин основной группы и 27 (33,7%) – контрольной. Нарушение целостности мягких тканей родовых путей в результате эпизиотомии имело место в 19 (26,7%) случаях в основной группе и в 5 (6,2%) – в контрольной (р=0,0006). Повреждение родовых путей в основной группе в результате перинеотомии было в 7 (9,8%) случаях, разрывы промежности II степени – в 4 (5,6%) и разрывы шейки матки – в 11 (15,4%), в контрольной группе – в 4 (5%) (р=0,202), 6 (7,5%) (р=0,447) и 6 (7,5 %) случаях (р=0,098) соответственно.
В силу своей очевидности наиболее изучена зависимость риска травмы промежности от массы плода. Так, масса новорожденных в диапазоне 3000–3499 г в основной группе была у 39 (54,9%) женщин, тогда как в контрольной – у 26 (32,5%; р=0,0045).
Согласно данным урофлоуметрии, в основной группе ТQ (время достижения максимальной скорости) составило 13,9 с, Qmax (максимальная объемная скорость потока мочи) – 44,1 мл/с, Vcomp (объем мочевого пузыря) – 290,2 мл; в контрольной – 15,5 с; 27,2 мл/с и 251,1 мл соответственно.
 Длина уретры в основной группе при ультразвуковом исследовании составила 1,7 см, в контрольной – 3,3 см, ширина проксимального отдела уретры – 1,2 и 0,9 см соответственно. Отмечено воронкообразное расширение и укорочение уретры, которое расценивается как сфинктерная недостаточность уретры в основной группе.
Длина уретры в основной группе при ультразвуковом исследовании составила 1,7 см, в контрольной – 3,3 см, ширина проксимального отдела уретры – 1,2 и 0,9 см соответственно. Отмечено воронкообразное расширение и укорочение уретры, которое расценивается как сфинктерная недостаточность уретры в основной группе.
Биоптат кожи промежности и слизистой влагалища пациенток фиксировали в 10%-ном нейтральном формалине и заливали в парафин по общепринятым стандартным методикам [5]. Парафиновые срезы для общего обзорного исследования окрашивали гематоксилином и эозином, для исследования структуры соединительной ткани – по Ван–Гизону и по Маллори [5]. Для выявления в тканях эластических волокон проводили специфическую окраску на эластин по Вейгерту [5].
Для иммуногистохимических исследований с каждого парафинового образца было сделано по 3 криостатных среза и фиксированы на отдельных стеклах с поли-L-лизиновым покрытием. На каждый из срезов были нанесены кроличьи антитела, специфичные к коллагену I, III, IV типов человека соответственно, в разведении 1:500, 1:1000, 1:500 («ИМТЕК», Россия). Изучали и фотографировали препараты под световым микроскопом Leica DM 300 («Leica», Германия).
Статистическая обработка результатов проведена в операционной среде Windows XP с использованием статистической программы «Statistica 6.0». Характер распределения количественных признаков оценивался по критерию Колмогорова–Смирнова.
Результаты. При гистологическом исследовании биоптатов кожи промежности пациенток мы учитывали строение многослойного эпителия, расположение в нем клеток и их структуру, наличие и состояние базальной мембраны, структуру коллагеновых и эластических волокон соединительнотканной пластинки кожи, состояние сосудов, степень инфильтрации ткани клеточными элементами и клеточный состав.
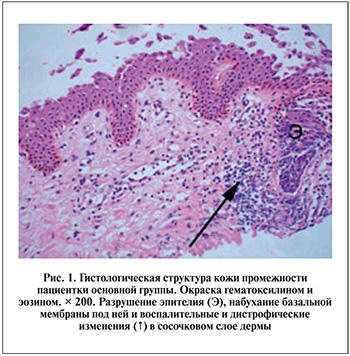
В основной группе пациенток, в отличие от контрольной группы, в эпителиальном пласте кроме общего утолщения и усиленного слущивания рогового слоя определялись вакуолизация шиповатых клеток, уплотнение и сморщивание их ядер, отмечался отек как самих клеток, так и межклеточных пространств. В отдельных случаях разрушения эпителиального пласта были более выраженными, деструкции подвергались глубокие клеточные слои вплоть до базального. В таких участках базальные мембраны эпителия набухали, местами подвергались расплавлению, а сосочковый слой дермы также становился отечным и имел признаки дистрофических изменений в виде мукоидного набухания межуточного вещества и фибриноидного набухания коллагеновых волокон (рис. 1).
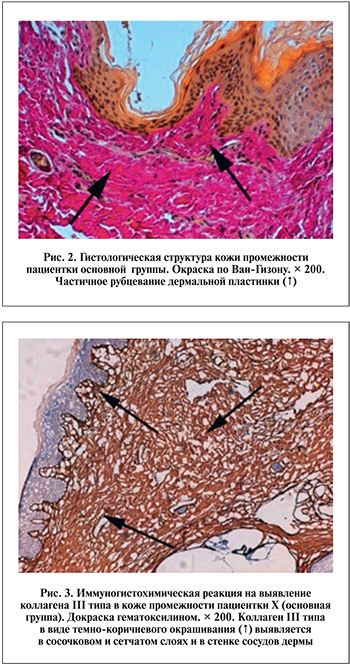
На гистологических препаратах, окрашенных по Вейгерту, в отличие от контрольной группы, выявлено лишь небольшое количество эластических волокон. Тонкие эластические волокна определены большей частью в области вокруг желез и волосяных луковиц. При такой морфологической картине кожа промежности пациенток основной группы, несомненно, должна была обладать низкой степенью растяжимости. Последствием описываемых воспалительных и деструктивных очагов в тканях обычно являются разворачивающиеся как результат компенсаторно-восстановительных процессов фиброзные или рубцовые преобразования, что мы и наблюдали очагово в сосочковом и сетчатом слоях дермальной пластинки кожи промежности у многих пациенток (рис. 2).
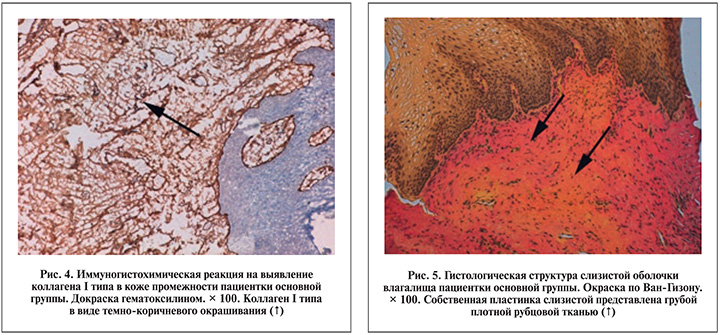
Результаты иммуногистохимических исследований с применением моноклональных антител показали, что содержание коллагена различных типов в соединительной ткани промежности пациенток основной группы отличалось от такового в контрольной группе. В дерме кожи промежности пациенток основной группы с выраженными патоморфологическими изменениями наряду с характерным для кожи коллагеном I типа в значительном количестве определен не характерный для кожи «незрелый» коллаген III типа (рис. 3). Он выявлен в строме соединительнотканной пластинки как в сосочковом, так и в сетчатом слое, а также в толще сосудистых стенок. В отличие от кожи промежности пациенток контрольной группы коллаген I типа в дермальной пластинке кожи определен не столь интенсивно (рис. 4).
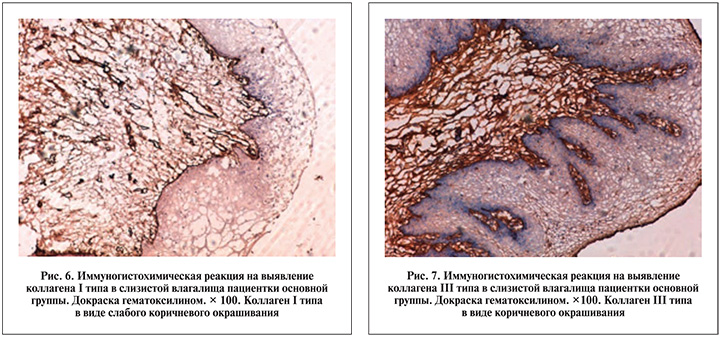
При гистологическом исследовании слизистой влагалища у пациенток основной группы выявлены признаки воспалительного процесса. В тяжелых случаях наблюдалась десквамация (слущивание) многослойного плоского неороговевающего эпителия вплоть до обнажения подслизистого слоя. В таких зонах определено полное разрушение базальной мембраны эпителия. В собственной пластинке слизистой влагалища отмечен выраженный отек, полнокровие сосудов, часто выявлялись очаги обширных кровоизлияний. Коллагеновые волокна набухали, гомогенизировались и подвергались деструкции. На их месте в конечном итоге появлялась грубая, очень плотная, почти бессосудистая неоформленная соединительная ткань, формирующая рубец (рис. 5). В собственной пластинке определены спавшиеся склерозированные сосуды, окруженные грубыми и толстыми коллагеновыми волокнами, которые их сильно сдавливали. В отличие от контрольной группы, в рубцующейся видоизмененной собственной пластинке слизистой оболочки основной группы пациенток эластические волокна почти не определялись.
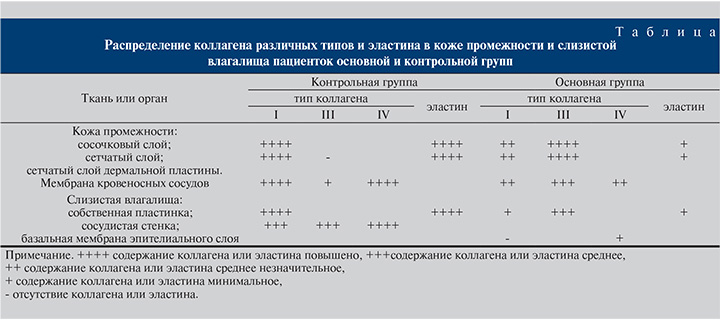
В слизистой оболочке влагалища пациенток основной группы выявленные значительные патоморфологические изменения в виде воспалительных и деструктивных процессов сопровождались изменением соотношения содержания в соединительной ткани коллагенов различных типов. При иммуногистохимическом исследовании с применением моноклональных антител на выявление коллагена I типа определялось слабое окрашивание отдельных волокнистых элементов собственной пластинки слизистой оболочки влагалища (рис. 6). Коллаген III типа выявлялся более интенсивно в виде темно-коричневого окрашивания коллагеновых волокон (рис. 7). Вследствие уменьшения количества сосудов и разрушения их базальных мембран и базальной мембраны эпителиального слоя заметно снижалось количество коллагена IV типа (см. таблицу).
Обсуждение. Таким образом, при гистологическом и иммуногистохимическом исследованиях биопсий кожи промежности и слизистой влагалища пациенток основной группы нами были выявлены патоморфологические изменения различной степени выраженности – от признаков воспалительных и деструктивных процессов до рубцовой реорганизации собственной пластинки слизистой оболочки влагалища и дермальной пластинки кожи промежности, которые сопровождались изменением содержания в тканях коллагенов различного типа. Исследования показали, что стрессовое недержание мочи может быть результатом процессов, при котором в собственной пластинке слизистой оболочки влагалища и дермальной пластинке кожи промежности изменяется соотношение коллагенов различного типа (преобладание коллагена III вместо коллагена I типа, снижение в базальных мембранах количества специфичного коллагена IV типа) и разрушаются эластические волокна, являющиеся вместе с коллагеновыми волокнами опорным каркасом кожи и вместе с межуточным веществом придающие ей упругость, а также эластичность при растяжении [7]. Имеются данные о смене типов коллагена в условиях патологии [8]. Установлено, что в грануляционной ткани, формирующейся в зонах регенерации тканей после воспалительных и деструктивных процессов, сначала преобладает коллаген III типа, сменяясь по мере созревания на коллаген I типа. При этом в рубцовой ткани, которая характеризуется незрелостью клеточных элементов, сохраняется высокое содержание коллагена III типа.
Кроме того, нужно принять во внимание, что в репаративных процессах при воспалении, а также в регуляции роста и дифференцировки клеток в тканях, в формировании волокнистых структур соединительной ткани и обеспечении их механических свойств, в том числе и эластичности, непосредственно участвуют протеогликаны и гликозаминогликаны, в большом количестве содержащиеся в межуточном веществе соединительной ткани [8]. В сформировавшейся при патологии плотной бесструктурной рубцовой ткани межуточное вещество между пучками коллагеновых волокон почти отсутствует, поэтому естественно, что гликозаминогликаны содержатся в минимальном количестве и этот факт тоже вносит свою лепту в снижение упругих свойств тканей кожи промежности и собственной пластинки слизистой влагалища у пациенток со стрессовой формой недержания мочи.
Заключение. В слизистой оболочке влагалища и кожи промежности у женщин со стрессовой формой недержания мочи выявлены выраженные патоморфологические изменения в виде признаков воспалительных, деструктивных и компенсаторно-приспособительных процессов, приводящих к рубцеванию соединительной ткани и изменению соотношения в тканях коллагенов различного типа.



