Введение. Несмотря на развитие и совершенствование медицинского инструментария и методик оперативного удаления камней, применение консервативных мероприятий, способствующих самостоятельному отхождению камней и их фрагментов, не теряет своей актуальности. Наиболее часто с этой целью используют диуретики и спазмолитики, а также повышенную водную нагрузку [1, 2]. По мере накопления знаний о молекулярно-биохимических особенностях физиологии гладкомышечных клеток мочеточника и развития фармакологии растет интерес к медикаментозным
средствам, которые могли бы существенно ускорить процесс самостоятельного отхождения камней [3–5]. Физиологические изменения, происходящие при воздействии на мочеточник фармакологических агентов – антагонистов α1-адренорецепторов, наталкивают на возможность использования этих препаратов в комплексе консервативной терапии при конкрементах мочевыводящих путей [6—8]. Более того, применение этих препаратов может снижать частоту повторных болевых приступов и в целом выраженность болевой симптоматики на фоне лечения.
Целью работы явилась оценка эффективности и безопасности применения α1-адреноблокаторов в комплексном лечении камней мочеточника.
В задачи исследования входили оценка эффективности и сроков применения α1-адреноблокаторов при конкрементах мочеточника по сравнению со стандартно используемыми спазмолитиками; оценка
вероятности самостоятельного отхождения камней в зависимости от их размера и локализации на фоне применения α1-адреноблокаторов по сравнению со стандартными спазмолитиками: оценка вероятности достижения миграции камней из проксимальных отделов мочеточника в дистальный на фоне применения α1-адреноблокаторов по сравнению со стандартной терапией; определение выраженности влияния на возможность отхождения конкремента таких предикторов, как размер камня, его локализация и характер терапии; оценка выраженности болей при проведении консервативной терапии с использованием α1-адреноблокаторов; оценка безопасности назначения α1-адреноблокаторов с целью консервативного лечения камней мочеточника.
Материалы и методы. Проведено сравнительное проспективное плацебо-неконтролируемое нерандомизированное одноцентровое исследование с участием 118 пациентов с единичными конкрементами различных отделов мочеточника.
Всем пациентам после купирования болей проведена консервативная терапия, направленная на самостоятельное отхождение конкрементов. Максимальная длительность консервативного лечения составила 28 сут. Еженедельно у всех пациентов осуществлялся ультразвуковой мониторинг.
Поскольку плотность распределения α1-адренорецепторов по данным проведенных исследований [9,
10] выраженно различается в нижней трети мочеточника и остальных его отделах, мы выделяли проксимальную и дистальную локализацию конкрементов, которую определяли по отношению к терминальной линии таза. Таким образом, к проксимальной локализации мы отнесли верхнюю и среднюю трети мочеточника, а к дистальной – только нижнюю треть. В зависимости от использованной схемы консервативной терапии пациенты были разделены на две группы. Больным контрольной группы (n=58) назначили только стандартную терапию – спазмолитик и анальгетики (по показаниям). В качестве спазмолитика мы применили широко применяемый в урологической практике дротаверин (но-шпа) по 40 мг 3 раза в сутки, действие которого связано с неспецифическим ингибированием фосфодиэстеразы – ключевого фермента функционирования гладкомышечных клеток. В основной группе (n=60) наряду со стандартными препаратами пациенты получали α1-адреноблокатор тамсулозин. Данный препарат, являясь селективным антагонистом α1А/D-подтипов адренорецепторов, практически не воздействует на α1В-подтип рецепторов, локализованных преимущественно в гладкомышечных клетках кровеносных сосудов. Этим объясняются хорошая переносимость тамсулозина пациентами и низкая частота развития неблагоприятных эффектов
[11]. Тамсулозин назначали в стандартной дозе 0,4 мг 1 раз в сутки.
В случае если приходилось менять первоначальную тактику лечения, данный факт мы относили к числу
цензурированных наблюдений. Кроме того, к цензурированным наблюдениям относили факт отказа
пациента от приема α1-адреноблокатора.
В исследование не включены пациенты с обструкцией единственно функционирующей почки; аномалией мочеточника; выраженными патологическими изменениями позвоночника; оперированных на верхних мочевыводящих путях; выраженной дилатацией верхних мочевыводящих путей; некупирующимся приступом почечной колики; сопутствующими заболеваниями в стадии декомпенсации; выраженной степенью снижения скорости клубочковой фильтрации (<30 мл/мин/1,73 м2); склонностью к гипотонии; непереносимостью α1-адреноблокаторов по данным анамнеза.
Для оценки выраженности боли на фоне лечения использована числовая рейтинговая шкала боли [12].
Статистическая обработка результатов исследования проведена с использованием статистического пакета программ STATISICA 8.0 для Windows (StatSoft Inc., США). Различия качественных данных проанализированы с помощью критерия χ2; при частоте количественных данных не более 5 использован точный тест Фишера. Для оценки достоверности различий средних между группами применен непараметрический критерий Манна—Уитни, для оценки повторных изменений – дисперсионный анализ Friedmen. Для оценки общей вероятности наступления самостоятельного отхождения конкрементов и “каменной дорожки”, а также медианы отхождения использован моментный метод Каплана–Мейера с графическим отображением. Для оценки достоверности различий между кривыми использован log-rank-критерий. Анализ выраженности влияния факторов, обеспечивающих самостоятельное отхождение конкрементов, осуществлен путем построения однофакторной и многофакторной логистической регрессионных моделей Cox (Statistical Package for Social Sciences, version 15, SPSS, Chicago, IL). Достоверными считали различия при р<0,05.
Результаты. Распределение пациентов в зависимости от локализации конкрементов в мочеточнике
в обеих группах лечения было сходным (табл. 1). Наиболее часто конкременты локализовались в дистальной части мочеточника – 83 (79 %) пациента.
Талбица 1. Распределение пациентов в зависимости от локализации конкрементов в мочеточнике.
Обе группы пациентов были сходными по основным характеристикам: возрасту, гендерному сотношению, стороне локализации конкремента и среднему его размеру. Результаты лечения оценивали в зависимости от исходного уровня локализации конкрементов.
Полученные кривые (рис. 1) дают основание полагать, что общая вероятность отхождения конкрементов, локализованных в дистальной части мочеточника, была достоверно выше в основной группе пациентов, получавших α1-адреноблокатор, по сравнению с контрольной группой пациентов, получавших только стандартную терапию (85 против 66%; р=0,02).
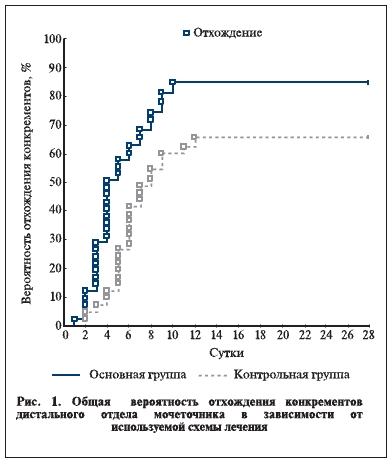
При сравнении выраженности болей на фоне проводимой терапии было отмечено, что повторные приступы, соответствующие уровню “выраженный”, гораздо чаще возникали у больных контрольной группы (25 против 9%; р=0,03).
Медиана интенсивности боли у больных основной группы была достоверно (р=0,003) меньше по сравнению с контрольной (рис. 2).
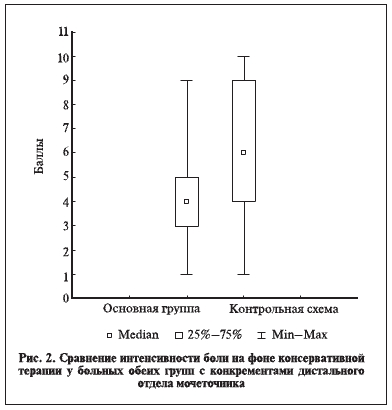
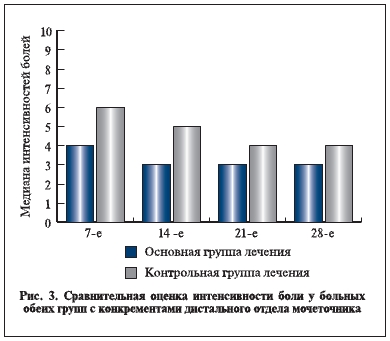
Сравнительный анализ динамики интенсивности болей при использовании двух вариантов терапии
продемонстрировал, что у больных основной группы болевая симптоматика гораздо лучше контролировалась даже в том случае, если отхождения конкрементов отмечены не были (рис. 3).
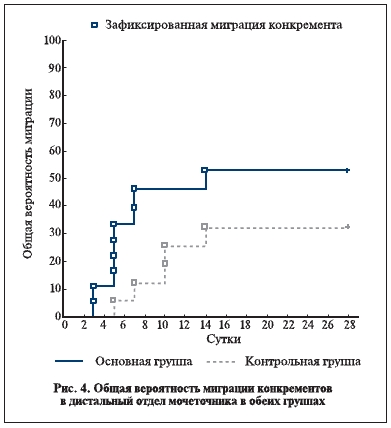
Результаты лечения пациентов с камнями проксимальной локализации продемонстрировали следующие закономерности. Общая вероятность миграции конкрементов в дистальный отдел мочеточника в основной группе была выше – 52 против 32 % (р=0,17). Медиана вероятности отхождения конкремента у пациентов основной группы составила 6 сут, в то время как в контрольной
группе достижений этого показателя не отмечено (рис. 4).
Интенсивность боли в течение первых 7 сут лечения в зависимости от использованной терапии достоверно различалась (р=0,046; рис. 5).
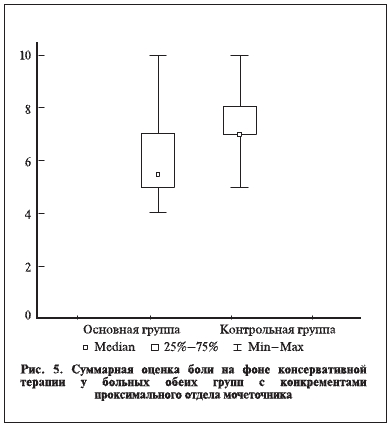
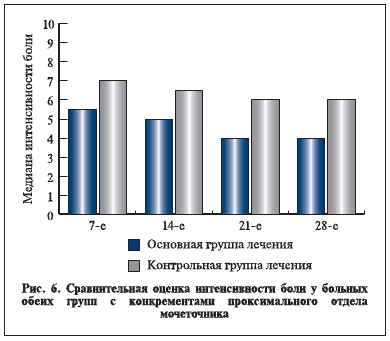
Сравнительный анализ выраженности болей в динамике продемонстрировал, что у больных основной
группы боль лучше поддавалась контролю во все периоды наблюдения, включая 21-е и 28-е сут. Медиана интенсивности болей в тот период времени (рис. 6) составила 4 балла в основной группе и 6 – в контрольной (р=0,031).
В целом частота встречаемости неблагоприятных эффектов в обеих группах была сопоставимой.
Достоверно чаще в основной группе пациентов, получавших α1-адреноблокаторы, имели место головокружение, постуральная гипотензия и слабость (табл. 2). Результаты анализа рисков отхождения конкрементов с использованием модели пропорциональных рисков приведены в табл. 3.
Таблица 2. Частота встречаемости нежелательных эффектов в зависимости от схемы лечения.
Таблица 3. Отношение рисков (OR) отхождения конкрементов в зависимости от влияния различных факторов (однофакторный и многофакторный варианты анализа).
Обсуждение. Лечение конкрементов мочеточника преследует две цели: устранить влияние тех факторов, которые препятствуют миграции конкремента по мочеточнику, и уменьшить выраженность боли во время миграции. К факторам, которые могут препятствовать миграции конкремента, но в то же время доступны для медикаментозного воздействия, относят отек стенки мочеточника, его спазм
и мочевую инфекцию. Основной принцип консервативной терапии при конкрементах мочеточника
должен заключаться в создании условий для прохождения тока мочи дистальнее конкремента, что в
свою очередь будет способствовать его продвижению по мочеточнику [13].
Предупреждение развития повторных болевых приступов и снижение общего дискомфорта в ходе
миграции конкремента достигаются за счет блокирования чрезмерной перистальтической активности
гладкой мускулатуры мочеточника и снижения проведения болевой импульсации по афферентным волокнам к центрам болевой чувствительности, локализованным в спинном мозге [14, 15].
Фармакологическим агентом, воздействие которого позволяет совместить оба эти принципа лечения,
являются α1-адреноблокаторы. Детально выяснено, что в стенке мочеточника присутствует значительное количество различных подтипов α1-адренорецепторов, причем наибольшая их плотность отмечается в дистальной части мочеточника [9, 10]. В многочисленных экспериментах показано, что применение антагонистов α1-адренорецепторов вызывает уменьшение перистальтической активности мочеточника, снижение базального тонуса и уменьшение внутрипросветного давления [16–18]. Все эти аспекты должны способствовать улучшению транспорта мочи. При сравнении эффекта от применения фармакологических агентов разных классов веществ было продемонстрировано, что α1-адреноблокаторы обладают наибольшим эффектом в отношении описанных свойств мочеточника [19]. Выбор тамсулозина был обусловлен тем, что данный фармакологический агент хорошо переносится пациентами, а его лекарственная форма удобна в
применении.
Проведенное исследование наглядно показало, что включение α1-адреноблокатора в схему лечения существенно повышало вероятность отхождения конкремента или его миграции по мочеточнику.
Использование α1-адреноблокатора также обеспечивало хороший контроль болевой симптоматики.
Назначение тамсулозина способствовало меньшей интенсивности болевых приступов и частоте повторных интенсивных приступов боли как в течение 1-й недели, так и при более длительном наблюдении за пациентами.
Эффект от назначения α1-адреноблокаторов был отмечен только в течение первых двух недель. При
дальнейшем наблюдении отхождений конкрементов отмечено не было, что не отличалось от использования только обычных спазмолитиков.
Назначение пациентам лечение α1-адреноблокаторами совместно с блокаторами фосфодиэстеразы не приводило к появлению значительного числа неблагоприятных эффектов. Достоверно чаще у них
отмечались лишь неблагоприятные эффекты, связанные с блокированием α1-адренорецепторов, локализованных в сосудистой стенке: постуральная гипотензия, головокружение. И только у одного пациента зафиксирован отказ от приема препарата.
Заключение. Таким образом, результаты нашего исследования, в том числе проведенных однофакторного и многофакторного анализов модели пропорциональных рисков, продемонстрировали, что характер применяемой терапии напрямую влиял на отхождение конкрементов из дистального отдела мочеточника. Включение в схему лечения α1-адреноблокатора увеличивало вероятность отхождения конкремента в 4,11 раза.



