Введение. На долю почечно-клеточного рака (ПКР) приходится 91–95% всех случаев выявленных новообразований паренхимы почки. Оставшиеся 5–9% опухолей почки являются доброкачественными [1]. ПКР представляет собой семейство опухолей, детерминируемых различными генетическими аномалиями, объединенных общим происхождением из эпителия мочевых канальцев. В структуре общей онкологической заболеваемости в РФ злокачественные новообразования почек составляют 2–3% и занимают 10-е ранговое место [2, 3].
За 10-летний период в России ПКР среди всех онкологических заболеваний по темпам прироста устойчиво занимает 2-е место, уступая “первенство” раку предстательной железы [3, 4]. В большой степени такой стремительный темп прироста объясняется широким внедрением в клиническую практику методов неинвазивной визуализации опухоли. Ультразвуковое исследование и компьютерная томография увеличили выявляемость злокачественных опухолей почек на ранних (клинически бессимптомных) стадиях. По данным [5], опухоли малых размеров составляют 60–70% всех диагностируемых новообразований почек. Выявление локализованных форм ПКР способствует реализации органосохраняющего подхода к лечению этого заболевания. В настоящее время прослеживается четкая тенденция расширения показаний к резекции почки пациентов с опухолями небольших размеров.
Основным аргументом в пользу выполнения парциальной нефрэктомии служит возможность сохранения максимального объема функционирующей почечной паренхимы, что позволяет избегать ренопривного состояния, необходимости проведения программного гемодиализа и связанных с ним осложнений. По результатам опубликованных исследований, через 10 лет после оперативного лечения
вероятность возникновения хронический почечной недостаточности в 2 раза выше у пациентов, подвергнутых нефрэктомии, по сравнению с теми, кому выполнена резекция почки [6].
В современных стандартах резекция почки является методом выбора в лечении больных злокачественной опухолью этого органа на стадии опухолевого процесса Т1аN0M0. На этой стадии онкологического процесса общая и безрецидивная 5-летняя выживаемость пациентов после резекции почки сопоставима с таковой после радикальной нефрэктомии [7–12].
В литературе последних лет все чаще встречаются публикации о допустимости выполнения органосберегающего вмешательства на стадиях опухолевого процесса Т1b–T3, в том числе и из лапароскопического доступа. На основании полученных промежуточных данных приводятся следующие выводы: для пациентов с опухолью размером более 4 см резекция почки по онкологической эффективности сопоставима с радикальной нефрэктомией, а в отношении сохранения функции почки значительно ее превосходит [13–20].
Открытая резекция на сегодняшний день остается стандартом оперативного лечения при злокачественном поражении почки. Определены показания и противопоказания к данному виду вмешательства, предложены различные способы выполнения операции и профилактики осложнений.
Эпоха нефронсберегающих операций в эндовидеохирургии ведет свой отсчет с 1993 г., когда H. Winfield впервые выполнил лапароскопическую резекцию почки пациенту с доброкачественной опухолью [21]. Последующие годы ознаменованы революционными преобразованиями в сфере эндовидеотехнологий и постоянным совершенствованием техники лапароскопической парциальной нефрэктомии, что в конечном итоге привело к улучшению результатов и росту популярности вмешательства из этого доступа. Частота осложнений сократилась настолько, что результаты этих операций стали сопоставимыми с таковыми после выполнения “золотого” общепризнанного стандарта — открытой резекции [22].
Несмотря на всю привлекательность концепции малоинвазивного вмешательства при опухолях почки малых размеров, лапароскопическая резекция до сих пор не получила широкого распространения и выполняется в основном в крупных урологических клиниках, так как не всегда удается завершить операцию по ранее запланированному органосберегающему малотравматичному сценарию. Основным
препятствием к осуществлению лапароскопической нефронсберегающей операции являются технические трудности, связанные с обеспечением надежного окончательного гемостаза. По данным разных авторов, кровотечение в послеоперационном периоде после резекции почки отмечено у 2–12% больных [23–25]. В литературе описаны различные методики достижения гемостаза при выполнении подобных вмешательств, предложены фармакологические средства, оригинальные лигатурные и комбинированные методы ушивания дефекта паренхимы почки [26–31]. При этом большинство авторов сходятся во мнении, что основным и наиболее надежным методом эффективного гемостаза при органосохраняющих операциях на почке остается лигатурный, а применение физических и химических гемостатических средств носит вспомогательный характер.
Целью нашего исследования стало изучение эффективности различных методов гемостаза при выполнении резекции почки из лапаро- и люмбоскопического доступов.
Материалы и методы. С февраля 2007 по февраль 2011 г. в Центре эндоскопической урологии и новых технологий Санкт-Петербурга выполнено 44 резекции почки с использованием эндовидеотехнологий. Среди прооперированных мужчин было 28, женщин — 16. Средний возраст пациентов составил 60,5±14,2 года.
Как видно из табл. 1, наиболее часто вмешательства производились по поводу злокачественных опухолей почки. Большая часть пациентов, которым выполнено органосохраняющее вмешательство по
поводу рака почки, – лица мужского пола, их число составило 26 (68,4%). По элективным показаниям
прооперирован 31 (70,5%) человек, по относительным – 13 (29,5%).
Таблица 1. Заболевания, послужившие причиной выполнения резекции почки.
У 26 (59,1%) пациентов в опухолевый процесс была вовлечена левая почка, у 18 (40,9%) – правая. В верхнем сегменте опухоль локализовалась в 29,5% случаев, в среднем – в 34,1%, в нижнем — в 36,4%
наблюдений.
Распределение больных по стадиям опухолевого процесса представлено в табл. 2. В абсолютном большинстве (81,5%) наблюдений органосохраняющее вмешательство выполнено на стадии опухоле-вого процесса Т1а. Минимальный размер опухоли составил 1,8, максимальный – 7,7 см. С целью
предупреждения возможности формирования в послеоперационном периоде мочевых затеков во всех случаях перед вмешательством выполнялось стентирование ипсилатерального мочеточника. В 38 случаях использован трансперитонеальный доступ, в 6 – ретроперитонеальный. Среднее время вмешательства при лапароскопическом доступе составило 132 (70–164) мин, при люмбоскопическом – 155 (110–196) мин.
Таблица 2. Стадии опухолевого процесса у больных, которым выполнена эндовидеохирургическая резекция почки.
В 38 (86,3%) из 44 вмешательств мы использовали метод энуклеорезекции в пределах неизмененных
тканей, при этом отступали от визуально определяемого края опухоли на 0,5–1,0 см. В 30 наблюдениях опухоль удаляли так называемым холодным способом – при помощи эндоскопических ножниц.
В остальных 8 наблюдениях при резекции почки использовали ультразвуковой диссектор Ultracision (Ethicon), 4 больным резекция произведена с использованием монополярной коагуляции или Liga Sure (Valleylab), а 2 пациентам выполнена радиочастотная абляция аппаратом Cooltip (Valleylab).
Из 30 пациентов 12 после холодной энуклеорезекции выполнена аргоноплазменная коагуляция зоны резекции аппаратом Forse Argon II (Valleylab) с последующим наложением гемостатических швов на
дефект паренхимы.
В 39 наблюдениях вмешательство выполнено в условиях тепловой ишемии. В оставшихся 5 наблюдениях резекция почки осуществлена без селективного пережатия почечной артерии: 3 пациентам с размером опухоли, не превышавшим 2,5 см, и в 2 случаях использования радиочастотной абляции. Для временного пережатия почечных сосудов использованы сосудистые зажимы Bulldog Clips
(Aesculap). Конструкция этих зажимов удобна, ибо она позволяет не только качественно пережимать артерию, но при этом и освобождать порт путем удаления установочного инструмента из троакара.
Среднее время тепловой ишемии составило 27 (11–39) мин, средняя интраоперационная кровопотеря — 210 (50–370) мл. При этом наибольшая кровопотеря отмечена в группе больных, которым резекция почки выполнена с использованием электрохиругических инструментов. Адекватная оценка кровопотери при использовании монополярной, биполярной типа Liga Sure, ультразвуковой и аргоноплазменной коагуляции не возможна в связи с отсутствием надежного интраоперационного гемостаза на резецированном участке паренхимы почки при использовании любого из перечисленных видов энергии. Во всех случаях применения электрохирургических инструментов потребовалось наложение гемостатических лигатурных швов.
Гистологическая структура удаленных опухолей представлена следующими вариантами: светлоклеточный ПКР – 32 (72,7%) случая, хромофильный ПКР – 4 (9,1%), хромофобный ПКР – 1 (2,3%), рак собирательных протоков – 1 (2,3%), ангиомиолипома – 5 (11,3%), онкоцитома – 1 (2,3%).
Для морфологической оценки качества гемостаза и степени воздействия электрохирургических инструментов на паренхиму проведено гистологическое исследование резецированного сегмента почки после применения биполярного и ультразвукового видов энергии. Кроме того, произведено экспериментальное исследование влияния радиочастотной энергии на почку кролика.
Анализу подвергнуты интра-, послеоперационные осложнения и радикализм операции (отсутствие
или наличие опухолевых элементов в хирургическом крае резекции).
Результаты и обсуждение. Во всех случаях использования моно-, биполярного (в виде Liga Sure) и ультразвукового видов коагуляции отмечен неустойчивый гемостаз, что потребовало дополнительного
наложения гемостатических швов на дефект паренхимы. Плохо контролируемое и непрогнозируемое
по объему воздействие энергии высокой частоты на паренхиматозный орган ограничивает сферу применения электрохирургических инструментов при нефронсберегающих операциях. По утверждению ряда авторов [32], микроскопические деструктивные изменения паренхимы формируются на глубине 1 см от поверхности дефекта, вызванного электрокоагуляцией.
Несмотря на качественный гемостаз, достигаемый при помощи Liga Sure на этапах мобилизации
сосудов, выделения почки из паранефральной клетчатки, эффективность коагуляции при выполнении
самой резекции почки крайне низка. Во всех случаях требовалось наложение гемостатических швов.
С помощью этой технологии произвести качественную резекцию почки без пережатия почечной артерии невозможно. Возникающее кровотечение носит интенсивный характер, активная аспирация изливающейся крови незначительно улучшает визуализацию операционного поля, что в конечном итоге не позволяет адекватно определять границы резекции.
При гистологическом исследовании удаленного препарата прицельно изучены парафиновые срезы толщиной 4 мкм тех участков ткани, которые подверглись воздействию Liga Sure. Для оценки общей
структуры паренхимы почки применена окраска гематоксилином и эозином, для оценки состояния
эпителия канальцев и стенки сосудов – гистохимическая методика: PAS-реакция.
В результате исследования обнаружено, что микроскопические деструктивные изменения в паренхиме почки выявляются на расстоянии до 1 см от поверхности зоны резекции (рис. 1). Эти изменения характеризуются острым субтотальным повреждением тканей в виде утраты щеточной каймы, дегенерации клеток с уплощением и слущиванием эпителия извитых канальцев. Стенки артерий
мелкого, среднего и крупного калибров утолщены. Определяются признаки выраженного полнокровия.
Таким образом, основные изменения в изученном материале характеризуются коагуляционным субтотальным острым некрозом канальцев. В доступной для анализа литературе нет работ, посвященных отдаленным последствиям такого воздействия на почку. Можно лишь предположить высокий риск склерозирования оставшегося сегмента почки. Закономерным исходом этого процесса является нефросклероз.
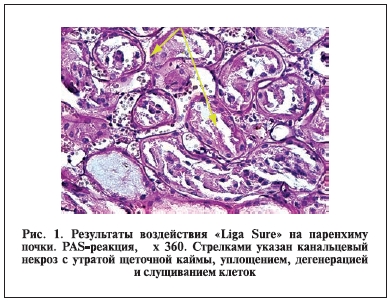
Еще одним серьезным недостатком использования высокочастотной энергии при парциальной нефрэктомии является затруднение в выборе границы резекции: в результате энергетического воздействия цвет неизмененной паренхимы и опухолевой ткани становится одинаковым, что не позволяет четко разграничить их.
Микроскопически “положительный хирургический край” имел место у 2 (5,3 %) человек, при оперировании которых использован ультразвуковой диссектор Ultracision (Johnson & Johnson). Им была
выполнена энуклеорезекция опухоли. В одном из этих двух случаев через 2 мес с момента резекции
почки возник местный рецидив ПКР, потребовавший выполнения радикальной нефрэктомии. При этом следует отметить, что у данного больного верифицирован редкий тип гистологической структуры
опухоли — рак собирательных протоков (протоков Беллини), отличающийся высокой степенью злокачественности. У второго пациента за 16 мес наблюдения признаков местного рецидива заболевания не выявлено. Как нам представляется, отсутствие рецидива в данном случае обусловлено отмеченными выше деструктивными изменениями в паренхиме почки, прилежащей к зоне резекции. При этом в литературе уже высказано мнение об отсутствии корреляции между “положительным краем” резекции и рецидивом ПКР [33].
Аналогичным образом мы изучили морфологические проявления воздействия ультразвукового диссектора на ткань почки (рис. 2, 3).
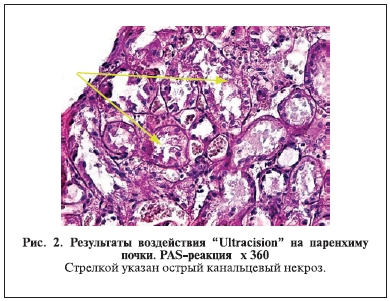
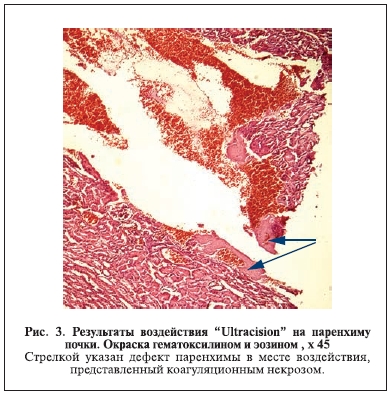
Распространенность зоны деструкции паренхимы почки при этом виде энергетического воздействия составила до 0,8 см. В этой зоне отмечены острый коагуляционный некроз в виде тканевого детрита (см. рис. 2), острое диффузное повреждение в виде утраты щеточной каймы в цитоплазме эпителиальных клеток извитых канальцев (см. рис. 3), неравномерное полнокровие сосудистого русла.
Коагулированных сосудов крупного калибра в зоне резекции не найдено.
В группе пациентов, к которым применялся метод “холодной” резекции с последующим наложением
гемостатического шва, значимого кровотечения из зоны резекции не было (50–120 мл), равно как и
“положительного хирургического края” при гистологическом исследовании.
По нашему мнению, для создания ишемии почки при нефронсберегающих вмешательствах достаточно
остановки только артериального притока. Пережатие всей почечной ножки не дает никаких преимуществ. Временное лигирование только почечной артерии обеспечивает хороший обзор зоны резекции. Использование аргоноплазменной коагуляции в 12 наблюдениях не улучшило гемостаза после “холодной” резекции. Необходимо отметить, что в тех случаях, когда ушивается полостная система почки, использование аргоноплазменной коагуляции может приводить к повреждению лигатуры. В подобных ситуациях важен порядок действий: вначале следует осуществлять коагуляцию и только потом прибегать к герметизации чашечно-лоханочной системы. Однако и при соблюдении этого правила не всегда удается качественно выполнять герметизацию, так как после коагуляции визуальное разграничение тканей чрезвычайно затруднено.
На этапе наложения гемостатических швов на зону резекции паренхимы почки мы рекомендуем фиксацию лигатур пластмассовыми клипсами Hemolok вместо традиционного формирования хирургического узла. По качеству гемостаза этот способ не уступает узловым швам, но по скорости выполнения существенно превосходит их, что в конечном итоге приводит к сокращению времени тепловой ишемии органа. Дополнительным преимуществом приведенной методики наложения гемостатического шва является снижение вероятности прорезывания паренхимы почки, так как основная нагрузка при натяжении и сведении краев раны в месте резекции ложится на клипсу, а не на шовный материал за счет линейного распределения усилия вдоль лигатуры (рис. 4).
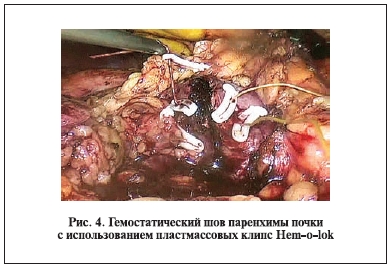
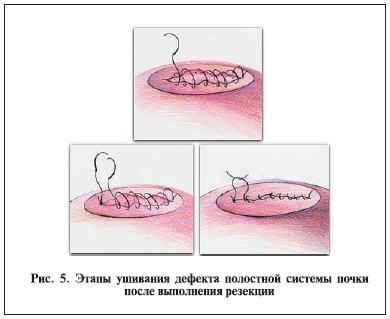
Для 12 (27,2%) пациентов в процессе выполнения нефронсберегающих вмешательств возникла необходимость устранения дефекта полостной системы. Решение этой проблемы сопряжено с трудностями, критичным увеличением времени тепловой ишемии, что заставляет многих специалистов отказываться от лапароскопических методов резекции почки. Восстановление герметичности чашечно-лоханочной системы достигается с помощью непрерывного шва лигатурой 2/0–3/0 на колющей игле кривизной 5/8. С целью упрощения завязывания последнегоузла мы прибегаем к методике, схематично отображенной на рис. 5.
Использование радиочастотной абляции позволяет производить резекцию почки без пережатия почечной артерии. При этом обеспечивается надежный гемостаз, не требующий дополнительного ушивания дефекта паренхимы. В одном случае на 5-е сутки после использования данного метода сформировался подпеченочный мочевой затек, потребовавший оперативного лечения в объеме релапароскопии и дренирования.
Еще у одного пациента в течение 6 дней после операции сохранялась интермиттирующая лихорадка.
Диагностический поиск причин этого состояния в данном случае результатов не дал.
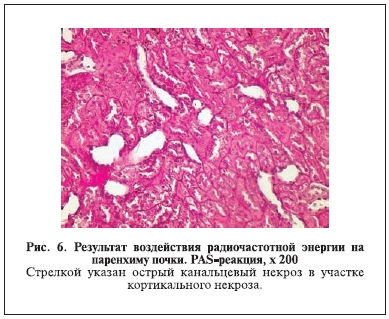
Для понимания сути развивающихся осложнений мы изучили морфологические изменения, возникающие в паренхиме почки после использования радиочастотной абляции. Проведено экспериментальное исследование почки кролика с гистологической оценкой органа после воздействия на него радиочастотной энергии. В фрагменте ткани почки кролика – цитоплазма эпителиальных клеток извитых канальцев с признаками субтотального острого повреждения в виде утраты щеточной каймы, дегенерации, уплощения и слущивания клеток. Определяются множественные очаги кортикального некроза (рис. 6).
Учитывая клинические данные и данные экспериментального исследования, мы пересмотрели свое отношение к методу радиочастотной абляции. Как нам представляется, этот метод должен иметь стро-гие показания к применению в связи с неконтролируемой зоной термического воздействия на паренхиму почки и невозможностью прогноза последующих деструктивных изменений в органе.
Средняя продолжительность послеоперационного койко-дня у пациентов, подвергнутых парциальной нефрэктомии из лапароскопического доступа,составила 7–8 дней. Ранняя активизация пациентов способствовала сокращению сроков пребывания пациентов в стационаре.
Большая часть осложнений послеоперационногопериода (парез кишки, нарушение функции внешнего дыхания) носила легкий и обратимый характер. Кровотечения из зоны резекции в послеоперационном периоде зафиксировано не было.
Выводы. Параллельно с развитием электрохирургических приборов появляются новые способы осуществления гемостаза при нефронсберегающих вмешательствах. Однако они не всегда отвечают необходимым требованиям, достоверно увеличивают время тепловой ишемии и кровопотерю. Несмотря на очевидный прогресс электрохирургических технологий, до настоящего времени наложение швов на дефект паренхимы наиболее адекватно решает задачи гемостаза при резекции почки. В экспериментальных исследованиях нами получены данные о значительном деструктивном воздействии электрохирургического инструмента на остающуюся паренхиму почки, в связи с чем выполнение этого вмешательства с использованием данных методик мы не рекомендуем. Лигатурный метод при осуществлении резекции почки по сей день остается надежным и безопасным методом достижения окончательного гемостаза.



