Введение. В структуре онкологической заболеваемости по Москве рак предстательной железы находится на втором месте после рака молочной железы [1]. На сегодняшний день одним из наиболее эффективных методов радикального лечения локализованного рака предстательной железы является радикальная простатэктомия. Начиная с 2000-х гг. в мире все большую популярность приобретает методика выполнения радикальной простатэктомии с роботической ассистенцией. Сейчас роботассистированная радикальная простатэктомия (РАРП) становится преимущественной альтернативой открытой хирургии. В клинике урологии МГМСУ им А. И. Евдокимова функционируют две роботизированные системы – da Vinci S (c 2008 г.) и da Vinci Si (c 2013 г.) Накоплен наибольший в России опыт выполнения РАРП – более 600 операций.
С появлением нового хирургического метода всегда возникает необходимость в оценке его эффективности и простоты освоения, поскольку даже самая многообещающая техника операции при низком уровне воспроизводимости не может быть рекомендована к широкому применению.
В настоящее время нет единого критерия оценки опыта хирурга. В мировой литературе наиболее часто используется термин «индивидуальная кривая обучения». Общепринятые критерии оценки данного показателя: продолжительность операции, объем кровопотери, частота гемотрансфузий, ча- стота осложнений, процент положительного хирургического края, продолжительность дренирования мочевого пузыря на основании анализа непрерывной серии операций [2, 3].
Цель настоящей работы: проанализировать кривые обучения трех хирургов для оценки скорости приобретения опыта РАРП, необходимого для снижения частоты послеоперационных осложнений.
Материалы и методы. В настоящее исследование включены 120 пациентов с верифицированным локализованным и местнораспространенным неметастатическим раком предстательной железы (T1–3aN0M0), перенесших оперативное лечение в объеме РАРП за период с ноября 2008 по март 2014 г. Операции выполнялись тремя «консольными» хирургами. Для каждого хирурга проведен анализ серии первых 40 операций. Каждая серия была разделена на 4 группы по 10 операций.
Все три хирурга к моменту включения в «роботическую программу» имели опыт выполнения более 100 радикальных позадилонных простатэктомий. Хирург № 3 регулярно на протяжении 10 лет осуществлял вмешательства из лапароскопического доступа. Двое других не имели предшествующего опыта лапароскопических операций.
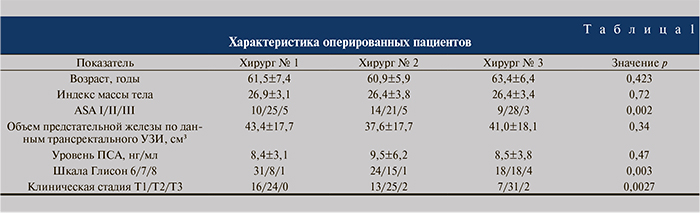
Пациенты, перенесшие трансуретральную резекцию предстательной железы, операции на органах малого таза, лучевую терапию, крио- или HIFU-терапию предстательной железы в анамнезе, ни в одну из трех серий включены не были, поскольку относятся к категории «сложных пациентов» и, по нашему мнению, не должны быть оперированы хирургом, находящимся на этапе «освоения методики». Результаты предоперационного обследования пациентов представлены в табл. 1.
Все роботассистированные операции выполняли из трансперитонеального доступа. Для наложения пневмоперитонеума применяли иглу Вереша или выполняли открытый доступ в брюшную полость (по Хасану). Во всех операциях мы использовали 6 лапароскопических портов (три для роботизированных манипуляторов, один оптический и два ассистентских). Первый порт 12 мм для камеры устанавливали через разрез над пупком (или ниже пупка, когда расстояние от лонного сочленения до пупка превышало 26 см). Два 8-миллиметровых порта для проведения роботических инструментов располагались по среднеключичной линии справа и слева на 2 см ниже пупка на расстоянии 9–11 см от первого. Третий 8-миллиметровый роботизированный порт – по передней подмышечной линии слева на расстоянии ладони между установленным ранее портом и гребнем подвздошной кости. Два ассистентских порта (5 и 12 мм) располагались по передней подмышечной линии справа.
Нервосохраняющий вариант РАРП выполняли сексуально активным пациентам группы низкого риска по D'Amico, частичное сохранение сосуди- сто-нервных пучков – пациентам со средним или высоким риском. При этом применяли как интра-, так и экстрафасциальную методику сохранения сосудисто-нервных пучков. Стандартная тазовая лимфаденэктомия, ограниченная наружной подвздошной и обтураторными зонами, выполнялась пациентам с вероятностью поражения регионарных лимфоузлов более 2% по номограмме Партина, расширенная – пациентам группы высокого риска прогрессирования заболевания (>T2c, ПСА>20 нг/мл, Глисон ≥8).
После перевязки дорсального венозного комплекса предстательную железу отделяли от шейки мочевого пузыря (антеградная методика), для идентификации которой использовали тракцию катетера Фолея с наполненным до 20 мл баллоном. При выделении семенных пузырьков применяли технику Мансури. Ножки предстательной железы клипировали с использованием гемостатических клипов Hem-o-loc. Перед формированием уретрошеечного анастомоза применяли шов Francesco Rocco, именуемый в некоторых публикациях «задней поддержкой» и обеспечивающий укрепление задней стенки уретрошеечного анастомоза и надежную фиксацию тканей. Для формирования уретрошеечного анастомоза использовали технику MVAC, подразумевающую применение шовного материала с иглой 5/8 и двумя иглами, при помощи которых шов накладывается непрерывно по правой и левой полуокружности анастомоза от 6 часов условного циферблата к 12 ч. Герметичность шва проверяли путем наполнения мочевого пузыря до 100 мл физиологическим раствором.
Этапы и техника выполнения РАРП у трех хирургов были идентичными. Следует отметить, что у хирурга № 1 имело место 5 запланированных конверсий в первых 20 операциях. Этот прием рекомендуется фирмой – производителем роботической системы для наилучшего понимания минимально- сти травмы, причиняемой окружающим органам и тканям, и размера операционного поля, который зачастую представляется обманчиво большим ввиду свойства эндоскопии увеличивать визуализируемые объекты в десятки раз. Вынужденных конверсий ни у одного хирурга не было.
В послеоперационном периоде страховой дренаж, установленный всем пациентам через контраппертуру к зоне операции, удаляли при наличии менее 100 мл отделяемого в сутки и отсутствии свободной жидкости по данным УЗИ. По результатам контрольной цистографии на 6-е сутки после операции принималось решение о завершении дренирования мочевого пузыря уретральным катетером.
В настоящем исследовании в рамках индивидуальной кривой обучения трех хирургов были собраны и проанализированы следующие данные: продолжительность операции, объем кровопотери, частота гемотрансфузий, частота осложнений, виды осложнений, процент положительного хирургического края (общий и при стадии pT2), продолжительность дренирования мочевого пузыря.
Статистическая обработка результатов была выполнена при помощи программы Excel (Microsoft) и Statistica; Package for Social Sciences v.16.0 (SPSS Inc, Chicago, Il, USA). Различия между сравниваемыми показателями являлись статистическо значимыми при р<0,05. Для определения р использовались следующие критерии – критерий Пирсона, Стьюдента, Фишера, Манн–Уитни.
Пациенты всех трех серий РАРП были сопо- ставимыми по предоперационным показателям, за исключением балла шкалы Глисона, клинической стадии заболевания (имело место увеличение доли пациентов с более высокими баллом Глисона и клинической стадией в каждой последующей серии) и анестезиологического риска ASA. Следует отметить, что начало выполнения РАРП хирургом № 2 совпало с моментом, когда хирург № 1 уже имел опыт выполнения примерно 200 РАРП. Хирург № 3 начал РАРП после того, как хирург № 1 преодолел отметку в 300 операций.

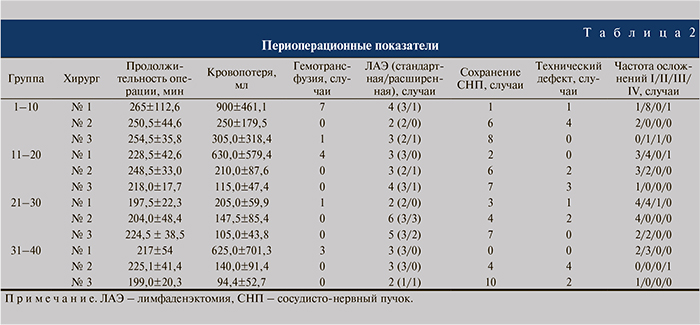
Результаты. Продолжительность операции в серии хирурга № 1 уменьшилась с 265±112,6 до 217±54,0 мин, хирурга № 2 – с 250,5±44,6 до 225,1±41,4 мин, хирурга № 3 – с 254,5±35,8 до 199,0±20,3 мин (табл. 2). При статистическом анализе выявлено значимое уменьшение времени операции внутри каждой из серий от начального показателя к конефному (р<0,05). При этом статистических различий в начальных и конечных показателях между сериями не обнаружено.
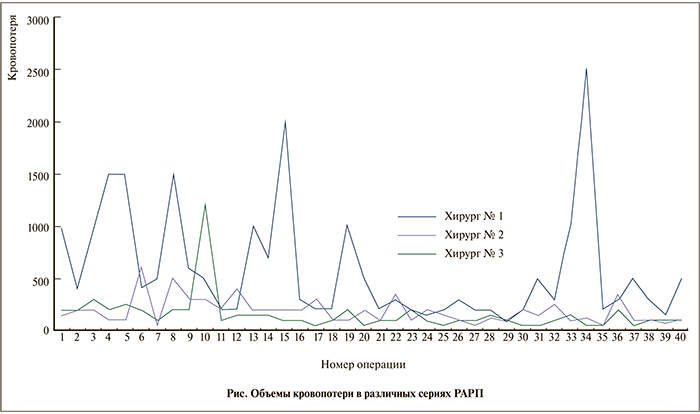
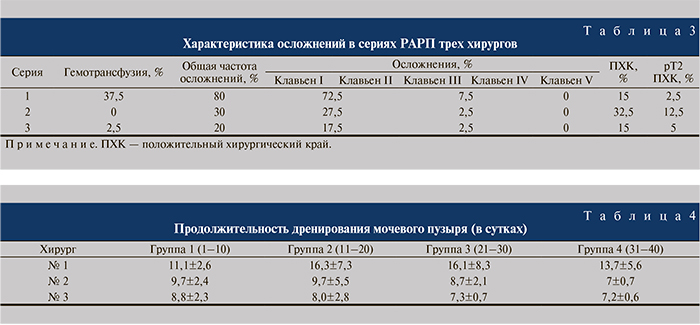
Величина кровопотери сокращалась с каждым последующим десятком выполненных операций во всех трех сериях (см. табл. 2). Внутри каждой серии отмечено статистически значимое уменьшение объема кровопотери (р<0,05). В отличие от времени операции мы зафиксировали статистическую разницу и при сравнении величины кровопотери между хирургами. Во второй, третей и четвертой десятках операций имеется статистическая разница между хирургами – наибольшая кровопотеря у первого хирурга, наименьшая – у третьего (р<0,05). В первой десятке операций разница показателей величины кровопотери имеет место между первым хирургом и двумя последующими. При этом между вторым и третьим статистической разницы не обнаружено. Динамика объемов интраоперационной кровопотери представлена на рисунке. Дефицит ОЦК восполняли переливанием солевых растворов, свежезамороженной плазмы, эритроцитарной массы. Потребность в гемотрансфузиях в серии хирурга № 1 возникла в 37,5% наблюдений, хирурга № 2 – в 0%, хирурга № 3 — в 2,5% (табл. 3). Разница в частоте гемотрансфузии статистически достоверна – р<0,05.
Лимфаденэктомию выполняли как по стандартной, так и по расширенной методике в зависимости от показаний (см. табл. 2).

Мы ввели показатель «технический дефект», под которым понимали наличие положительного хирургического края при стадии заболевания pT2 и/или наличие положительного хирургического края локализации, отличной от локализации имеющейся эк- стракапсулярной инвазии опухоли. Мы считаем, что данный показатель может представлять не меньший интерес, чем частота позитивного хирургического края как таковая. Технический дефект у хирурга № 1 регистрировали в 2 случаях, у хирурга № 2 – в 12, у хирурга № 3 – в 5, что подтверждает отсутствие влияния опыта выполнения лапароскопических вмешательств хирурга № 3 в этом компоненте операции.
Мы наблюдали снижение частоты осложнений при сравнении данных последующих серий с предыдущей, а также внутри каждой серии с увеличением количества выполненных операций (как общих, так и в группе малых [Клавьен I и Клавьен II] и больших [Клавьен III и Клавьен IV], табл. 2, 3). Отмечалось снижение числа пациентов с двумя и тремя осложнениями в каждой последующей серии. Так, у хирурга № 1 пациентов с двумя осложнениями было 5, с тремя – 1; у хирурга № 2 – 1 и 0; у хирурга № 3 – также 1 и 0 соответственно. Разница была статистически достоверной (р<0,05).
Как видно из табл. 4, продолжительность дренирования мочевого пузыря в серии хирурга № 1 была максимальной, а в сериях хирургов № 2 и № 3 была сопоставимой и не превышала 10 сут. По данным статистического анализа, разница между первым хиругом и последующими достоверна, между вторым и третьим – отсутствовала.
Профиль осложнений первых 40 операций каждого из трех хирургов представлен в табл. 5–7. Диагноз «несостоятельность уретрошеечного анастомоза» устанавливали при наличии затека контрастного вещества на контрольной цистограмме, выполненной спустя 7±2 дня после операции. Лимфорею констатировали при наличии характерного отделяемого по дренажу и отсутствии экстравазации контрастного вещества за пределы уретрошеечного анастомоза на контрольной цистограмме.

Стоит отметить, что в случаях с инфарктом миокарда и острым коронарным синдромом интраоперационная кровопотеря не превышала 500 мл.
Обсуждение. Кривая обучения новой хирургической методике всегда является предметом дискуссии. В литературе неоднократно обсуждалось отсутствие необходимости опыта предшествующих лапароскопических операций для успешного освоения методики роботических операций. Тем не менее D. Wood и соавт. опубликовали данные, согласно которым средняя продолжительность первых 10 РАРП значительно меньше у опытного лапароскопического хирурга (244 мин против 347) [4]. M. Menon и соавт. [5] считают, что достаточно выполнить 18 РАРП для достижения сопоставимого уровня эффективности лапароскопических простатэктомий, выполненных опытными хирургами. В нашем исследовании хирурги № 1 и № 2 подобного опыта не имели, в то время как хирург № 3 на протяжении 10 лет регулярно выполнял различные вмешательства из лапаро скопического доступа. При сравнительном анализе результатов операций очевидно, что предшествующий лапароскопический опыт не обеспечил никаких значимых преимуществ в освоении роботассистированных технологий.
В индивидуальную кривую обучения мы предлагаем ввести в качестве дополнительного фактора то количество операций, которое хирург просмотрел в режиме life-surgery и/или участвовал в качестве ассистента до момента начала собственной хирургической активности. Иллюстрацией этому утверждению может быть тот факт, что в нашем исследовании операции, выполненные хирургом № 3, характеризовались меньшим количеством «технических дефектов», объемом кровопотери и продолжительностью, нежели у хирурга № 2, поскольку до начала обучения он участвовал в качестве ассистента более чем в 200 РАРП. Хирург № 2 присутствовал в операционной лишь как наблюдатель и к ассистенции в операциях не привлекался. Нам кажется оправданным трактовать опыт привлечения обучающегося к ассистенции в РАРП как положительный фактор прогноза быстрого и качественного освоения данной методики.
При сравнении продолжительности операции, объемов кровопотери, частоты гемотрансфузии, ча- стоты осложнений отмечено статистически значимое улучшение этих показателей в каждой серии с увеличением количества выполненных операций, а также каждой последующей серии при сравнении с предыдущей.
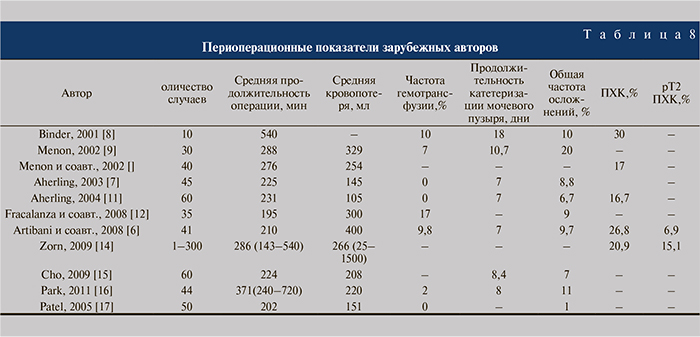
По данным зарубежной литературы (табл. 8), продолжительность роботассистированной простатэктомии не более 4 ч определяет достаточный технический уровень освоения метода. W. Artibani и соавт. [6] сообщают о сокращении времени операции до 4 ч после выполнения 16 РАРП; T. Ahlering и соавт. [7] – 12. В нашем исследовании продолжительность РАРП у хирургов № 1 и № 2 снизилась к 3-му десятку; у хирурга № 3 – ко 2-му.
K. Zorn и соавт. при сравнении трех последовательно проведенных серий РАРП пришли к выводу, что большинство случаев конверсии на открытый доступ имели место в числе первых 25 наблюдений. В нашей клинике ни у одного хирурга не было вынужденной конверсии [14].
Кровопотеря – один из важных показателей оценки кривой обучения. В нашем исследовании величина кровопотери сокращалась с каждым последующим десятком выполненных операций во всех трех сериях (см. табл. 2). Меnоn и соавт. в 2002 г. опубликовали результаты первых 30 последовательных РАРП, средняя кровопотеря составила 329 мл, гемотрансфузия потребовалась в 7% случаев (см. табл. 8). В нашем исследовании частота варьировалась от 37,5 (хирург № 1) до 0% (хирург № 2).
Продолжительность дренирования мочевого пузыря в серии РАРП у хирурга № 1 колебалась от 11,1±2,6 до 16,3±7,3 сут, у хирургов № 2 и № 3 не превышала 10 сут, снизившись к 4-му десятку в среднем до 7 сут. Среди европейских работ можно отметить исследование J. Binder и соавт., в котором средняя продолжительность катетеризации мочевого пузыря после 10 первых РАРП составила 18 сут. Причина подобного укорочения времени дренирования мочевого пузыря в серии 2-го и 3-го хирурга кроется в приобретении опыта, основанного на данных цистографического исследования, рутинно выполняющегося в настоящее время на 6–7-е сутки после операции. В большинстве случаев на ретроградных цистограммах фиксируется герметичность анастомоза, что позволяет удалять катетер в день выполнения исследования. На этапе обучения первого хирурга такой практики не было, а продолжительность дренирования объяснялась принятыми в клинике стандартами дренирования мочевого пузыря после позадилонной радикальной простатэктомии – около 10–13 сут.
Несмотря на то что на этапе освоения методики врач стремится проводить тщательный отбор пациентов, последующий за ним придерживается менее жестких критериев включения (на примере нашего исследования очевидно). Количество осложнений у каждого отдельного хирурга следует рассматривать с учетом совокупности клинических характеристик оперированных им пациентов. Очевидно, что на втором, третьем десятках операций в список пациентов включаются больные не только со второй, но и с третьей клинической стадиями заболевания. Таким образом, имеющая место некоторая «стагнация» по количеству осложнений не отражает истинного состояния вопроса, но является результатом прогрессивного усложнения операций.
Многие авторы связывают кривую обучения с частотой положительного хирургического края. В нашем исследовании данный показатель составил 15; 32,5 и 15%; при стадии заболевания pT2 – 2,5; 12,5 и 5,0 % в 1-й, 2-й и 3-й сериях соответственно. Artibani и соавт. опубликовали данные первых 41 РАРП, ПХК выявлен в 26,8%, а ПХК при pT2 – 6,9% (см. табл. 8).
В дополнение к термину «индивидуальная кривая обучения» мы предлагаем в рамках роботической хирургии ввести термины «индивидуальный этап обучения хирурга» и «кривая обучения клиники». Опыт нашей клиники наглядно демонстрирует, что первый хирург сталкивается с наибольшим количе- ством осложнений и трудностей, и каждый последующий обучающийся в своем индивидуальном опыте стартует с позиции, существенно более продвинутой, чем его предшественник. Это обеспечивается общим уровнем понимания проблемы и приобретенным навыком коллектива, позволяющими на любом этапе операции привлечь более опытных коллег в качестве консультанта, а иногда и сооператора. Таким образом, логично выделить три этапа в индивидуальном обучении: первого хирурга, второго хирурга, этап клиники.
В качестве критериев оценки кривой обучения клиники мы рекомендовали бы учитывать число консольных хирургов, выполнивших более 40 РАРП, общее число выполненных РАРП и осложнений.
В настоящее время в клинике урологии МГМСУ на этапе обучения находится следующее поколение роботических хирургов, у которых опыт выполнения открытых вмешательств минимален или отсутствует. Сравнение скорости и эффективности освоения ими методики – предмет нашего дальнейшего изучения, результат которого мы планируем привести в последующих публикациях.
Выводы
- Наличие обширного опыта открытых хирургических операций, хорошее знание анатомии и архитектоники малого таза позволяют начинающему роботическому хирургу избежать многих тяжелых осложнений, таких как перфорация прямой кишки, ранение магистральных сосудов и конверсия операции в открытую; которые могли бы быть стратифицированы по системе Клавьена как осложнения IIIb–IV степеней. В нашем исследовании такие осложнения отсутствовали.
- Для формирования у хирургов представления о масштабе интраоперационной травмы в процессе роботассистированной операции и высокой прецизионности данного вмешательства целесообразно при первых операциях выполнять запланированные конверсии.
- Предшествующий лапароскопический опыт не обеспечивает хирургам никаких значимых преимуществ в освоении роботассистированных технологий.
- С увеличением количества выполненных операций, а также у каждого последующего хирурга по сравнению с предыдущим отмечается статистически значимое улучшение интра- и послеоперационных показателей в каждой серии.
- Мы предлагаем в индивидуальную кривую обучения ввести два показателя: количество операций, которое хирург просмотрел в режиме life surgery и/или в которых участвовал в качестве ассистента до момента начала собственной хирургической активности; «технический дефект», значение которого мы уже разбирали выше.
- В дополнение к термину «индивидуальная кривая обучения» целесообразно в рамках роботической хирургии ввести термины «индивидуальный этап обучения хирурга» и «кривая обучения клиники».
- Результаты первых РАРП клиники урологии МГМСУ сопоставимы с таковыми первых РАРП ведущих зарубежных клиник.
Статья публикуется при поддержке РФФИ по проекту НК 13-04-12045/14



