Эректильная дисфункция (ЭД) – продолжающаяся более 6 мес неспособность достигать эрекции, достаточной для проведения полноценного полового акта, и/или поддерживать ее [23].
Эрекция – нейро-васкуло-тканевой феномен, связанный с гормональным контролем. Он включает расширение кавернозных артерий, расслабление гладкой мускулатуры трабекул и активацию вено-окклюзионного механизма кавернозных тел [1, 2] (УД: 2b) [29].
ЭД определяется как постоянная неспособность достигать и поддерживать эрекцию, достаточную для успешного полового акта. Несмотря на то что ЭД – это доброкачественное расстройство, оно может негативно влиять на физическое и психосоциальное здоровье, а также может оказывать значительное влияние на качество жизни пациентов и их партнерш [3]. Появляется все больше доказательств того, что ЭД может быть ранним проявлением ишемической болезни сердца и других системных сосудистых заболеваний; таким образом, ЭД не следует рассматривать только с точки зрения качества жизни, но и считать возможным предупредительным сигналом о наличии сердечно-сосудистого заболевания [4–8] (УД: 2b) [29].
МКБ-10
- F52 Сексуальная дисфункция, не обусловленная органическими нарушениями или болезнями
- N48.4 Импотенция органического происхождения.
ЭПИДЕМИОЛОГИЯ (CР:С)
Эректильная дисфункция встречается у 52% мужчин в возрасте 40–70 лет: 17% из них страдают ЭД легкой степени, 25% – средней, 10% – тяжелой степени B [11]. При исследовании мужчин от 30 до 80 лет частота ЭД была 19,2. Частота новых случаев ЭД на 1000 мужчин составила 65,6 в Бразилии, 19,2 в Дании и 26,0 в MMAS. Частота этого расстройства увеличивается с возрастом: в 40–50 лет его выявляют у 40% мужчин, в 50–60 – практически у половины обследованных (48–57%), а в старшей возрастной группе этим расстрой-
ством страдают более 70% мужчин [11]. Среди курильщиков ЭД встречается на 15–20% чаще, чем среди некурящих мужчин [7].
ФАКТОРЫ РИСКА
К факторам риска ЭД (СР: D) относят:
- возраст,
- депрессию,
- гиподинамию,
- ожирение,
- табакокурение,
- употребление наркотических средств,
- алкоголизм,
- авитаминоз,
- гиперлипидемию и метаболический синдром,
- неблагоприятные внешние факторы – радиацию, электромагнитное излучение.
Устранение неблагоприятных воздействий, связанных с особенностями образа жизни, приводит к уменьшению риска возникновения ЭД. В частности, увеличение физической активности снижает ее вероятность у мужчин среднего возраста на 70% в течение 8 лет регулярных тренировок (CH:D) [8, 26]. При исследовании 2 групп в течение 2 лет польза физических упражнений была подтверждена.
ПРИЧИННЫЕ ФАКТОРЫ
Психогенные:
- cитуационные (особенности партнера, чувство вины, тревога и т.д.);
- неврозы (тревожные, фобические);
- зависимость от психоактивных веществ.
В ЭД выделяют:
- генерализованный тип (недостаток возбудимости и сексуальной интимности);
- ситуационный.
Органические факторы
Васкулогенные:
- сердечно-сосудистые заболевания;
- артериальная гипертензия;
- атеросклероз;
- сахарный диабет;
- гиперлипидемия;
- табакокурение (пенильный ангиоспазм);
- синдром Лериша;
- веноокклюзивные нарушения;
- оперативные вмешательства или лучевое воздействие в области таза и забрюшинного пространства (УД: 2b).
Нейрогенные:
- заболевания головного и спинного мозга:
- болезнь Паркинсона;
- инсульт;
- новообразования;
- рассеянный склероз;
- травма;
- поражения межпозвонковых дисков;
- периферические нейропатии вследствие:
- сахарного диабета;
- алкоголизма;
- ХПН;
- полинейропатии;
- оперативных вмешательств в области таза и забрюшинного пространства.
Гормональные:
- гипогонадизм (врожденный, приобретенный, возрастной);
- гиперпролактинемия;
- гипертиреоз, гипотиреоз;
- болезнь Иценко–Кушинга.
Структурные факторы (болезни полового члена):
- болезнь Пейрони;
- травма;
- врожденное искривление;
- склеротические изменения вследствие кавернита или приапизма;
- малый половой член;
- гипоспадия, эписпадия.
Лекарственно-индуцированные факторы
- Гипотензивные препараты (особенно диуретики и β-адреноблокаторы).
- Антидепрессанты.
- Антиандрогены.
- Психотропные и наркотические средства.
- Прочие.
ПРОФИЛАКТИКА
Меры профилактики ЭД (СР: D) – нормализация образа жизни, достаточная физическая активность, исключение табакокурения, ограничение потребления алкоголя, контроль и коррекция массы тела, содержания глюкозы и липидов в крови [12], а также регулярные половые сношения.
СКРИНИНГ
Скрининг не проводят. Следует информировать всех пациентов с факторами риска ЭД о возможности ее развития и убедить их изменить образ жизни.
КЛАССИФИКАЦИЯ
Эректильную дисфункцию классифицируют:
- по степени выраженности:
- легкая,
- средняя,
- умеренная,
- тяжелая;
- по причинам ее возникновения:
- психогенная – около 40% случае;
- органическая – 29%;
- смешанная (сочетание психических и органических факторов) – 25%;
- неясного генеза – 6% (СР: В) [2].
ДИАГНОСТИКА
Жалобы и анамнез
Диагностические мероприятия у пациентов, предъявляющих жалобы на ЭД, преследуют несколько целей:
- Подтвердить наличие ЭД.
- Определить степень ее выраженности.
- Выяснить причину этого расстройства, т.е. установить заболевание, вызвавшее его развитие.
- Определить, страдает ли больной только ЭД, или она сочетается с другими видами сексуальных расстройств (снижение полового влечения, нарушения эякуляции и оргазма).
Диагностический процесс начинается с подробного сбора жалоб и анамнеза, сведений о состоянии здоровья пациента в целом и его психическом статусе. Анализируют данные общего и сексологического анамнеза, а также состояние копулятивной функции в прошлом и в настоящее время. Необходимо получить информацию о характере взаимоотношений с половым партнером, предшествующих консультациях, о лечебных мероприятиях и их эффективности.
Уточняют характер нарушения, его давность, стабильность проявления, влияние отдельных факторов и обстоятельств. Важно детально обсудить с пациентом качество адекватных и спонтанных эрекций, охарактеризовать половое влечение, продолжительность фрикционной стадии копулятивного цикла и оргазм.
Беседа с половым партнером пациента весьма желательна и важна как для уточнения характера и степени выраженности нарушения, так и для успеха планируемой терапии.
С целью объективизации жалоб больного, количественной характеристики копулятивных нарушений, включая ЭД, а также экономии времени врача рекомендуют использовать одну из предложенных анкетных систем, например наиболее распространенный опросник – Международный индекс эректильной функции (УД: 3; СР: В) [26, 27].
Анализ полученных данных позволяет с достаточной степенью достоверности судить о природе ЭД (табл. 1). Ситуационный, избирательный и преходящий характер расстройства, а также наличие спонтанных эрекций свидетельствуют о психогенном генезе нарушения. По результатам заполненного пациентом опросника можно сделать количественное заключение о степени выраженности ЭД.

Необходимо выяснить, страдает ли больной сахарным диабетом, артериальной гипертензией, атеросклерозом, гипогонадизмом, почечной недостаточностью, неврологическими и психическими нарушениями, собрать сведения о перенесенных оперативных вмешательствах на органах мочевой и половой систем, прямой кишке, о длительном приеме лекарственных средств и злоупотреблении алкоголем [5, 9]. В недавних исследованиях была выявлена связь между кардиоваскулярными факторами риска, метаболическими факторами и сексуальной дисфункцией обоих полов.
Физическое обследование
Физическое обследование предполагает оценку состояния сердечно-сосудистой, нервной, эндокринной и половой систем (УД: 4; СР: В).
В оценку состояния сердечно-сосудистой системы обязательно входят измерение артериального давления и характеристика пульса. Учитывая высокую распространенность заболеваний сердечно-сосудистой системы и метаболического синдрома (возрастной гипогонадизм), объем обследования должен быть достаточным для заключения о допустимости сексуальной активности и отсутствии противопоказаний к терапии ЭД.
Для стандартизации врачебных рекомендаций по сексуальной активности в случаях сердечного риска на международной конференции (Принстон, 1999) разработали рекомендации по лечению сексуальной дисфункции у больных сердечно-сосудистыми заболеваниями (СР: А) [10]. Согласно Принстонскому консенсусу, больных разделяют на группы низкого, среднего и высокого риска (табл. 2).
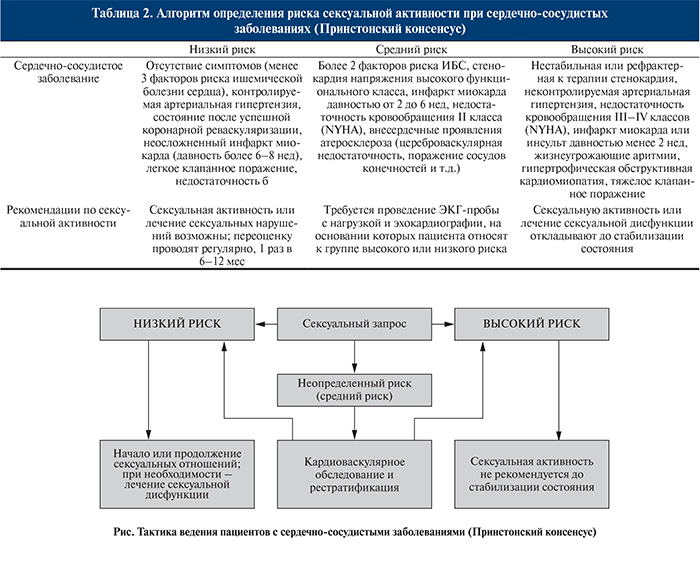
При низкой степени риска сексуальную активность или лечение ЭД считают безопасным, при средней степени перед возобновлением сексуальной активности необходимо дополнительное обследование, при высокой – коррекция сердечно-сосудистого заболевания (см. рисунок).
Исследование вторичных половых признаков позволяет косвенно судить об инкреторной функции яичек, т.е. андрогенной насыщенности организма и своевременности наступающего полового созревания.
Анализу подвергают:
- массу тела, рост;
- строение скелета (соотношение длины верхних и нижних конечностей и роста);
- характер и темп оволосения на лице, туловище и лобке;
- состояние мышечной системы, развитие и характер отложения жировой клетчатки, объем талии;
- тембр голоса;
- наличие гинекомастии.
Объективное обследование завершают изучением половых органов. Оно включает обнаружение и определение локализации яичек, их размеров и консистенции, пальпацию придатков яичек и предстательной железы, а также осмотр, измерение и пальпацию полового члена.
Лабораторные и инструментальные исследования
Характер и объем лабораторных исследований определяют индивидуально с учетом жалоб, данных анамнеза и физикального обследования в зависимости от объективной необходимости и желаний пациента.
Обязательно определение натощак:
- уровень глюкозы в крови;
- липидный профиль;
- общий тестостерон в утренней порции крови.
Для полной оценки андрогенного статуса более информативно определение биодоступного и свободного тестостерона (СР:А) (расчет свободного тестостерона проводят после определения общего связанного с глобулином тестостерона). При сниженном уровне тестостерона показано определение ЛГ- и ФСГ-гормонов, а также пролактина.
Мониторинг ночных пенильных тумесценций или спонтанных эрекций используют для дифференциальной диагностики органических и психогенных форм ЭДС (СР:С). Исследование проводят в течение как минимум двух ночей с помощью прибора Rigiscan, а в его отсутствие – специальными кольцами с тремя контрольными полосами разрывов. У здоровых мужчин в течение ночи в фазе быстрого сна отмечают 4–6 эпизодов эрекций продолжительностью от 5 до 15 мин. Зарегистрированный эпизод эрекции с 60%-ной ригидностью вблизи головки полового члена и продолжительностью не менее 10 мин свидетельствует о сохранности механизма эрекций [14, 19]. У мужчин с ЭД выявляется снижение качества и количества ночных пенильных тумесценций во время ночного сна (СР:В).
Тест с интракавернозным введением вазоактивных препаратов (обычно аналога простагландина Е1 – алпростадила в средней дозе 10 мкг) позволяет выявлять васкулогенную ЭД. При нормальных гемодинамических показателях примерно через 10 мин после инъекции возникает выраженная эрекция, сохраняющаяся в течение 30 мин и более (СР:С) [3, 19]. Данный тест подтверждает функциональную, но не нормальную эрекцию, так как данная эрекция может сосуществовать с артериальной недостаточностью и веноокклюзивной дисфункцией.
Ультразвуковую допплерографию артерий полового члена широко применяют для диагностики ЭД, хотя результаты исследования во многом зависят от технического совершенства аппаратуры. Этот метод более информативен, если исследование выполняют в состоянии покоя полового члена и индуцированной фармакологическими препаратами эрекции с последующим сравнением результатов. Основные количественные показатели при ультразвуковой допплерографии – максимальная (пиковая) систолическая скорость и конечная диастолическая скорость. На основе абсолютных показателей по стандартным формулам рассчитывают индекс резистентности. В норме пиковая систолическая скорость составляет более 30 см/с2 и индекс резистентности – более 0,8 (СР:A) [19].
При соответствующих показаниях для оценки состояния автономной иннервации полового члена и выявления ее нарушений выполняют исследование бульбокавернозного и кремастерного рефлексов, вызванных потенциалов, электромиографию полового члена, позволяющее в подавляющем большинстве случаев определить причину ЭД и приступить к лечению.
Инвазивные методы диагностики: ангиографию, кавернозометрию, кавернозографию (метод рентгенодиагностики кавернозной веноокклюзивной дисфункции и кавернозного фиброза) выполняют в тех случаях, когда больной – потенциальный претендент на реконструктивные оперативные вмешательства по поводу ЭД.
Клинические рекомендации по диагностике ЭД

Показания к консультации других специалистов
Патогенетическая терапия сопутствующих заболеваний должна проводиться совместно со специалистами смежных дисциплин на основе общепринятых современных стратегий. Пациентов следует направлять на консультацию/лечение к следующим специалистам.
- К эндокринологу – при выявлении избыточной массы тела (окружность талии более 94 см), гипогонадизма, сахарного диабета (всех типов), гликемии натощак, полинейропатии, любых патологических отклонений гормонов крови.
- К кардиологу – при выявлении дислипидемии, артериальной гипертензии, нарушении сердечного ритма, ишемической болезни сердца, клинических проявлений атеросклероза, острого нарушения мозгового кровообращения в анамнезе.
- К неврологу – при выявлении заболеваний центральной и/или периферической нервсной системы, полинейропатии, острого нарушения мозгового кровообращения в анамнезе.
- К психотерапевту/сексологу – при выявлении тревожного и/или депрессивного синдрома, невроза, стойких травмирующих переживаний, акцентуации личности.
ЛЕЧЕНИЕ
Цели лечения
Цель лечения – восстановление эрекции, достаточной для проведения полноценного полового акта.
Пациента нужно полностью информировать о возможных методах его лечения, их эффективности и возможных осложнениях.
Больного целесообразно ознакомить с анатомией и физиологией половой системы, объяснить причины и патогенез возникшей у него ЭД. Активное вовлечение пациента в разработку стратегии лечения повышает его эффективность.
ЭД не относится к тяжелым нарушениям, однако она может отрицательно влиять на психический статус мужчины, ухудшать качество его жизни, нарушать партнерские отношения и прочность семьи, поэтому независимо от генеза расстройства психотерапия– обязательный компонент лечения. Во всех случаях врач должен использовать свое влияние для нормализации или улучшения межличностных отношений половых партеров. Важно, чтобы сексуальная партнерша была вовлечена в терапевтический процесс.
Терапия ЭД должна быть максимально этиотропной и патогенетической. В первую очередь это касается сахарного диабета, артериальной гипертензии, метаболического синдрома. На полное излечение от ЭД можно рассчитывать в случаях психогенной ЭД (рациональная психотерапия), посттравматической артериогенной ЭД у молодых мужчин (оперативная реваскуляризация кавернозных тел), при гормональных нарушениях (гипогонадизм, гиперпролактинемия) (СР:А).
В случаях когда комплексное обследование не выявило причины ЭД, терапия может носить симптоматический характер.
Перед началом лечения больному указывают на необходимость максимального исключения факторов риска, нормализацию образа жизни и режима сексуальной активности. Следует решить вопрос о возможности отмены или замены получаемых пациентом лекарственных препаратов, способных отрицательно влиять на эрекцию.
Показания к госпитализации
Госпитализация показана только для выполнения сложных инвазивных исследований и/или оперативных вмешательств.
Медикаментозное и немедикаментозное лечение
Следует применять поэтапное лечение.
- На первом этапе при наличии соответствующих показаний используют препараты, повышающие концентрацию тестостерона, пероральные эректогенные препараты, вакуумные устройства и психосексотерапию.
- Второй этап лечения подразумевает внутриуретральное и/или внутрикавернозное введение вазоактивных средств. В дальнейшем при необходимости применяют хирургическое лечение.
Необходимо помнить, что при наличии андрогендефицитного состояния применение других ЛС, направленных на устранение васкулогенной и нейрогенной причин ЭД, будет малоэффективным.
При наличии у мужчины с ЭД низкой концентрации тестостерона при нормальной концентрации других гормонов, нормальных размерах предстательной железы, нормальной концентрации ПСА, отсутствии других противопоказаний для терапии тестостероном (карциномагрудная железа, тяжелая полицитемия, наличие симптомов обструкции нижних мочевыводящих путей) и отсутствии дислипидемии назначают препараты тестостерона. Лекарственное средство, дозу, режим введения и продолжительность курса подбирают индивидуально.
Для андрогензаместительной терапии – лекарственные инъекционные и трансдермальные формы тестостерона. Тестостерона ундеканоат вводится внутримышечно в дозе 1000 мг. Он поддерживает уровень тетостерона в физиологических пределах в течение 12 нед и не вызывает пиковых концентраций.
Накожно применяют тестостероновый гель, который отличается удобными фармакокинетическими свойствами. Через 1–2 ч после аппликации уровень тестостерона в сыворотке крови достигает физиологических значений и сохраняется в течение суток. Важное обстоятельство – сохранение циркадного суточного ритма концентрации гормона.
Основное противопоказание к назначению препаратов тестостерона – РПЖ или подозрение на него, поэтому перед назначением препаратов тестостерона ПРИ предстательной железы и определение ПСА в сыворотке крови обязательны (СР:А) [22]. Результат андрогензаместительной терапии обязательно оценивают через 2–3 мес, после чего решают вопрос о целесообразности ее продолжения. Гормональная терапия не всегда эффективна в лечении ЭД на фоне гипогонадизма. При хирургической реваскуляризации пациентов с тазовой или перениальной травмой в долгосрочном периоде успех наблюдается в 60–70% случаев. Кавернозная веноокклюзивная дисфункция является противопоказанием к реваскуляризации и должна быть исключена динамической кавернозографией или кавернозометрией. Васкулярная хирургия при веноокклюзивной дисфункции не рекомендована из-за плохих отдаленных результатов.
При лечении ЭД руководствуются принципом поэтапного проведения лечебных мероприятий.
Терапия первой линии
Ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5)
В настоящее время в России доступны четыре препарата этой группы:
Их отличительная особенность – эффективность при всех формах ЭД и хорошая переносимость (СР:B) [13, 24, 25]. Ингибиторы ФДЭ-5 используются эпизодически (по требованию) за определенное время перед половым актом, причем для наступления эффекта от препарата необходима сексуальная стимуляция. Дозы подбирают индивидуально. Ингибирование ФДЭ-5 увеличивает кровоток, что приводит к релаксации гладких мышц, вазодилатации и эрекции. Профиль побочных эффектов варденафила, силденафила и тадалафила схож с плацебо.
Эффект силденафила может наблюдаться в течение 12 ч. Воздействие побочных эффектов варденафила, силденафила и тадалафила схож с плацебо. После 24 нед применения силденафила улучшения наблюдались у 56, 77 и 84% мужчин, принимавших 25, 50 и 100 мг силденафила соответственно, по сравнению с 25%-ным улучшением у пациентов, принимавших плацебо. При диабете при использовании силденафила отмечалось 66,6% улучшения эрекции и 63% успешных соитий по сравнению с 28,6 и 33% у мужчин, принимавших плацебо, соответственно. Варденафил помимо обычных таблетированных форм дозировкой 5, 10 и 20 мг выпускается также в варианте орально диспергированной таблетки, которая растворяется в ротовой полости без воды. Принципиальное отличие тадалафила – его длительное действие – 36 ч. В премаркетинговых исследованиях после 12 нед применения тадалафила улучшение эрекции наблюдалось у 67 и 81% мужчин, принимавших 10 и 20 мг соответственно, пю сравнении с 35% мужчин, принимавших плацебо.
В исследованиях in vitro варденафил демонстрирует в 10 раз более мощный результат, чем силденафил, что не обязательно ведет к более мощному клиническому ответу. После 12 нед применения варденафила улучшение эрекций отметили в 66, 76 и 80% случаев при применении 5, 10 и 20 мг соответственно против 31% мужчин, принимавших плацебо. При приеме варденафила в сочетании с диабетом 78% пациентов подтвердили положтельное изменение эректильной функции против 13% пациентов, получавших плацебо.
Исследования показали, что ежедневное применение тадалафила приводит к большему улучшению сексуальной функции, чем прием данного препарата по необходимости. В связи с этим данный препарат стали также выпускать в таблетированной форме с дозировкой 5 мг, предназначенной для ежедневного применения.
Было выявлено, что длительное применение тадалафила улучшает эндотелиальные функции, данный эффект сохраняется после прекращения применения препарата.
Ни один из ингибиторов ФДЭ-5 не сказывается отрицательно на продолжительности нагрузки или времени до наступления ишемии при тестировании пациентов со стабильной стенокардией. Ингибиторы ФДЭ-5 могут даже улучшать результаты данных тестов.
При сочетании ингибиторов ФДЭ-5 с антигипертензивными средствами наблюдается незначительное усиление снижения давления.
Применение альфа1-адреноблокаторов в сочетании с ингибиторами ФДЭ-5 может приводить к ортостатической гипотензии. С целью профилактики значимого снижения артериального давления ингибиторы ФЭД-5 целесообразно назначать с тамсулозином.
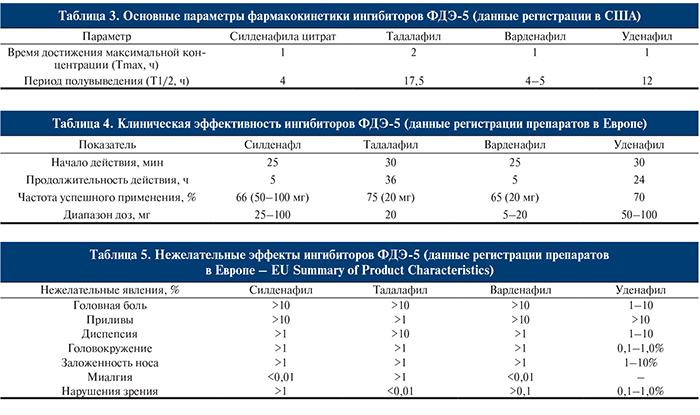
Ввиду отсутствия прямых сравнительных исследований трех препаратов анализ их характеристик целесообразно проводить на основании данных регистрации препаратов в Европе и США, которые формирую по единым стандартам (табл. 3–5).
Нормализация тестостерона в сыворотке крови может улучшать ответ на ФДЭ-5. По сравнению силденафила с тадалафилом 17% мужчин имеют лучший эффект от силденафила, а 13%– от тадалафила. Иногда некоторые мужчины, не имеющие эффекта от однократного применения ФДЭ-5, могут испытывать эффект от регулярного употребления препарата.
Ввиду отсутствия прямых сравнительных исследований трех препаратов анализ их характеристик целесообразно проводить на основании данных регистрации препаратов в Европе и США, которые формируют по единым стандартам (табл. 3–5).
Ингибиторы ФДЭ-5 нельзя принимать параллельно с органическими нитратами из-за потенцирования гипотензивного действия. Согласно рекомендациям Американской кардиологической ассоциации, органические нитраты можно использовать не ранее чем через 24 ч после приема короткодействующих ингибиторов ФДЭ-5 и не ранее чем через 48 ч после приема тадалафила. При использовании ингибиторов ФДЭ-5 следует учитывать потенциальный риск осложнений, связанных с сексуальной активностью, в течение 90 дней после перенесенного инфаркта миокарда; при нестабильной стенокардии или стенокардии, возникающей во время полового акта; при развившейся в течение последних 6 мес сердечной недостаточности II функционального класса и выше по NYHA, неконтролируемых нарушениях сердечного ритма, артериальной гипотензии (АД ниже 90/50 мм рт.ст.) или неконтролируемой артериальной гипертензии, а также в течение 6 мес после инсульта (СР:B) [10].
Сочетание ингибиторов ФДЭ-5 с другими лекарственными средствами возможно.
Врач должен донести до пациента достоверную и объективную информацию об особенностях каждого из препаратов группы ингибиторов ФДЭ-5 и предоставить ему самому возможность выбора.
Терапия локальным отрицательным давлением
К физическим средствам первой линии лечения ЭД относят терапию локальным отрицательным давлением. Сущность метода заключается в том, что половой член помещают в специальную колбу, где создают отрицательное давление с помощью вакуумного насоса. Это приводит к увеличению притока крови к пещеристым телам, что обусловливает эрекцию, для сохранения которой на основание полового члена накладывают специальное сжимающее кольцо, ограничивающее венозный отток. Достигаемая эрекция нефизиологична. Показания к применению вакуумных устройств – невозможность лекарственной терапии или ее неэффективность, а также предпочтение пациента. К данному виду терапии более склонны пожилые мужчины, которым свойственна низкая сексуальная активность. Эффективность метода и удовлетворенность им составляют от 27 до 94% (СР:B) [16]. Примерно 30% пациентов отказываются от применения вакуумных устройств в связи с возникновением боли, подкожных кровоизлияний, затрудненной эякуляцией и снижением чувствительности головки полового члена.
Терапия второй линии
В отсутствие эффекта от пероральных препаратов могут быть применены интракавернозные инъекции вазоактивных лекарственных средств. Результативность данной терапии составляет около 85% (СР:B) [28]. Для интракавернозного введения используют несколько препаратов в качестве монотерапии или в комбинации (простагландин Е1, фентоламин, папаверин). Первоначальная (тестирующая) доза для простагландина Е1 составляет 10 мкг (вводится в одно из кавернозных тел после растворения в 1 мл физиологического раствора). При необходимости доза может быть увеличена до 20 мкг. Эрекция наступает через 5–15 мин после введения препарата, ее продолжительность зависит от дозы, составляя в среднем около 90 мин. После подбора необходимого количества препарата и соответствующего обучения пациента переводят на выполнение аутоинъекций, частота не более 3 раз в неделю [3]. В генеральной группе пациентов с ЭД эффективность простагландина – 70%, в субгруппах – до 94%. Осложнения: боль в половом члене у 50% пациентов после 11% инъекций, сверхпролонгированная эрекция – 5%, приапизм – 1% и фиброз – 2%. Боль облегчается при использовании раствора бикарбоната и анестезии.
Данная терапия противопоказана лицам:
- при повышенной чувствительности к используемому препарату;
- с риском развития приапизма;
- с грубыми анатомическими дефектами полового члена.
К побочным эффектам относят:
- пролонгированную эрекцию;
- приапизм;
- боль в половом члене;
- развитие фиброза кавернозной ткани.
Пациента нужно предупредить, что в случае сохранения эрекции более 4 ч ему необходимо обратиться к врачу. Эрекцию необходимо купировать путем пункции кавернозных тел и аспирации крови, а при необходимости – введением минимальных доз адреномиметических препаратов.
Большинство пациентов, применяющих внутрикавернозные инъекции, могут переключиться на ингибиторы ФДЭ-5 во избежание патологических изменений в белочной оболочке полового члена, но, как правило, не делают этого.
Альтернатива интракавернозным инъекциям – внутриуретральное введение алпростадила. Однако данный метод не нашел широкого клинического применения.
Возможно различное сочетание препаратов.
Терапия третьей линии (хирургическое лечение)
Оперативные вмешательства на сосудах могут быть показаны больным с окклюзивными поражениями артерий, снабжающих кровью тазовые органы. При этом наилучших результатов можно ожидать от молодых мужчин с изолированными артериальными дефектами вследствие перенесенной травмы, тогда как у мужчин с генерализованным атеросклерозом эффект после этих операций непродолжителен. Хирургические пособия на венах при повышенном оттоке венозной крови от кавернозных тел заключаются в их перевязке и иногда используются молодыми пациентами. Однако эффективность этих операций невысокая и сведения о них противоречивы (СР:D) [2].
Как крайнюю меру (при безуспешности всех остальных методов лечения ЭД), если пациент настаивает на кардинальном решении своей проблемы, применяют фаллоэндопротезирование полужесткими протезами или протезами, при необходимости имитирующими эрекцию (СР:C), основной недостаток которых – их высокая стоимость [1, 4]. Уровень удовлетворенности среди пациентов, подвергшихся фаллопротезированию, составляет 70–87%.
Таким образом, индивидуальный подбор и поэтапное применение современных методов терапии ЭД позволяют в подавляющем большинстве случаев добиваться сексуальной реабилитации больных (табл. 6).

КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ЭРЕКТИЛЬНОЙ ДИСФУНКЦИИ

ПРОГНОЗ
За последние десятилетия прогноз при ЭД у подавляющего большинства больных существенно улучшился. Это связано с внедрением в клиническую практику лекарственных средств с этиопатогенетическим механизмом действия (ингибиторы ФДЭ-5) и препаратов тестостерона последнего поколения. В тяжелых случаях ЭД, не поддающейся консервативной терапии, восстановление функции возможно сосудистыми микрохирургическими операциями или фаллоэндопротезированием с применением высокоэффективных современных имплантантов.



