Введение. Рак почки не занимает лидирующих позиций в онкологическом реестре, но как в России, так и в странах Западной и Восточной Европы, а также Северной Америки за последние два десятилетия отмечена неуклонная тенденция к росту частоты этого заболевания [1]. Повсеместное широкое использование современных методов визуализации привело к повышению выявляемости опухолей почки небольших размеров [2]. Многоцентровые исследования не только доказали целесообразность органосохраняющего хирургического подхода, но и показали преимущества перед радикальной нефрэктомией на ранних стадиях почечно-клеточного рака (ПКР) [3, 4]. В ряде работ представлены данные, оправдывающие нефронсберегающий подход при опухолях большего размера [5, 6].
С другой стороны, не снижается частота выявления билатерального ПКР и поражения анатомически или функционально единственной почки [5, 7]. Необходимость сохранения почечной функции связана с большей частотой прогрессирования ПКР в ренопривном состоянии у пациентов в связи с субуремической иммуносупрессией на диализе или фармакологической — после аллотрансплантации почки, т.е. максимальное сохранение функциональности является приоритетным направлением развития хирургии ПКР в настоящее время.
Нефронсберегающие операции на почке все шире используются как в обще-, так и в онкоурологической практике. Целесообразность нефронсберегающего подхода уже не оспаривается в урологическом сообществе. Успех хирургического лечения определяется временем и качеством наложения шва на почечную рану. Именно с качеством шва сопряжено развитие таких осложнений, как кровотечение, мочевые свищи, а также длительность ишемии и выбор способов нефропротективной защиты, что в конце концов обеспечивает остаточную почечную функцию. На неразрешенность этих вопросов указывает изобилие различных хирургических приемов ушивания раны почки, выключения ее из кровотока, проведения нефропротективной защиты и т.д. Развиваются и так называемые малоинвазивные, или аблативные, методики (радиочастотная аблация, криодеструкция, HIFU-терапия, высокодозная рентгенхирургия). Снижая инвазивность, данные подходы порождают другие проблемы; кроме того, пока отсутствуют крупномасштабные исследования по оценке их эффективности [8, 9].
Целью настоящей работы было осветить возможность выполнения и определить место экстракорпоральной резекции почки в хирургии ПКР.
Материалы и методы. За 2005–2015 гг. нами выполнено 47 интра- и 5 экстракорпоральных резекций почки (РП) по поводу опухолей и 65 радикальных нефрэктомий (РНЭ). В группе интракорпоральной РП средний возраст пациентов составил 54,3±11,5 лет; соотношение мужчины/женщины – 53,2/46,8%; правосторонняя/левосторонняя локализация опухоли имела место в 44,7/55,3% наблюдений. В группе РНЭ эти показатели составили соответственно 56,15±8,01 года, 53,8/46,2 и 43,1/56,9%. Группа эстракорпоральной РП была сопоставимой по возрасту (65,3±4,1 года) и локализации опухоли (справа процесс локализовался у 2 (40%), слева – у 3 [60%]). Экстракорпоральная РП в 4 (80%) случаях выполнена женщинам.
В группе экстракорпоральной РП производили РНЭ по классической методике из поперечного лапаратомного доступа с сохранением максимальной длины почечных сосудов. Лимфоаденэктомию выполняли вокруг прилежащего сосуда, по переднебоковым поверхностям противолежащего и в аортокавальном промежутке от верхней брыжеечной артерии до бифуркации аорты. Консервацию осуществляли 1000 мл кустадиола с 5000 ЕД гепарина. Резекцию почки производили в условиях холодовой ишемии, отступя от опухоли 0,5–1,0 см в пределах визуально неизмененной почечной паренхимы. Также визуально оценивали хирургический край удаленной опухоли и ширину отступа. Срочного морфологического исследования не выполняли. Рану почки ушивали П-образными швами полисорб-0, дополнительно укрепив линию шва лоскутом из сосудистого протеза. Операцию завершали гетеротопической контралатеральной аутотрансплантацией на наружные подвздошные сосуды. Экстравезикальный уретероцистоанастомоз дренировали внутренним стентом в течение 1 мес.
Интракорпоральную РП 46 (97,9%) пациентам выполняли без полного выключения почки из кровотока, а именно с компрессией сегментарного или абберантного сосуда. Техника резекции и закрытия почечной раны не отличались от описанных выше.
Для статистического анализа полученных данных был использован непараметрический критерий Вилкоксона. Различия считали достоверными при вероятности, большей 95%.
Результаты. Продолжительность операции в группе экстракорпоральной РП была выше по сравнению с интракорпоральной РП и РНЭ, составив 228,5±39,7, 135,4±25,9 и 143,1±35,2 мин соответственно (р<0,05). Отсутствовали различия в группах РНЭ и интракорпоральной РП по размерам опухолей Т2 и Т3а (р>0,05). При том что на этапе дооперационного стадирования в группе интракорпоральной РП не регистрировали сосудистой или капсулярной инвазии. Опухоли до 4 см (Т1а) преобладали в группе интракорпоральной РП – 35,6 против 21,5% в группе РНЭ (р<0,05). У пациентов, которым была выполнена экстракорпоральная РП, имели место инвазия почечного синуса или сегментарной вены по данным рентгенологических методов визуализации, а также центрально расположенные опухоли размером более 4 см и регионарная лимфоаденопатия. Внеполюсное расположение опухолевого узла в группе РНЭ отмечено примерно в половине (50,8%) случаев, что сопоставимо с группой интракорпоральной РП – 48,9% наблюдений (р>0,05). Объем кровопотери при РП был статистически незначимо выше, составив 258±93 против 137±88 мл при РНЭ (р>0,05). Длительность компрессии сегментарного или абберантного сосуда в группе интракорпоральной РП составила 8,2±4,7 мин. Первичная тепловая ишемия (время от прекращения кровотока до начала перфузии консервирующим раствором) при экстракорпоральной резекции почки не превысила 1 мин, вторичная достигла 24,8±8,5 мин. Средняя ширина хирургического отступа от края опухоли при интракорпоральной РП составила 0,88±0,3, при экстракорпоральной РП – 0,51±0,17 см.

Морфологическое исследование не выявило положительного хирургического края ни у одного больного. Нами не зарегистрировано фатальных исходов и таких серьезных послеоперационных осложнений, как кровотечение, образование мочевого свища и стриктур мочеточника. Достоверных различий в частоте послеоперационных осложнений в группах наблюдения не отмечено, последние составили 16,9, 10 и 15,9% в группах РНЭ, экстракорпоральной и интракопоральной РП соответственно (р>0,05). При этом в первых двух группах отмечали дисфункцию почки с ростом азотемии, а в последней осложнения были представлены ранением плеврального синуса, которые были диагностированы и устранены интраоперационно и не повлияли на течение послеоперационного периода. Лимфодиссекцию в группах РНЭ и экстракорпоральной РП выполняли рутинно, в группе интракорпоральной РП парциальную лимфодиссекцию производили при опухолях более 4 см или визуализируемых при спиральной компьютерной томографии (СКТ) лимфоузлах размером более 5 мм. В анализ не включены пациенты с лимфатической инвазией, которые подверглись РНЭ, в группах РП секундарных поражений лимфатических узлов не выявлено.

В группах интра- и экстракорпоральной РП на сроках наблюдения 44,7±19,5 и 46,5±22,3 мес соответственно не выявлено прогрессирования заболевания ни у одного пациента. В группе РНЭ у 2 (3,1%) пациентов со стадией рТ3bN0M0 на сроках наблюдения 59 и 68 мес выявлены легочные метастазы, на фоне проведения таргентной терапии один пациент умер через 6 мес от ее начала. Средний период наблюдения в группе РНЭ составил 64,5±23,1 мес, общая безрецидивная выживаемость – 51,3±18,9 мес.
Приводим два клинических наблюдения пациенток, которым была выполнена экстакорпоральная РП.
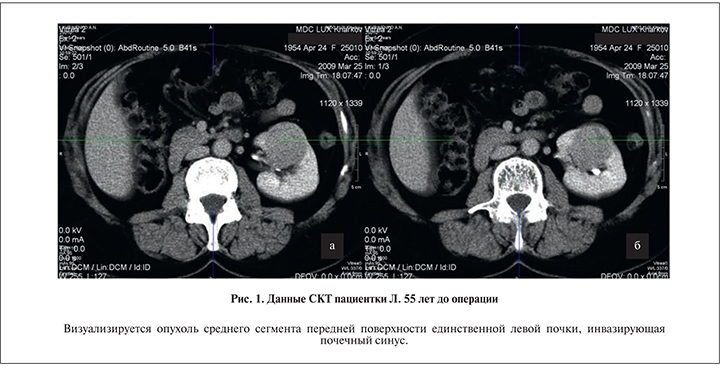
П а ц и е н т к а Л. 55 лет поступила в клинику с образованием единственной левой почки через год после нефрэктомии справа по поводу ПКР. Опухолевый узел размером 65 мм располагался по передней поверхности среднего сегмента, прилегая непосредственно к воротам почки (рис. 1). По данным обследования у пациентки отсутствовали признаки лимфатической инвазии и отдаленного метастазирования. Диагноз: метахронная гипернефрома справа T2N0M0 (нефрэктомия в 2004 г.).

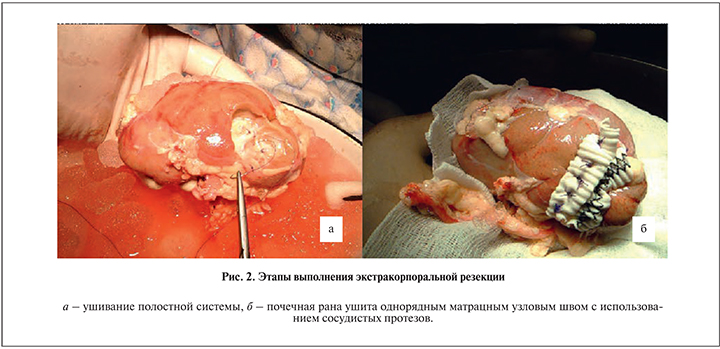
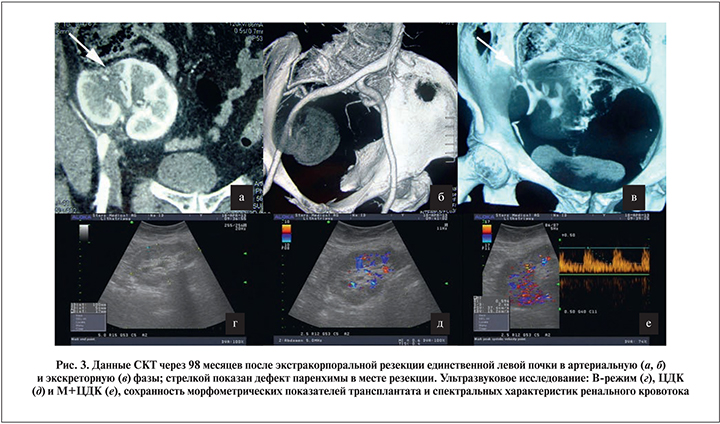
Опухоль среднего сегмента левой почки T1вN0M0, стадия 2, клиническая группа 2. Выполнена радикальная нефрэктомия с расширенной лимфодисcекцией, экстракорпоральная резекция (рис. 2) с гетеротопической аутотрансплантацией в правую подвздошную область. При сроке наблюдения 98 мес отсутствуют данные за ХПН (креатинин 123 мкмоль/л, мочевина 8,1 ммоль/л от 10.07.15) и прогрессирование опухоли (рис. 3).
П а ц и е н т к а Б. 62 лет. При обследовании выявлены гидронефроз слева, обусловленный конкрементом (2 см) лоханки, в проекции левого надпочечника опухолевидное образование размером до 4 см; солидное кровоснабжаемое образование задней поверхности среднего сегмента размером 78х60 мм с неровным контуром. Почечная вена проходима на всем протяжении. По ходу аорты и нижней полой вены определяются лимфатические узлы до 2 см (рис. 4). Диагноз: опухоль среднего сегмента правой почки Т2NхM1(mts в левый надпочечник), стадия 4, клиническая группа 2. Мочекаменная болезнь. Камень лоханки левой почки. Гидронефроз слева, 2-я стадия. Хронический калькулезный пиелонефрит, нестойкая ремиссия. ХПН0. Проведено этапное лечение. Первый этап: пиелолитотомия, адреналэктомия слева; через 1 мес второй этап: радикальная нефрэктомия справа с расширенной лимфодиссекцией (рис. 5, а, б), экстракорпоральная резекция с гетеротопической аутотрансплантацией в левую подвздошную область (рис. 5, в–е). Опухоль надпочечника представлена его аденомой, имела место инвазия в сегментарную вену, край резекции отрицательный (рис. 6). Таким образом, при послеоперационном стадировании мы увеличили градацию по категории «Т» со 2 до 3а и исключили метастатическое поражение надпочечника и лимфатических узлов. Заключительный диагноз: светлоклеточная гипернефрома среднего сегмента правой почки рТ3аN0M0, стадия 3, клиническая группа 3. Мочекаменная болезнь. Камень лоханки левой почки. Гидронефроз слева 2 стадия. Хронический калькулезный пиелонефрит, нестойкая ремиссия. ХПН0. Светлоклеточная аденома левого надпочечника. При сроке наблюдения 32 мес. не получено данных за ХПН (креатинин 83 мкмоль/л, мочевина 4,8 ммоль/л от 04.07.15) и прогрессию опухоли.
Обсуждение. Экстракорпоральная РП в наших наблюдениях составила 10% от всех РП и 4,3% от вмешательств по поводу ПКР: в двух наблюдениях была выполнена по абсолютным, а в трех – по относительным показаниям. В работе [10] частота выполнения экстракорпоральной резекции составила 8,2% от числа пациентов, получивших нефронсберегающее лечение, а в исследовании [11] этот показатель составил 4,4%.
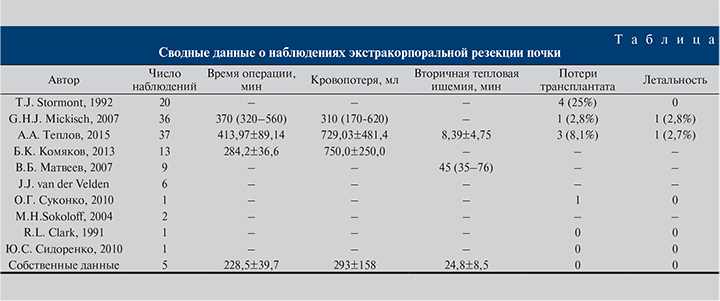
Несомненно, ограничивающим фактором является большая техническая трудоемкость вмешательства, а именно, необходимость реконструкции почечных сосудов и мочеточника. Нами в литературе обнаружено 131 наблюдение об экстракорпоральной РП по поводу почечно-клеточного рака (см. таблицу) [10–19]. Аналогичный подход профессором А.А. Тепловым использован для сосудистой реконструкции в случае аневризм почечной артерии [12].
Анализируя технические особенности экстракорпоральной РП, следует выделить три принципиальных варианта хирургического пособия, обеспечивающих длительную холодовую ишемию. Наиболее ранний из предложенных классический вариант, сторонниками которого являемся и мы, описан выше. Для того чтобы избежать дополнительного доступа, предложены модификации в виде ортотопической аутотрансплантации [12] и холодовой перфузии без пересечения сосудов [13]. Такие подходы снижают хирургическую травму, исключая необходимость доступа в подвздошной области, а в остальном их преимущества довольно спорны. Прежде всего, необходимость скелетирования мочеточника и сосудов для канюляции не позволяет выполнить интрафасциальное удаление почки, т.е. объем радикальной нефрэктомии. Наличие перфузионных канюль и фиксация почки к сосудистой ножке ограничивают манипуляции в операционной ране и требуют расширения хирургического доступа, а нахождение почки интракорпорально, даже в «ледяной крошке», не всегда может гарантировать стабильность гипотермии. Сохранение мочеточника избавляет хирурга от необходимости наложения анастомоза, но приводит к образованию зоны с нестабильной гипотермией на границе антеградной холодовой перфузии и сохранного ретроградного кровотока. Ориентируясь на собственные наблюдения, хотелось бы отметить, что при работе двумя хирургическими бригадами продолжительность операции при гетеротопической аутотрансплантации не увеличивается: пока выполняется этап экстракорпоральной резекции, другая бригада закрывает лапаратомный доступ и осуществляет подход к подвздошным сосудам. Видимо, поэтому мы получили сопоставимые с данными профессора А. А. Теплова при ортотопическом подходе и профессора Б. К. Комякова при локальной перфузии (см. таблицу) показатели продолжительности собственных операций – 228,5±39,7 мин. Кроме того, при гетеротопической позиции аутотрансплантата облегчается перкутанный доступ при необходимости проведения аблативных вмешательств и высокодозной рентгенхирургии, а также нефрэктомии в случае локального рецидива.
В заключение хотелось бы отметить несомненные преимущества экстракорпоральной РП с гетеротопической аутотрансплантацией: соблюдение онкологических принципов в виде объема радикальной нефрэктомии, контролируемый гемостаз на всех этапах вмешательства, «неограниченное» время ишемии, визуальный контроль, отсутствие кровотечения во время резекции почки и возможность интраоперационного морфологического мониторинга. Таким образом, экстракорпоральная РП обеспечивает лечение больных ПКР без потери радикальности и должна использоваться в отношении пациентов с высоким риском резектабельности.



