Введение. Патогенез послеоперационных кровотечений остается одной из малоизученных проблем урологии [1, 2]. Причины развития этого осложнения следует искать в том числе в индивидуальной реактивности тромбоцитарного звена гемостаза [3]. В связи с этим привлекают внимание: 1) адренореактивность организма пациента, отражающая состояние симпатоадреналовой системы, поскольку адреналин может существенно модулировать реакцию тромбоцитов (Тц) на основные агонисты (тромбин, коллаген, АДФ); 2) адаптационные возможности Тц, которые генетически детерминированы в процессе мегакариоцитопоэза. Следует признать, что частота развития и выраженность кровотечений после урологических вмешательств ставят под сомнение информативность существующих методов диагностики и эффективность прогнозирования гемостаза [4]. Это обосновывает интерес к разработке технологий оценки индивидуальной реактивности Тц на этапах консервативного и оперативного лечения пациентов с заболеваниями почек и мочевыводящих путей.
Цель исследования: изучить механизмы индивидуальной реактивности Тц на АДФ и адреналин в связи с вариабельностью гематурии после литотрипсии (ЛТ) у пациентов с хроническим обструктивным пиелонефритом (ХОПН).
Материалы и методы. В исследование включен 41 пациент с ХОПН, который поступил в урологическое отделение для проведения контактной ультразвуковой ЛТ (аппарат Karl Storz-Calcuson). На этапе госпитализации проведен отбор пациентов с гипореактивным фенотипом тромбоцитов, одной из причин которого может быть назначение нестероидных противовоспалительных препаратов (НПВП) и антибиотиков. Данный фенотип тромбоцитов весьма перспективен для прогнозирования кровопотери после оперативных вмешательств. В связи с этим в исследование включены пациенты, принимавшие НПВП и антибиотики в стандартной дозе не менее 5–10 дней до момента госпитализации. Диагноз ХОПН верифицирован на основании жалоб больных, данных анамнеза заболевания, объективного осмотра, результатов клинико-лабораторных и инструментальных исследований. О степени гематурии через 24 ч после ЛТ судили на основании общего анализа мочи и критерия [5], согласно которому микрогематурия характеризуется наличием трех и более эритроцитов в поле зрения. Для градации макрогематурии подсчитали по Нечипоренко количество эритроцитов в 1 мл мочи.
Тромбоциты выделены путем центрифугирования из цитратной периферической крови пациентов. Для анализа функционального состояния Тц использованы агонисты АДФ (5 мкМ) и адреналин (5 мкМ) в концентрации ЕС50, воспроизводящей амплитуду агрегации 50% у здоровых лиц. В исследованиях также были использованы субпороговые концентрации агонистов, которые в контрольной группе (10 здоровых доноров) вызывали агрегацию Тц (АТц) на уровне 10,0±0,8%. Для адреналина ЕС10 составила 0,1 мкМ, для АДФ – 0,5 мкМ. Оценку АТц проводили на агрегометре Chrono-log (США). Все клинические исследования выполнены с разрешения комиссии по биоэтике Донецкого национального медицинского университета им. М. Горького.
Статистическую обработку результатов проводили в пакетах MedCalc; статистически значимую достоверность констатировали при р<0,05.
Результаты. Для достижения поставленной цели в ходе исследования мы попытались ответить на несколько вопросов.
Во-первых, отличается ли индивидуальная реактивность Тц на адреналин после ЛТ? При исходной гипореактивности Тц на агонисты увеличение ответа на адреналин после ЛТ выявлено у 21 (51,2%) пациента, отсутствие изменения реакции – у 15 (36,6%), снижение – у 5 (12,2%; табл. 1).
Таким образом, спектр функциональных ответов Тц на адреналин после проведения ЛТ представлен всеми тремя возможными вариантами, однако преобладающим типом реакции является повышение АТц. При таком типе реакции Тц адреналининдуцированная агрегация после ЛТ возросла в 3,1 раза (95% ДИ – 23–100%), при этом в I квартиле величина АТц составила 23%, в III – 58%. Полученные данные свидетельствуют о том, что фенотип гипоадренореактивных Тц является гетерогенным, причем встречается популяция Тц, которая при необходимости может значительно повышать проагрегантный потенциал.

В группе пациентов со снижением агрегации после ЛТ ответ Тц на адреналин был в 2,5 раза меньше, чем до операции. Сам по себе этот факт расширяет представления о границах реакции гипоадренореактивных Тц. Вероятно, спектр ответов тромбоцитов на адреналин обусловлен индивидуальной реакцией симпатоадреналовой системы пациентов в ответ на ЛТ.
Во-вторых, отличается ли индивидуальная реактивность тромбоцитов на АДФ после ЛТ? Реакция фенотипа гипоадренореактивных Тц на АДФ также представлена тремя возможными вариантами.
У 11 (45,8%) пациентов зарегистрировано повышение ответа Тц на АДФ, у 7 (29,2%) – не выявлено изменений АТц и в 6 (25%) случаях АТц снизилась. Интересен анализ количественной характеристики реакции Тц на АДФ. В случае положительной динамики агрегация увеличилась на 54,9% по сравнению с таковой до ЛТ (р<0,001), а в случае отрицательной динамики уменьшалась на 38,6% (р=0,031).
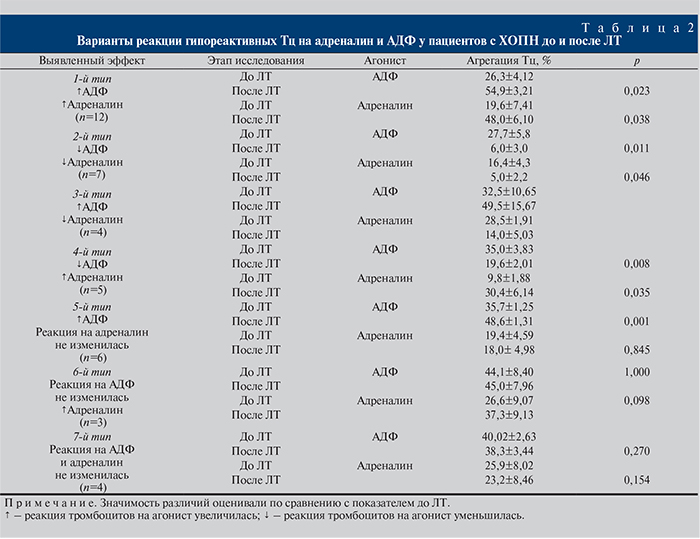
В-третьих, какие сочетания функциональной активности α2-адренорецепторов и пуриновых рецепторов (Р2Y1 и Р2Y12) Тц встречаются после ЛТ? Через 24 ч после ЛТ обнаружено 7 фенотипов Тц, отличавшихся функциональной активностью исследованных рецепторов (табл. 2). Первый фенотип – реакция Тц на адреналин и АДФ повышается. В 12 (29,3%) случаях имело место увеличение ответа Тц как на адреналин (на 144,9%; р<0,05), так и на АДФ (на 108,7%; р=0,023) по сравнению со значениями агрегации до ЛТ. Второй фенотип – реакция Тц на адреналин и АДФ снижается. В 7 (17,1%) случаях реакция Тц на АДФ и адреналин уменьшалась относительно соответствующих значений до ЛТ соответственно в 4,2 (р=0,046) и 4,6 (р=0,011) раза. Третий фенотип – реакция Тц на адреналин снижается, реакция на АДФ повышается. В 4 (9,75%) случаях реакция Тц на АДФ возросла (на 52,3%; р>0,05), а на адреналин снизилась (на 50,9%; р>0,05). Четвертый фенотип – реакция Тц на адреналин повышается, на АДФ снижается. В 5 (12,2%) случаях реакция Тц после ЛТ на АДФ снизилась (на 56%; р=0,008), а на адреналин повысилась (в 3,1 раза; р=0,008) относительно значений агрегации до ЛТ. Пятый фенотип – реакция Тц на адреналин не изменяется, реакция на АДФ увеличивается. Наиболее часто у 6 (14,6%) пациентов встречался тип реакции Тц, когда добавление АДФ сопровождалось повышением АТц, а адреналин не оказывал существенного влияния на агрегацию. При этом АДФ в стандартной дозе ЕС50 статистически значимо повышал АТц на 36,1% (р=0,001) по сравнению с ее величиной до ЛТ. Шестой фенотип – реакция Тц на адреналин повышается, реакция на АДФ отсутствует: в 3 (7,3%) случаях реакция Тц на АДФ не изменилась, тогда как на адреналин повысилась (на 40,2%; р=0,098) относительно значений агрегации, индуцированной данными агонистами до ЛТ. Седьмой фенотип – реакция Тц на адреналин и АДФ отсутствует. В 4 (9,75%) наблюдениях после ЛТ не выявлено статистически значимых различий эффектов адреналина и АДФ на Тц по сравнению с таковыми до ЛТ.
Общим для 1-го, 3, 5 и 6-го фенотипов Тц является нормореактивность пуриновых рецепторов, тогда как при 2-м, 4 и 7-м фенотипах имела место гипореактивность рецепторов. Что касается сенситивности α2-адренорецептора, то во всех фенотипах Тц, за исключением 1-го, выявлена гипоадренореактивность.
Очевидно, что прогнозировать функциональный статус фенотипов Тц крайне сложно, что обосновывает необходимость моделирования проагрегантного статуса in vitro.
Четвертый вопрос: отличается ли выраженность гематурии у пациентов с различной реактивностью Тц на адреналин и АДФ после ЛТ?
Для анализа сформированы две группы пациентов с разной реакцией Тц на АДФ. В 1-й группе (пациенты с 1-м, 3, 5 и 6-м фенотипами Тц), для которой характерна нормореактивность (45±5%) Тц на АДФ после ЛТ, выявлена микрогематурия – 2,64±1,83 103 эр/мл (95 % ДИ – 1,45–8,75∙103). Во 2-й группе (пациенты с 2-м, 4 и 7-м фенотипами Тц) реакция Тц на АДФ находилась в диапазоне гипореактивности (95% ДИ – 5–40 %); при этом выявлена макрогематурия на уровне 27,5±6,1∙103 эр/мл (95% ДИ – 10–52 103 эр/мл). Таким образом, снижение реакции Тц на АДФ после ЛТ, достигающее уровня гипореактивности, служит предиктором выраженности гематурии после оперативного лечения.
Пятый вопрос: различается ли агрегация Тц при одновременном воздействии АДФ и адреналина у пациентов обследованных групп с нормо- и гипореактивностью пуриновых рецепторов после ЛТ?
В 1-й группе пациентов АДФ-индуцированная агрегация при использовании агониста в концентрациях ЕС50 и ЕС10 не отличалась от контрольных значений – соответственно 49,8±3,3 и 10,3±1,0%. Субпороговая концентрация адреналина воспроизвела АТц на 40,7% меньше (р<0,05), чем в контроле (табл. 3). Изолированное действие АДФ и адреналина статистически значимо не различалось (р=0,390). При совместном действии АДФ и адреналина агрегация превышала изолированные эффекты агонистов соответственно в 2,1 и 2,2 раза (p<0,001). В случае предварительной блокады α2-адренорецепторов Тц йохимбином (IС50 10 мкм) стимулирующий эффект не воспроизводился, что подтверждает участие α2-адренорецепторов в зарегистрированном эффекте. Таким образом, сама по себе субпороговая доза адреналина воспроизводит АТц менее 10%, однако потенцирует эффект АДФ. Это означает, что при наличии нормальной реактивности пуриновых рецепторов Тц сохраняют способность в ответ на адреналин повышать функциональную активность, направленную на ограничение гематурии.
Во 2-й группе стимулирующее влияние субпороговой дозы АДФ на Тц было ниже, чем в 1-й группе, на 11,1% (р=0,010) и на 32% (р<0,001) меньше, чем в контроле. Демонстративной была динамика адреналининдуцированной агрегации, поскольку данный агонист воспроизводил эффект на 30% и в 2,4 раза меньше, чем соответственно в 1-й группе и контроле (р<0,001). При этом изолированный эффект АДФ на Тц был на 16,7% больше, чем адреналина (р=0,042). Означает ли это, что при гипореактивности пуриновых рецепторов нивелируется стимулирующая роль адреналина в индукции Тц? Установлено, что при совместном действии АДФ и адреналина на Тц зарегистрированный эффект превышал действие одного адреналина на 25% (р=0,013); для сравнения: в 1-й группе этот эффект, как уже отмечалось, достигал 2,2 раза (р<0,001). Однако не выявлены значимые различия при совместном воздействии адреналина и АДФ относительно изолированного эффекта АДФ (р=0,380). При макрогематурии такое взаимодействие агонистов не эффективно для ограничения кровопотери; одной из причин этого явления может быть сниженная аутокринная стимуляция Тц, по сути – низкая адаптационная реакция Тц при повреждении стенки сосудов. Следовательно, индивидуальная реактивность Тц, проявляющаяся взаимодействием агонистов АДФ и адреналина, определяет эффективность повышения проагрегантного статуса Тц при развитии послеоперационной гематурии.

Обсуждение. До настоящего времени крайне мало публикаций, касающихся анализа механизмов гематурии после литотрипсии. Классические лабораторные методы диагностики позволяют ответить на ключевой вопрос гемостазиологии: снижена ли реактивность Тц на отдельные агонисты (АДФ, коллаген, тромбин и др.) и насколько ингибирована активность циклооксигеназы-1 [6, 7]? Можно предположить, что в силу индивидуальной реактивности организма встречаются разные фенотипы Тц, биологический смысл наличия которых заключается в поддержании гемостаза, для которого «возмущающими» воздействиями являются факторы патогенеза заболевания, используемая медикаментозная терапия или повреждение стенки сосудов в процессе оперативного вмешательства [8–10].
В рамках данной статьи анализ индивидуальных особенностей реакции Тц проводился на гипореактивном фенотипе, что позволило оценить компенсаторные возможности тромбоцитарного звена гемостаза при проведении литотрипсии. Применительно к поставленной цели исследования следует признать, что, во-первых, целесообразно руководствоваться анализом функционального состояния рецепторов Тц, активность которых генетически детерминирована при данном конкретном заболевании; во-вторых, необходимо определить кластеры рецепторов Тц, активность которых сохраняется на фоне используемой медикаментозной терапии каждого конкретного пациента. При обосновании анализа кластера рецепторов, участвующих в активации Тц после ЛТ у пациентов с ХОПН, мы руководствовались принципами перманентного действия этиологических факторов заболевания на клетки крови, возможности одновременного действия нескольких агонистов и взаимодействия различных рецепторов в инициации агрегации Тц [11]. В рамках данной работы анализ тромбоцитарного звена гемостаза у пациентов с ХОПН базировался на исследовании: 1) пуриновых P2Y1- и P2Y12-рецепторов, сенситивность которых определяет эффективность аутокринной стимуляции и адаптационные возможности Тц [12]; 2) α2-адренорецепторов, связывающих адреналин, что позволяло контролировать влияние симпатоадреналовой системы на агрегацию Тц [13]. Активация симпатоадреналовой системы обусловлена наличием конкрементов в лоханке или/и мочеточнике, что периодически провоцирует обструкцию мочевыводящих путей. Вероятно, повышение уровня циркулирующих катехоламинов в крови и синтез АДФ в Тц определяются реактивностью организма.
В свою очередь индивидуальная реакция Тц на основные агонисты, в том числе на адреналин и АДФ, при повреждении стенки сосудов во время оперативного вмешательства предопределяет выраженность гематурии [14]. В то же время анализ in vitro реакции Тц на одновременное воздействие АДФ и адреналина позволяет выявлять пациентов с нормальной реактивностью пуриновых рецепторов. Данный фенотип интересен тем, что возможно повышение функциональной активности Тц при действии адреналина, обеспечивающее ограничение гематурии.
Если отталкиваться от необходимости повышения проагрегантной активности Тц после выполнения ЛТ, то очевидно, что качественная и количественная характеристика агрегации будет зависеть прежде всего от силы сигналов (концентрации агонистов) и сенситивности соответствующих рецепторов, по сути – от индивидуальной реактивности Тц. При этом АДФ и адреналин могут усиливать эффекты друг друга в случае необходимости повышения протромбогенного потенциала Тц. Данный феномен связан с тем, что эффекты этих агонистов реализуются через один и тот же сигнальный путь – Gi–Akt, хотя при этом активируются различные рецепторы – соответственно α2-адренорецептор и пуриновый рецептор Р2Y12 [15]. Анализ изолированных эффектов адреналина и АДФ in vitro подтверждает возможность повышения функциональной активности Тц, если после ЛТ возрастает концентрация адреналина в циркулирующей крови (результат стресс-реакции организма на оперативное вмешательство) и сохраняется эффективность аутокринного механизма регуляции тромбогенеза (секреция АДФ из плотных гранул).
Таким образом, выявленные сочетания функциональной активности α2-адренорецепторов и пуриновых рецепторов (Р2Y1 и Р2Y12) Тц, которые встречаются после ЛТ, формируют представление о кластерах функционально активных рецепторов, способных модулировать тромбогенез и ограничивать гематурию. Дальнейшее изучение индивидуальной реактивности Тц открывает возможность идентификации мишеней фармакологической коррекции с целью профилактики послеоперационной гематурии.



