Мочекаменная болезнь (МКБ), несмотря на значительные достижения как в диагностике, так и в лечении, продолжает занимать важное место в повседневной практике уролога и практикующих врачей общего профиля.
В основе развития МКБ лежат нарушения обменных процессов, связанных как с алиментарными факторами, так и с заболеваниями эндокринной системы, наследственной предрасположенностью, а также c климатогеографическими условиями.
В среднем риск заболеваемости уролитиазом колеблется от 1 до 20% [1]. Заболеваемость уролитиазом среди мужчин выше, чем среди женщин (соотношение около 3:1), и наиболее часто проявляется в возрасте 35–50 лет, однако в последние десятилетия это соотношение имеет обратную тенденцию: так, по данным Stamatelou и соавт., на основании регистра NHANES эта пропорция составила 1,75 к 1 [2].
Распространенность МКБ зависит от географических, климатических, этнических, диетических и генетических факторов. Риск рецидива определяется, преимущественно, заболеванием или нарушением, которое привело к образованию камня. Показатели распространенности МКБ варьируют от 1% до 20%. Встречаемость достаточно высокая в странах с высоким уровнем жизни, например в Швеции, Канаде или США (>10%). В некоторых регионах отмечается увеличение заболеваемости более чем на 37% за последние 20 лет.
Камни можно классифицировать по причинам их образования: инфекционные, неинфекционные, вследствие генетических дефектов или образовавшиеся при приеме лекарственных препаратов (лекарственные) (табл. 1).

Минералогический состав камней
Состав камня служит основой для диагностики и определения тактики лечения. Клинически наиболее значимые минеральные составляющие мочевых камней перечислены в табл. 2.

Факторы и группы риска камнеобразования
 Учитывая высокий риск рецидивирования, а именно порядка 50% пациентов с МКБ имеют минимум 1 рецидив, от 10 до 20% – 3 рецидива и более [3, 4], знание факторов риска имеет наиважнейшее значение (табл. 3).
Учитывая высокий риск рецидивирования, а именно порядка 50% пациентов с МКБ имеют минимум 1 рецидив, от 10 до 20% – 3 рецидива и более [3, 4], знание факторов риска имеет наиважнейшее значение (табл. 3).
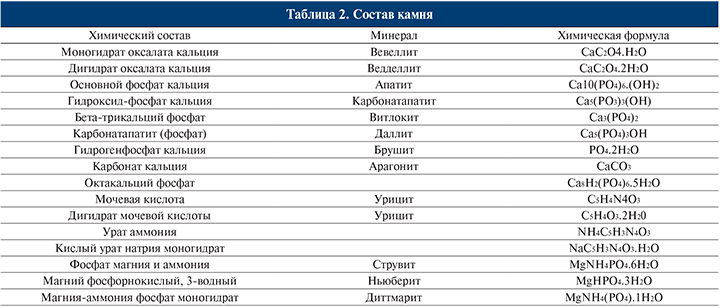
Среди факторов, влияющих на формирование кальциево-оксалатных камней, часто можно выявить заболевания эндокринной системы (паращитовидных желез), желудочно-кишечного тракта и непосредственно почек (тубулопатии). Нарушение пуринового обмена приводит к уратному нефролитиазу. К развитию гиперкальциемии, гиперфосфатемии, гиперкальциурии и гиперфосфатурии приводят заболевания, представленные на рис. 1.
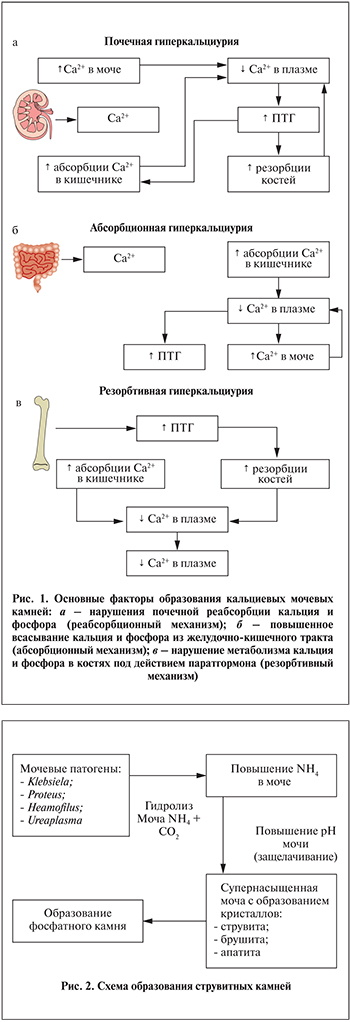
Хронические воспалительные заболевания мочеполовой системы могут способствовать образованию инфицированных фосфатных (струвитных) камней (рис. 2).
В зависимости от факторов и развивающихся метаболических нарушений формируются различные по химическому составу мочевые камни.
Классификация химических видов камнеобразующих веществ
- Неорганические камни:
- при рН мочи 6,0 – кальций-оксалат (вевелит, веделит);
- при рН мочи 6,5 – кальций-фосфат (гидроксил-карбонатапатит);
- при рН мочи 7,0 – магний-аммоний-фосфат (струвит).
 Кальциевые камни (обнаруживают у 75–85% больных) чаще находят у мужчин старше 20 лет. Рецидив регистрируют в 30–40% наблюдений (брушит – в 65%).
Кальциевые камни (обнаруживают у 75–85% больных) чаще находят у мужчин старше 20 лет. Рецидив регистрируют в 30–40% наблюдений (брушит – в 65%).
Струвитные камни связаны с инфекционным агентом. Их выявляют в 45–65% случаев, чаще у женщин. Отличаются высоким риском воспалительных осложнений. Рецидив заболевания быстрый (до 70%) при неполном удалении камня и отсутствии лечения.
- Органические камни:
- при рН мочи 5,5–6,0 – мочевая кислота, ее соли (ураты), цистин, ксантин;
- при рН мочи 6,0 – уратаммония.
Цистиновые (1%) и ксантиновые камни связаны с врожденными нарушениями обмена веществ на уровне организма в целом. Рецидив достигает 80–90%. Метафилактика крайне сложна и не всегда эффективна.
Таким образом, под сочетанным воздействием экзогенных, эндогенных и генетических факторов происходят нарушения метаболизма в организме, сопровождаемые усилением выделения почками камнеобразующих веществ.
Процесс формирования камня может быть длительным и нередко протекает без клинических проявлений, что наиболее характерно для коралловидных камней, а может проявиться острой почечной коликой, обусловленной отхождением микрокристалла.
К сожалению, действующая в настоящее время классификация МКБ не отражает всех клинических форм мочекаменной болезни и не позволяет дать правильную оценку активности процесса, эффективности лечения и адекватно интерпретировать осложнения.
Теории камнеобразования
Существует несколько теорий камнеобразования, каждая из которых имеет право на существование:
- Матричная теория, в основе которой лежат инфекция и десквамация эпителия, закладывающие ядро формирующегося камня.
- Коллоидная теория – когда защитные коллоиды переходят из лиофильного состояния в лиофобное, создавая благоприятные условия для патологической кристаллизации.
- Ионная теория базируется на недостаточности протеолиза мочи, что в условиях измененного рН приводит к камнеобразованию.
- Теория преципитации и кристаллизации рассматривает образование камня при перенасыщенной моче с интенсивным процессом кристаллизации (Buck А., 1990).
- Ингибиторная теория объясняет образование камней нарушением баланса ингибиторов и промоторов, поддерживающих метастабильность мочи (Sommeren А., 1989).
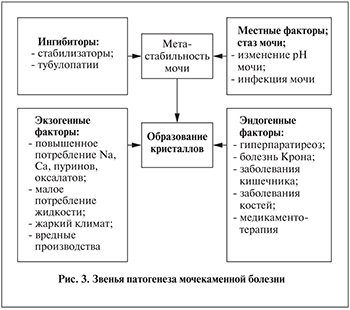
Несмотря на обилие теорий, основным условием для формирования ядра нового конкремента илинуклеации является выход за пределы метастабильного состояния мочи по основным камнеобразующим соединениям [5] (рис. 3).
Для оценки состояния насыщения мочи основными камнеобразующими соединениями и выбора оптимального метода метафилактики камнеобразования мочи в настоящее время используется ряд компьютерных программ, наиболее популярными из которых являются EQUIL 2, разработанная Finlayson и соавт. [6], и JESS (Joint Expert Speciation System), разработанная Rogers и соавт. [7].
 Клиническая классификация мочекаменной болезни
Клиническая классификация мочекаменной болезни
- Одиночный камень.
- Множественные камни.
- Коралловидные камни.
- Первичный.
- Рецидивные; истинно рецидивные; ложнорецидивные.
- Резидуальные.
- Инфицированный.
- Неинфицированные.
В зависимости от локализации камня в мочевыделительной системе выделяют:
- камни чашечек;
- камни лоханки;
- двусторонние камни чашечек;
- камни верхней трети мочеточника;
- камни средней трети мочеточника;
- камни нижней трети мочеточника;
- камни мочевого пузыря;
- камни уретры.
В Российской и Европейской ассоциациях урологов камни мочеточников подразделяют на три зоны в соответствии с анатомической классификацией сегментарного строения мочеточников, где средняя треть проецируется на крестец, тогда как в Американской ассоциации урологов принято подразделение на две зоны, где мочеточник делится на абдоминальную и тазовую части, где границей раздела являются подвздошные сосуды (Сегура, 2002).
Диагностика
Ультразвуковое исследование (УЗИ) – позволяет выявить конкременты в чашечно-лоханочной системе, лоханочно-мочеточниковом и пузырно-мочеточниковом сегментах, а также диагностиро-вать расширение верхних мочевыводящих путей (ВМП). Чувствительность УЗИ при камнях моче-точника составляет 45%, специфичность – 94%, а при камнях почки – 45% и 88% соответственно.
Обзорный снимок органов мочевой системы – позволяет выявить тени, подозрительные на конкременты, в проекции почек, мочеточников и мочевого пузыря, определить их рентген-контрастность, а также облегчает последующее динамическое наблюдение. Чувствительность и специфичность составляет 44–77 и 80–88 % соответственно.
Экскреторная урография (ЭУ) – важный диагностический метод. До внедрения в клиническую практику КТ считалась «золотым стандартом» в диагностике мочекаменной болезни. Рекомендуется проводить в безболевом периоде (вне почечной колики). Показания к инфузионной экскреторной урографии определяются индивидуально, чаще при почечной недостаточности.
Мультиспиральная (спиральная) КТ – позволяет определить конкремент, его линейные размеры, объем, плотность, а также оценить анатомо-функциональное состояние мочевых путей. В настоящее время является «золотым стандартом» в диагностике мочекаменной болезни, особенно при рентгеннегативных камнях, непереносимости рентгенконтрастных препаратов, при почечной колике и т.д. Является более информативным методом, чем ЭУ.
КТ без контрастирования позволяет диагностировать камни, содержащие мочевую кислоту и ксантин, которые являются рентгеннегативными, однако камни, образованные индинавиром, на КТ не визуализируются. Кроме этого КТ без контрастирования дает возможность определить плотность камня, внутреннюю структуру, расстояние от камня до кожи и анатомические особенности – параметры, влияющие на выбор метода лечения. Тем не менее наряду с преимуществами КТ без контрастирования следует учитывать, что она не дает информации о функции почек и анатомии ВМП, а также имеет высокую дозу облучения.
Лучевую нагрузку можно снизить благодаря использованию низкодозной КТ. У пациентов с индексом массы тела (ИМТ) <30 чувствительность низкодозной КТ при диагностике камней в мочеточнике <3 мм составила 86%, а при диагностике камней >3 мм – 100%. По результатам мета-анализа проспективных исследований, средняя чувствительность низкодозной КТ при диагностике МКБ равнялась 96,6%, а специфичность – 94,9%.
При обследовании беременных с подозрением на почечную колику основным методом визуализации является УЗИ, однако в качестве диагностического метода второй линии можно использовать магнитно-резонансную урографию (МРУ), чтобы определить уровень обструкции и визуализировать камень как дефект.
Обследование пациентов с почечной коликой
В настоящее время «золотым стандартом» диагностики при острой боли в области поясницы является нативная или бесконтрастная КТ. Этот метод пришел на смену экскреторной урографии (ЭУ), которая долгое время считалась «золотым стандартом». КТ позволяет определять размер конкремента, его локализацию и плотность. При диагностике конкрементов мочевыводящих путей бесконтрастная КТ обладает более высокой чувствительностью и специфичностью по сравнению с ЭУ (табл. 4) [17–22].

Бесконтрастная КТ способна выявлять рентгеннегативные камни, позволяет определять плотность конкремента, его внутреннюю структуру и расстояние от конкремента до кожи – параметры, которые дают возможность прогнозировать эффективность применения дистанционной ударно-волновой литотрипсии (ДУВЛ) [24, 13–15].
Тем не менее наряду с преимуществами бесконтрастной КТ следует иметь в виду, что, в отличие от ЭУ, она не предоставляет данных о функции почек и анатомических особенностях мочевыводящей системы, а также сопровождается высокой лучевой нагрузкой на пациента (табл. 5). В связи с этим пациентам с индексом массы тела менее 30 был разработан метод низкодозной компьютерной томографии [25] с чувствительностью и специфичностью 96,6 и 94,9 соответственно [26].

Клинический анализ и биохимический анализ крови позволяют судить о признаках воспаления (лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ), почечной недостаточности, степени электролитных расстройств.
Общий анализ мочи, посев мочи – уровень рН мочи, наличие воспалительных изменений, а также определение бактериального агента.
При планировании оперативного вмешательства – скрининговая коагулограмма.

ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика в остром периоде, который проявился почечной коликой, осложнившейся обструктивным пиелонефритом, необходима со следующими хирургическими заболеваниями:
- острым аппендицитом;
- острым холециститом;
- перфоративной язвой желудка или двенадцатиперстной кишки;
- острой кишечной непроходимостью;
- острым панкреатитом;
- внематочной беременностью;
- заболеваниями позвоночника и др.
Основной отличительной особенностью является отсутствие симптомов раздражения брюшины, которые возникают при заболеваниях желудочно-кишечного тракта в отсутствие четкой связи с движениями.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ (табл. 6, 7)

Крайне важны своевременные консультации и подключение к лечению МКБ соответствующего специалиста (эндокринолога, диетолога, гастроэнтеролога).

Лечение
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Первый этап лечения при почечной колике – купирование боли [27, 28]. Нестероидные противовоспалительные средства (НПВС) эффективны для пациентов с почечной коликой [29, 30] и оказывают лучший анальгезирующий эффект по сравнению с опиатами. Пациентам, принимающим НПВС, в краткосрочной перспективе дальнейшая анальгезия требуется реже.
Применение опиатов по сравнению с НПВС связано с более частым развитием рвоты и чаще требует проведения повторной анальгезии.
При камнях мочеточника, сопровождающихся симптомами почечной колики, допустимо проведение срочного удаления камня в качестве терапии первой линии (УД: 1b).
Купирование болевого синдрома достигается при применении различных комбинаций следующих препаратов:
- диклофенак;
- индометацин;
- ибупрофен;
- трамадол.
Лечение должно быть начато сразу при возникновении боли. Следует помнить, что диклофенак снижает уровень гломерулярной фильтрации у больных почечной недостаточностью, у пациентов с нормальной функцией почек этого не происходит.
По классификации Европейской ассоциации урологов (EAU), вероятность спонтанного отхождения камней размером 4–6 мм составляет 80%:
- камни верхней трети – 35%;
- камни средней трети – 49%;
- камни нижней трети – 78%.
По мнению Американской ассоциации урологов (AUA), в 75% случаев камни спонтанно отходят:
- до 4 мм – 85%;
- 4–5 мм – 50%;
- более 5 мм – 10%.
Однако и мелкие камни (до 6 мм) могут стать показанием к их активному лечению в следующих случаях:
- некупируемый болевой синдром;
- обструкция с риском нарушения функций почки и начинающимся воспалением почки;
- уросепсис;
- двусторонний блок или блок единственной почки;
- блок почки у беременной.
ПРОФИЛАКТИКА ПОВТОРНЫХ ПРИСТУПОВ ПОЧЕЧНОЙ КОЛИКИ
У пациентов с конкрементами мочеточника, которые могут отойти самостоятельно, назначение НПВС в таблетированной форме или в форме суппозиториев (диклофенак натрия, 100–150 мг/сут в течение 3–10 дней) снижает риск повторного возникновения боли [31, 32]. Диклофенак может негативно влиять на почечную функцию у пациентов с почечной недостаточностью (УД: 1b) [33]. Согласно результатам двойного слепого плацебо-контролируемого исследования, повторные приступы почечной колики отмечались значительно реже у пациентов, получавших НПВС (по сравнению с пациентами, не получавшими терапии) в течение первых 7 дней лечения [34].
Ежедневный прием α-адреноблокаторов также снижает вероятность повторного эпизода почечной колики (УД: 1a).
Если обезболивание не может быть достигнуто лекарственными средствами и эффект от проводимой консервативной терапии отсутствует, необходимо прибегнуть к хирургическим методам дренирования верхних мочевыводящих путей или дезинтеграции камня. При наличии признаков пиелонефрита следует выполнить дренирование почки с помощью внутреннего мочеточникового стента или чрескожной пункционной нефростомии (ЧПНС). Различий между этими методами дренирования не выявлено, однако, по утверждению ряда авторов, при инфицированном гидронефрозе перкутанное дренирование может иметь больший успех [35, 36].

ДРЕНИРОВАНИЕ ВЕРХНИХ МОЧЕВЫХ ПУТЕЙ (ВМП)
Показаниями к экстренному дренированию являются:
- мочевая инфекция с обструкцией мочевыводящих путей;
- уросепсис;
- некупируемая боль;
- обструкция единственной или трансплантированной почки;
- двусторонняя обструкция;
- беременность
Методы дренирования при обструкции ВМП:
- установка мочеточникового стента;
- установка чрескожного нефростомического дренажа.
Для декомпрессии ЧЛС мочеточниковые стенты и чрескожные нефростомические дренажи имеют одинаковую эффективность (УД: 1b) [35–38].
При любом виде дренирования почки, особенно у больных пиелонефритом, необходимо выполнять забор мочи на посев до назначения антибактериальных препаратов.
Выбор метода остается за врачом и зависит от хирургических навыков врача и технического оснащения медицинского учреждения. В настоящее время не существует данных, способных сформировать четкие рекомендации относительно сроков выполнения дренирования почки.
Окончательное лечение, направленное на удаление камней, следует начинать только после полноценного курса противомикробной терапии и купирования пиелонефрита (не раньше чем через 10–14 дней после нормализации показателей крови). В редких тяжелых случаях при крупном камне верхней трети мочеточника и доказанном гнойнодеструктивном пиелонефрите (карбункул, абсцесс почки) может потребоваться выполнение экстренной открытой операции.
ДАЛЬНЕЙШИЕ МЕРОПРИЯТИЯ
После дренирования почки в случае инфекции, возникшей на фоне обструкции мочевыводящих путей, следует незамедлительно назначить курс антибиотиков. Схему лечения необходимо скорректировать с учетом результатов бактериального посева и антибиотикограммы.

НАБЛЮДЕНИЕ ЗА ПАЦИЕНТАМИ С КОНКРЕМЕНТАМИ В МОЧЕТОЧНИКЕ
Частота отхождения конкрементов
В настоящее время в литературе нет точных и убедительных данных о вероятности самостоятельного отхождения конкрементов в зависимости от их размера. В частности, вероятность отхождения конкрементов мочеточника размером <10 мм исследовалась в мета-анализе 328 больных (табл. 8) [39–41]. Исследования, включенные в мета-анализ, имели некоторые ограничения; например, в ряде исследований отсутствовал стандартный метод измерения размера конкремента, в других исследованиях не проведен анализ локализации конкремента и фактов самостоятельного отхождения конкрементов.

95% конкрементов до 4 мм проходят в течение 40 дней [42].

НАБЛЮДЕНИЕ ЗА ПАЦИЕНТАМИ С КОНКРЕМЕНТАМИ В ПОЧКАХ
Естественное течение МКБ при небольших, не вызывающих обструкции и клинических проявлений конкрементах нижней чашечки изучено недостаточно, по этой причине риск прогрессирования остается неясным. Показаниями к лечению таких камней служат рост конкремента, появление обструкции, присоединение инфекции и острая и/или хроническая боль.
Риск развития почечной колики или необходимости хирургического лечения приблизительно составляет ~10–25% в год, или 48,5% в перспективе 5 лет [42]. В другом ретроспективном исследовании было показано, что у 77% пациентов с асимптоматичными камнями будет отмечено прогрессирование, а 26% потребуют хирургического вмешательства [43].
В ретроспективном исследовании Hubner и Porpaczy было показано, что 83% конкрементов чашечек потребуют оперативного вмешательства в течение 5 лет после установления диагноза [44]. Inci и соавт. провели исследование камней нижней чашечки и заметили, что в течение последующих 52,3 мес у 9 (33,3%) пациентов наблюдался рост конкрементов, а 3 (11%) потребовалось оперативное лечение [45]. В ходе другого проспективного РКИ с периодом клинического наблюдения 2,2 года Keeley и соавт. исследовали две группы пациентов с бессимптомными конкрементами нижних чашечек <15 мм. Пациентам первой группы выполнена ДУВЛ, пациенты второй группы подверглись динамическому наблюдению. При оценке показателя полного отсутствия камней (stone free), симптомов, необходимости дополнительного лечения, качества жизни, функции почек и частоты госпитализации авторы не обнаружили существенной разницы между группами [46]. Osman и соавт. показали, что в течение 5 лет после проведения ДУВЛ 21,4% пациентов с небольшими резидуальными фрагментами будут нуждаться в лечении. Похожие цифры приводят и Rebuck и соавт. Несмотря на то что эти исследования включили пациентов с резидуальными камнями после ДУВЛ и УРС, они могут служить источником информации о естественном течении МКБ [47]. После удаления небольших конкрементов чашечек с помощью ДУВЛ, ЧНЛТ и УРС отмечаются высокие показатели полного избавления от конкрементов и купирования боли, что свидетельствует о необходимости удаления конкрементов чашечек, сопровождаемых клиническими проявлениями [47–49].

МЕДИКАМЕНТОЗНАЯ ЭКСПУЛЬСИВНАЯ ТЕРАПИЯ
Существуют убедительные доказательства, подтверждающие, что медикаментозная экспульсивная терапия (МЕТ) способствует самостоятельному отхождению конкремента мочеточника или его фрагментов, образующихся после дистанционной ударно-волновой литотрипсии (ДУВЛ), а также уменьшает боль (УД: 1a) [34, 50–61]. Согласно данным мета-анализа, у пациентов с конкрементами мочеточника (особенно в нижней трети), принимающих α-адреноблокаторы или нифедипин, вероятность отхождения конкремента выше, а вероятность возникновения почечной колики ниже, чем у пациентов, не получающих такого лечения [34, 50].
Лекарственные препараты
Тамсулозин – один из наиболее часто используемых для МЕТ α-адреноблокаторов [34, 50–52, 62–65]. Однако результаты одного исследования тамсулозина, теразозина и доксазозина продемонстрировали их одинаковую эффективность [66]. Эффективность этой группы препаратов также подтверждается несколькими исследованиями, продемонстрировавшими увеличение частоты отхождения конкрементов на фоне приема доксазозина [66, 67], теразозина [66, 68], альфузозина [69–72], нафтопидила [73, 74] и силодозина (УД: 1b) [75, 76]. Назначение тамсулозина и нифедипина безопасно и эффективно для пациентов с почечной коликой при конкрементах, локализованных в дистальном отделе мочеточника. Однако тамсулозин значительно лучше, чем нифедипин, купирует приступ почечной колики, облегчает и ускоряет отхождение камней мочеточника [56, 77, 78]. К сожалению, ограниченное количество пациентов, принимавших участие в исследованиях [79, 80] (УД: 1b), не позволяет сформировать четкие рекомендации относительно применения глюкокортикоидов в качестве монотерапии или в комбинации с α-адреноблокаторами при проведении МЕТ.
Факторы, влияющие на эффективность медикаментозной экспульсивной терапии тамсулозином
Размер конкремента
Ввиду высокой вероятности самостоятельного отхождения конкрементов размером около 5 мм применение МЕТ может лишь незначительно увеличить частоту отхождения камней этого размера (УД: 1b). Тем не менее применение МЕТ снижает необходимость приема анальгетиков [81–84] (УД: 1a).
Локализация конкремента
Подавляющее большинство исследований было посвящено изучению конкрементов в дистальном отделе мочеточника [34]. В ходе одного РКИ оценивалась эффективность α-адреноблокатора тамсулозина для облегчения самостоятельного отхождения конкрементов размером 5–10 мм из проксимального отдела мочеточника. Основным эффектом тамсулозина было продвижение конкрементов в более дистальные отделы мочеточника либо его отхождение [85] (УД: 1b).
Медикаментозная экспульсивная терапия после дистанционной ударно-волновой литотрипсии
Согласно результатам клинических исследований и нескольких мета-анализов, проведение ЛКТ после ДУВЛ при конкрементах в мочеточнике или почках позволяет ускорить отхождение и увеличить частоту полного избавления от камней, а также снизить необходимость применения анальгетиков [52, 57, 86–92] (УД: 1a).
Медикаментозная экспульсивная терапия после уретероскопии
Проведение MET после контактной уретеролитотрипсии увеличивает частоту полного избавления от камней и снижает частоту приступов почечной колики в послеоперационном периоде (УД: 1b) [93].
Медикаментозная экспульсивная терапия и стентирование мочеточника
Большая часть исследований проведена в течение 30 дней. В экспериментах доказано, что нахождение камня в одном месте мочеточника уже к 14-м суткам приводит к выраженному отеку и гиперплазии слизистой оболочки, перимускулярному склерозу (Кудрявцев Ю.В., 2004). Те же причины влияют на неэффективность как ДУВЛ, так и УРС.

ХЕМОЛИТИЧЕСКОЕ РАСТВОРЕНИЕ КАМНЕЙ
Пероральный хемолиз конкрементов и их фрагментов при правильном его проведении может быть эффективной терапией 1-й линии. Также его можно применять в качестве дополнительного метода к ДУВЛ, чрескожной нефролитолапаксии (ЧНЛТ), уретерореноскопии (УРС) или открытого оперативного вмешательства для облегчения элиминации камня. Комбинированное лечение ДУВЛ+хемолиз может также рассматриваться как малоинвазивный способ лечения пациентов с коралловидными «инфекционными» камнями, полностью или частично выполняющими ЧЛС, при котором существуют противопоказания к выполнению ЧНЛТ. Дробление конкремента приводит к увеличению его поверхности, что повышает эффективность хемолиза (или литолиза). Применение хемолиза возможно только при определенном составе конкрементов.
Пероральный хемолиз
Пероральный хемолиз эффективен только при конкрементах из мочевой кислоты. В основе лечения лежит ощелачивание мочи посредством перорального приема цитратных смесей или двууглекислого натрия [94–97]. При планировании хемолиза следует отрегулировать уровень pH в диапазоне 7,0–7,2. Для профилактики камнеобразования достаточно поддерживать рН в диапазоне 6,4–6,8. Следует назначать ощелачивающие препараты не по однократному исследованию рН мочи, а по средним показателям суточного колебания рН (утро, обед, вечер) за 2–3 дня исследования. В пределах этих значений хемолиз наиболее эффективен, при более высоких значениях рН возрастает риск формирования конкрементов из фосфата кальция. В случае обструкции мочевыводящих путей конкрементов из мочевой кислоты целесообразно назначать пероральный хемолиз после дренирования мочевыводящих путей стентом [98]. Ощелачивание мочи с параллельным применением тамсулозина позволяет достигать более высокой частоты полного избавления пациента от конкрементов, расположенных в дистальном отделе мочеточника [99].

ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Показания к активному удалению камней почек:
- рост камня;
- камни у пациентов с высоким риском камнеобразования;
- обструкция, вызванная камнями;
- инфекция;
- симптоматические камни (боль, гематурия);
- камни размером >15 мм;
- камни размером <15 мм, если наблюдение не является предпочтительной тактикой;
- выбор пациента;
- сопутствующие заболевания;
- социальное положение (профессия или путешествия);
- выбор лечения
Показания к активному удалению камней мочеточника:
- камни с низкой вероятностью самостоятельного отхождения;
- постоянная боль, несмотря на адекватное обезболивание;
- выраженная обструкция;
- нарушение функции почек (почечная недостаточность, двусторонняя обструкция, единственная почка).
 Выбор метода активного удаления почечных конкрементов
Выбор метода активного удаления почечных конкрементов
Камни почечной лоханки или верхней/средней чашечки
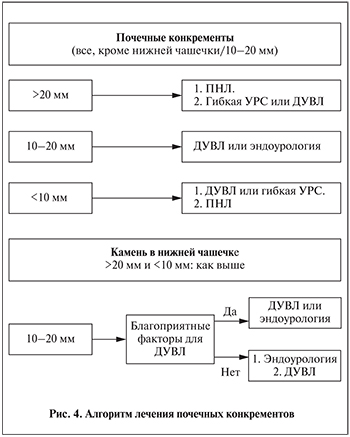
Дистанционная ударно-волновая литотрипсия (ДУВЛ), ЧНЛТ и гибкая УРС являются современным способом лечения камней почек. Эффективность ЧНЛТ зависит от размера конкремента, тогда как частота полного избавления от конкрементов после ДУВЛ или УРС обратно пропорциональна размеру камня [100–103]. Ударно-волновая литотрипсия позволяет достигать отличных показателей полного избавления от конкрементов при лечении камней до 20 мм, за исключением таковых, расположенных в нижней чашечке [102, 104]. ДУВЛ остается методом выбора для лечения таких камней. Методом выбора для удаления более крупных конкрементов (>20 мм) является ЧНЛТ, так как при ДУВЛ часто требуется проведение нескольких сеансов и имеется риск возникновения обструкции мочеточника «каменной дорожкой» с необходимостью выполнения дополнительных вмешательств (рис. 4) [105]. Несмотря на обнадеживающие результаты, ретроградные вмешательства (гибкая уретероскопия) в настоящее время не могут быть рекомендованы в качестве терапии первой линии для камней >20 мм, при которых могут понадобиться многоэтапные вмешательства [106, 107]. Однако гибкая УРС может выполняться с большим успехом в центрах с большим опытом применения данного метода [103, 108]. Ряд исследований свидетельствуют о том, что гибкая УРС может выполняться для лечения камней почки с эффективностью, сопоставимой с ЧНЛТ [109–114]. Преимуществами гибкой УРС являются малая травматичность, низкий риск таких осложнений, как кровотечение и повреждение смежных органов, и менее продолжительное пребывание в стационаре [115].
Камни в нижней почечной чашечке
Частота полного избавления от конкрементов при ДУВЛ более низкая для камней нижней чашечки. Эффективность самой фрагментации камня не зависит от локализации, однако резидуальные фрагменты часто остаются в нижней чашечке, вызывая рецидив камнеобразования. Показатель полного избавления от конкрементов нижней чашечки (SFR) при ДУВЛ составляет 25–85% [100–105].
Следующие факторы могут нарушать отхождение резидуальных конкрементов из нижней чашечки, снижая эффективность ДУВЛ:
- плотные камни, резистентные к ДУВЛ (более 1000 HU);
- камни, плотно охваченные чашечкой или лоханкой;
- длинная шейка нижней чашечки (>10 мм);
- узкая шейка чашечки (<5 мм) [106–108, 116–120];
- патологическая подвижность почки (нефроптоз).
Результаты ДУВЛ камней нижней чашечки часто неудовлетворительны, поэтому для конкрементов >15 мм в настоящее время рекомендуется выполнять эндоскопические операции (ПНЛ и/или гибкую УРС). При наличии не благоприятных для ДУВЛ прогностических факторов ПНЛ и гибкая УРС могут быть альтернативой даже при лечении конкрементов меньшего размера. Эффективность ретроградных вмешательств на почках сравнима [104,105], а, согласно некоторым исследованиям, достоверно выше ДУВЛ [121]. Результаты недавних клинических исследований с использованием уретерореноскопов последнего поколения показали преимущества УРС перед ДУВЛ, однако этот метод более инвазивен [122, 123]. В зависимости от квалификации хирурга крупные камни до 3 см могут эффективно удаляться с помощью гибкой УРС [110, 124–126]. В сложных случаях может быть показано комбинирование антеградного и ретроградного доступов [127–129].
Однако в таком случае часто требуются многоэтапные операции. В сложных случаях МКБ в качестве возможной альтернативы прибегают к открытому и лапароскопическому вмешательству (см. соответствующие главы).

Показания к активному удалению камней мочеточника
- Конкременты с низкой вероятностью самостоятельного отхождения.
- Рецидивирующая или некупируемая боль, несмотря на адекватное обезболивание.
- Сохраняющаяся обструкция.
- Нарушение функции почек (почечная недостаточность, двусторонняя обструкция или единственная почка).
- Отсутствие эффекта литокинетической терапии, несмотря на правильное лечение.
Сравнение дистанционной ударно-волновой литотрипсии и уретероскопии
В исследованиях при локализации конкрементов в верхней трети мочеточника после ДУВЛ и УРС не отмечено различий показателя полного избавления от камней. Однако после проведения стратификации исследования по размеру конкремента при локализации конкремента <10 мм в верхней трети мочеточника (n=1285) оказалось, что ДУВЛ позволяла получать более высокие показатели избавления от камней по сравнению с УРС, а при конкрементах >10 мм (n=819) лучшие показатели были получены после УРС. Это различие объясняется тем, что при лечении конкрементов, расположенных в проксимальном отделе мочеточника, с помощью УРС данный показатель практически не зависит от размера конкремента, тогда как после ДУВЛ его значение обратно пропорционально размеру конкремента. При анализе лечения конкрементов средней трети мочеточника УРС оказалась более эффективным методом по сравнению с ДУВЛ; однако стратификация по размеру конкремента не позволила получить статистически значимые данные из-за небольшого числа пациентов, включенных в мета-анализ. При локализации конкрементов в дистальном отделе мочеточника УРС демонстрирует более высокие показатели избавления от камней, чем другие методы активного удаления конкрементов, независимо от их размера.
ЭФФЕКТИВНОСТЬ (ПОКАЗАТЕЛЬ ПОЛНОГО ИЗБАВЛЕНИЯ ОТ КОНКРЕМЕНТОВ)
В табл. 9 представлены результаты мета-анализа, изучавшего показатели полного избавления от конкрементов (Мед или Медиана) [40].

К сожалению, в настоящий момент проведено недостаточное количество рандомизированных исследований, посвященных сравнению этих методов лечения. Тем не менее при сравнении УРС и ДУВЛ показатели избавления от камней после УРС были значительно выше, чем после ДУВЛ при лечении конкрементов размером <10 и >10 мм в дистальном отделе мочеточника, а также размером >10 мм в проксимальном отделе мочеточника. При лечении конкрементов в среднем отделе мочеточника с помощью ДУВЛ и УРС значительных различий не отмечено. В табл. 10 представлены методы лечения в зависимости от размера и локализации камней.

В настоящее время накоплено недостаточно данных для получения статистически значимых результатов сравнения гибкой и жесткой УРС при проксимальной локализации конкрементов мочеточника, более высокие показатели частоты полного избавления от конкрементов отмечаются при использовании гибкой УРС (87%) по сравнению с полужесткой и гибкой УРС (77%) [40]. По мере распространения гибкой УРС и ее дальнейшего технического усовершенствования данные показатели, вероятно, будут улучшаться.
ОСЛОЖНЕНИЯ
Несмотря на то что выполнение УРС высокоэффективно при камнях мочеточника, она несет более высокий риск развития осложнений. На современном этапе развития эндоурологии вследствие появления возможности использовать новые тонкие ригидные и гибкие инструменты и мелкокалиберные контактные литотриптеры уровень осложнений от уретероскопии значительно снизился [134]. Пациентов следует информировать о том, что вероятность избавления от камня за одну операцию выше при УРС, однако это связано с более высоким риском развития осложнений (см. соответствующие разделы).
Чрескожная антеградная уретероскопия
Чрескожное антеградное удаление камней мочеточника возможно в особых случаях. Например, в случае больших (>15 мм) вколоченных конкрементов, расположенных в проксимальном отделе мочеточника [135–138], или в случаях, когда ретроградное вмешательство невозможно [139–141]. В ряде исследований было оценено преимущество данного метода по сравнению со стандартными техниками. Показатель полного избавления от конкрементов при этом составил 85–100% [135,138, 139, 142]. Частота осложнений была более низкой или не отличалась от таковой при других чрескожных операциях. Однако чрескожное антеградное удаление камней мочеточника связано с более длительным временем операции, пребывания в стационаре и более поздним возвращением к нормальному образу жизни [139–141].
Другие методы удаления камней мочеточника
Удалению конкрементов с помощью лапароскопической и открытой операции (см. разд. «Открытое и лапароскопическое удаление камней почек») посвящено мало исследований. Данные операции обычно применяются лишь в особых случаях, поэтому представленные результаты нельзя использовать для сравнения этой методики с ДУВЛ и УРС.

ОБЩИЕ РЕКОМЕНДАЦИИ И ПРЕДОСТОРОЖНОСТИ ПРИ УДАЛЕНИИ КОНКРЕМЕНТОВ
Инфекция
Если планируется активное удаление конкрементов, в обязательном порядке следует провести лечение инфекции мочевыводящих путей. Недавние исследования показали, что назначение антибактериальной терапии пациентам с исходно отрицательным посевом мочи значительно сокращает частоту послеоперационных инфекционных осложнений [143].
Антикоагулянты и лечение мочекаменной болезни
Пациенты с геморрагическим диатезом или пациенты, получающие терапию антикоагулянтами, должны направляться на консультацию к терапевту (кардиологу) для принятия соответствующих терапевтических мер перед и в течение удаления конкремента [144–148].
Пациентам с неоткорректированным геморрагическим диатезом противопоказаны:
- ДУВЛ [149];
- ЧНЛТ;
- чрескожная нефростомия;
- лапароскопическая хирургия;
- открытые операции [150, 151].
Несмотря на то что проведение ДУВЛ вполне безопасно после коррекции коагулопатии [13, 152, 153], УРС может служить в качестве оптимального и наиболее безопасного альтернативного метода лечения, связанного с меньшей частотой осложнений.
Плотность конкремента
Камни, состоящие из брушита, оксалата кальция, моногидрата или цистина, обладают особой твердостью. Чрескожная нефролитотомия или гибкая УРС являются альтернативным методом удаления крупных камней плотностью более 1.200 HU, резистентных к ДУВЛ.
Рентгеннегативные конкременты
Камни, состоящие из мочевой кислоты (кроме уратов натрия и аммония), могут быть растворены с помощью орального хемолиза. Послеоперационный мониторинг рентгенопрозрачных камней во время хемолиза проводится с помощью УЗИ, однако может потребовать выполнения повторной бесконтрастной КТ.
«Каменная дорожка»
«Каменная дорожка» представляет собой скопление фрагментов камней в мочеточнике, которые не отходят в течение определенного времени и препятствуют пассажу мочи [154, 155]. Она образуется в 4–7% случаев после ДУВЛ [156], главный фактор ее формирования – размер камня [157].
Некоторые исследования показывают, что установка мочеточникового стента перед ДУВЛ конкрементов диаметром >15 мм позволяет предотвращать образование «каменной дорожки» [158]. «Каменная дорожка» может не вызывать никаких симптомов, а может сопровождаться клинической картиной почечной колики, лихорадкой либо симптомами раздражения мочевого пузыря. Основная опасность заключается в обструкции мочеточника, которая может быть бессимптомной в 23% случаев [159] и приводить к почечной недостаточности [161] или обструктивному пиелонефриту. При образовании «каменной дорожки» в единственной почке отмечается анурия [159].
Если «каменная дорожка» не вызывает симптомов, начинать лечение следует с применения консервативных методов в зависимости от предпочтений пациента и его готовности придерживаться протокола динамического наблюдения (табл. 11).

Литокинетическая терапия увеличивает частоту отхождения конкрементов при «каменной дорожке» (УД: 1b). Если спонтанное отхождение камней маловероятно, назначается дальнейшее лечение. ДУВЛ показана в случаях с клиническими проявлениями и без них при отсутствии признаков инфекции мочевыводящих путей и наличии крупных фрагментов. Уретероскопия имеет одинаковую с ДУВЛ эффективность лечения «каменной дорожки». Установка чрескожной нефростомы или мочеточникового стента выполняется при обструкции мочеточника, сопровождаемой клиническими проявлениями, при наличии или отсутствии признаков ИМП.

Основные методы активного удаления камней
ДИСТАНЦИОННАЯ УДАРНО-ВОЛНОВАЯ ЛИТОТРИПСИЯ
ДУВЛ у взрослых пациентов позволяет фрагментировать до 90% конкрементов [161–163].
Тем не менее эффективность ДУВЛ зависит и от таких факторов, как:
- размер, локализация (в мочеточнике, лоханке или чашечке), расстояние от кожи до камня и плотность конкремента; конституциональные особенности пациента и длительность стояния камня в одном месте;
- технология проведения ДУВЛ (применение передового опыта, см. ниже).
Каждый из этих факторов оказывает большое влияние на частоту повторных сеансов лечения и исход ДУВЛ.
Хотя камень разрушается на мелкодисперсную массу, в 15–18% случаев выявляют фрагменты размером до 3–4 мм, что может приводить к формированию «каменной дорожки» в мочеточнике. Камни до 2 см оптимальны для выполнения ДУВЛ. Обязательное условие эффективности и наименьшей травматичности сеанса ДУВЛ – идеально точное выведение камня в фокальную зoну. Это осуществляют под рентгеновским и ультразвуковым наведением (такой возможностью оснащены все современные литотриптеры, табл. 12).

Требования, обеспечивающие эффективность дистанционной ударно-волновой литотрипсии
- Специальная подготовка врача.
- Правильный отбор пациентов для ДУВЛ (оптимальные камни размером до 2 см).
- Точность выведения камня в фокальную зону ударной волны в течение всего сеанса.
- Исходное знание физико-химических свойств камня и функционального состояния почки.
- Соблюдение технологии использования ударно-волновых импульсов.
Противопоказания к дистанционной ударно-волновой литотрипсии
- Беременность [164].
- Нарушения свертываемости крови (гемофилия, прием антикоагулянтов, период мен-струаций у женщин [165].
- Активная фаза воспалительного процесса мочевыводящих путей.
- Деформации опорно-двигательного аппарата или тяжелая степень ожирения, не позволяющая правильно позиционировать пациента и точно навести ударную волну на конкремент.
- Аневризма аорты или любой артерии, расположенная в зоне действия ударной волны [166].
- Обструкция мочевыводящих путей ниже места расположения камня.
Стентирование перед проведением дистанционной ударно-волновой литотрипсии
Стентирование мочеточника перед проведением ДУВЛ выполняется не для повышения частоты полного избавления от конкрементов (УД:1b) [167], а для предотвращения обструкции мочеточника. Использование J-J-стента уменьшает риск возникновения приступа почечной колики и снижает риск образования «каменной дорожки» в раннем послеоперационном периоде, развития инфекционных осложнений [168]. Кроме того, установка стента диаметром 5–7 Сh не препятствует активному отхождению фрагментов (до 3 мм). Установка стента должна осуществляться только под рентгенотелевизионным контролем. В некоторых случаях стент может сопровождаться дизурией, рефлюксом, миграцией его в мочеточник, развитием острого пиелонефрита, что требует немедленной его замены или установки нефростомы. Длительное нахождение стента может привести к его инкрустации. Если эти осложнения сопровождаются развитием острого пиелонефрита, несмотря на правильно установленный стент, необходимо удалить его, заменить новым или выполнить чрескожное дренирование почки. В Рекомендациях по конкрементам мочеточника, изданных совместно AUA и ЕАU в 2007 г., отмечается, что при ДУВЛ по поводу конкрементов мочеточника не рекомендуется обязательное стентирование [40]. В то же время установка внутреннего стента в обход камня или заведение камня в почку создает более благоприятные условия для его эффективного дробления [169].
Передовой клинический опыт
Кардиостимулятор
Пациентам с кардиостимулятором можно выполнять ДУВЛ при условии предварительной консультации кардиолога. Особенно внимательного подхода требуют пациенты с имплантированным кардиовертером, некоторые приборы на время проведения ДУВЛ необходимо выключать. Тем не менее этого может не потребоваться при использовании литотриптеров нового поколения [170]. Частота импульсов выбирается с учетом дыхательной экскурсии почки и выраженностью смещения камня в фокусе ударной волны. Так, значительное смещение камня из фокальной зоны приводит к тому, что более 50% ударной волны попадает мимо камня и приходится на ткань почки, что может приводить к ее травматизации.
Количество, частота импульсов ударной волны, мощность и повторные сеансы дистанционной ударно-волновой литотрипсии
Оптимальной частотой является 1,0–1,5 Гц, 60–90 в 1 мин (1a A). Дальнейшее увеличение частоты приводит к большей травматизации тканей без изменения показателей эффективности [171–174]. Количество импульсов ударной волны, которые можно использовать за 1 сеанс, зависит от типа литотриптера, мощности применяемой энергии ударной волны и исходного состояния почечной паренхимы, размера и плотности камня. Чем более выражены нарушения функции почки (выраженное замещение ее склеротической тканью), тем меньше количество применяемых высокоэнергетичных импульсов и импульсов во время сеанса. При нормальной функции почки и отсутствии обструктивных осложнений восстановление функции почки осуществляется на 7–8-е сутки, при снижении функции и применении высоких энергий ДУВЛ восстановление занимает более длительное время – 12–14 дней. С учетом особенностей первого сеанса повторное дробление камней почки может быть осуществлено не ранее чем через 7 дней. При дроблении камней мочеточника интервал может быть сокращен до 1–2 дней [168, 175, 176]. Режим «рампинга» или литотрипсия на низком энергетическом уровне с постепенным переходом на большую мощность позволяет сократить травматизацию почки и улучшить результаты [177–180].
Улучшение проведения ударной волны
Большое значение имеют система подготовки и контроль ее состояния. Со временем в жидкости ударно-волновой головки накапливаются пузырьки газа, которые ослабляют ударно-волновой импульс, что снижает эффективность дробления. Использование контактного геля между головкой и телом пациента препятствует образованию воздушных пузырьков. Оптимальным доступным контактным веществом для литотрипсии считается гель для УЗИ [181].
Контроль результата
Результаты лечения зависят от врача, выполняющего процедуру; более эффективные результаты достигаются урологами с максимальным опытом и владеющими знаниями о влиянии высоких энергий на биологические ткани человека. Контроль за нахождением камня в фокусе, дроблением и его эффективностью должен осуществляться рентгенологическими методами через каждые 250–500 импульсов. При УЗИ-наведении контроль осуществляется постоянно.
Обезболивание
На литотриптерах с пьезокерамическими генераторами возможно проведение ДУВЛ без наркоза. Боль во время литотрипсии формируется в кожных рецепторах при воздействии на них ударно-волновы импульсов, и для их ликвидации не требуется эндотрахеального, эпидурального наркоза, но в то же время во время процедуры необходимо обеспечить адекватное обезболивание, чтобы не допустить движения пациента и увеличения дыхательных экскурсий [182–184].
Антибактериальная профилактика
Перед ДУВЛ не рекомендуется проводить рутинную антибактериальную терапию, не зная микрофлоры и ее чувствительности к антибиотикам, а также при нарушенном оттоке мочи. Тем не менее профилактику рекомендуется проводить пациентам с мочеточниковым стентом и с высокой вероятностью инфекционных осложнений при малейшем нарушении оттока после ДУВЛ (например, постоянный катетер, нефростомическая трубка, инфекционные конкременты) [185, 186].
Камнеизгоняющая терапия после дистанционной ударно-волновой литотрипсии
Проведение МЕТ после ДУВЛ при конкрементах мочеточника или почек позволяет ускорить отхождение и увеличить частоту полного избавления от конкрементов, а также снизить необходимость в дополнительных анальгетиках [52, 57, 87, 90, 187–193]. Если сравнивать метод ДУВЛ с ЧНЛ и уретероскопией, ДУВЛ сопряжена с меньшей частотой осложнений (табл. 13) [91, 92]. Особое внимание должно быть уделено заболеваниям желудочно-кишечного тракта, так как выполнение ДУВЛ и прохождение ударных волн через острую язву, колит могут спровоцировать кровотечение, разрыв. Также при прохождении ударных волн через воздушную среду (легкие, аэроколия) на границе вода–воздух возникает травматический кавитационный эффект и как следствие – разрыв слизистой оболочки, кровотечение.

Связь между ДУВЛ, артериальной гипертензией и диабетом остается неясной. Опубликованные данные противоречивы и не дают возможности сделать четкие выводы [40, 193–195].
Влияние дистанционной ударно-волновой литотрипсии на функцию почки
По имеющимся данным, ДУВЛ не приводит к острому повреждению почек и повышению концентрации в крови маркера повреждения почечной паренхимы (NGAL) [196].

ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ УДАЛЕНИЯ КАМНЕЙ
Уретероскопия
Эффективность эндоскопических методов в удалении камней не уступает, а при крупных и сложных камнях превосходит ДУВЛ. До сих пор не прекращаются дебаты относительно выбора метода удаления камней почек больших размеров. Приблизительно в 15–20% случаев при контактной уретеролитотрипсии (особенно при камнях верхней трети мочеточника) конкременты мигрируют в почку, что требует выполнения в последующем ДУВЛ. В то же время УРС в 18–20% случаев позволяет ликвидировать «каменные дорожки», образующиеся после ДУВЛ. Таким образом, ДУВЛ и УРС служат взаимодополняющими мини-инвазивными методами удаления камней мочеточников, сочетание которых позволяет добиваться 98–99% эффективности.
Противопоказания
Кроме общих противопоказаний, например, относящихся к общей анестезии или неконтролируемой ИМП, либо наличия аденомы предстательной железы больших размеров УРС может проводиться всем пациентам без каких-либо особых ограничений. Специфические проблемы, такие как стриктура мочеточника, выраженная девиация мочеточника, могут не позволить успешно выполнить ретроградное вмешательство на мочеточнике. В случае затрудненного доступа к мочеточнику альтернативой его дилатации может служить установка J-J-стента (пассивная дилатация) с последующим проведением УРС через 5–7 дней (Smith’s textbook of endourology, 2012).
Кожухи для доступа в мочеточник
Кожухи с гидрофильным покрытием для доступа в мочеточник обычно имеют внутренний диаметр 9 Шр и выше, их можно вводить в мочеточник с помощью проводника и устанавливать в проксимальный отдел мочеточника. Кожухи обеспечивают свободный многократный доступ к верхним мочевыводящим путям, а также значительно облегчают проведение УРС. Использование кожухов для доступа в мочеточник помогает улучшить качество изображения за счет постоянного оттока жидкости, снижая при этом внутрипочечное давление и уменьшая потенциальную продолжительность операции [197,198]. Применение кожухов для доступа в мочеточник может приводить к повреждениям мочеточника до 40%, однако в настоящее время данные, свидетельствующие о долгосрочных последствиях, отсутствуют [199]. Использование кожухов для доступа в мочеточник определяется предпочтениями хирурга.
Профилактика осложнений уретероскопии
- Выполнение операции сертифицированными специалистами.
- Выполнение УРС под рентгенотелевизионным контролем (особенно при длительно стоящих камнях).
- Комплексная и противовоспалительная предоперационная подготовка почки к УРС.
- Предоперационное дренирование почки при длительно стоящих и крупных камнях мочеточника с уретерогидронефрозом выше места расположения камня.
Использование проводников при уретероскопии
Прекращение лечения ингибиторами агрегации тромбоцитов/антикоагулянтами. Эта мера в ряде случаев может быть необязательной, поскольку УРС может проводиться пациентам с нарушением свертываемости крови, при этом отмечается лишь умеренное увеличение осложнений [200, 201].
Дренирование почки катетером или стентом после УРС не обязательно. При непродолжительной (до 45 мин) и без бужирования устья УРС и атравматичном удалении небольшого камня катетер можно не устанавливать. Однако большинство урологов продолжают устанавливать стент после УРС, хотя, как показывают результаты нескольких рандомизированных проспективных исследований, рутинного стентирования выполнение УРС (с полным удалением конкрементов) не требует (УД: 1a); стентирование может быть связано с более высокой частотой побочных эффектов [202–205]. С тем же успехом возможна установка постоянного мочеточникового катетера на более короткое время (1 день). Стент следует устанавливать пациентам с повышенным риском развития осложнений (например, при миграции фрагментов в почку, кровотечении, перфорации, ИМП и беременности). Также стент следует устанавливать во всех сомнительных случаях, чтобы избежать стрессовых неотложных ситуаций. Оптимальная продолжительность стентирования не определена. Большинство урологов предпочитают устанавливать его после УРС на 1–2 нед. Впоследствии пациентам следует проводить обзорный снимок органов мочевой системы, КТ или УЗИ.
Альфа-адреноблокаторы уменьшают неприятную симптоматику, связанную со стентированием мочеточника, и улучшают его переносимость (УД: 1a) [205]. Недавно опубликованный мета-анализ приводит доказательства в пользу улучшения переносимости стентирования мочеточника при приеме тамсулозина [206].
Средняя частота осложнений УРС составляет 9–25% [40, 207] (табл. 14). Большинство из них незначительны и не требуют вмешательства. Отрыв и стриктура мочеточника являются серьезным осложнением, но в настоящее время среди опытных хирургов они отмечаются крайне редко (<1%).


Согласно данным мультицентрового исследования по уретероскопии, включившего 11 885 пациентов [267], эффективность метода составила 85,6%, 89,4 из них не требовали дальнейшего лечения, частота осложнений составила:
- отрыв мочеточника – 0,1%;
- перфорацию мочеточника – 122%;
- кровотечение – 1,4%;
- лихорадку – 1,8%;
- необходимость в гемотрансфузии – 0,2%.
Лечение при осложнениях
- Обязательное дренирование почки: пункционная нефростомия или установка внутреннего стента.
- Активная противовоспалительная дезинтоксикационная терапия на фоне дренирования при развитии острого пиелонефрита.
- Открытая операция (уретеро-уретероанастомоз+нефростомия+интубация мочеточника) при отрыве мочеточника.

Чрескожная нефролитотрипсия и литоэкстракция
Единственным недостатком чрескожной нефролитотрипсии и литоэкстракции (ЧНЛТ) являются ее инвазивность, необходимость в наркозе и травматичность как на этапе доступа к ЧЛС почки, так и непосредственно при сеансе литотрипсии, как следствие – больший риск осложнений, особенно на этапе овладения методом. Совершенствование эндоскопического оборудования и инструментария для дренирования почки позволило существенно снизить риск травматических осложнений. Квалифицированная подготовка уролога, знание топографической анатомии и владение ультразвуковыми методами диагностики обязательны для эффективного проведения операции, так как эффективность результата ЧНЛТ и процент осложнений зависят от самого ответственного этапа операции – создания доступа и бужирования хода. Современные исследования кривой обучения выделяют следующие этапы: 24 – средний уровень, 60 – мастер, более 115 – экспертный уровень [208–210].
В зависимости от места расположения камня вход в полостную систему почки осуществляется через чашечки нижней, средней либо верхней группы. При коралловидных или множественных камнях возможно дробление через два нефростомических хода и более. Для облегчения визуализации чашечек и в целях предотвращения миграции разрушенных фрагментов в мочеточник перед операцией устанавливается катетер, оптимально обтурационный с баллоном с пиелографией.
Используя электрогидравлический, ультразвуковой, пневматический, электроимпульсный или лазерный литотриптер, проводят разрушение камня и одновременную литоэкстракцию фрагментов. Специальный кожух, не теряя нефротомического хода, не только позволяет удалять крупные фрагменты, но и препятствует повышению внутрилоханочного давления. Разработка нового минатюрного эндоскопического инструментария (мини, ультрамини, микромини и микроперк) позволила существенно расширить показания к применению ЧНЛТ. Операцию заканчивают установкой через нефротомический ход дренажа, стента либо вовсе без дренирования.
Принятие решения, как будет дренироваться почка после операции, лежит на оперирующем урологе, основывается на следующих параметрах:
- наличие резидуальных камней;
- возможность выполнения повторной нефроскопии;
- кровотечение (установка нефростомического дренажа более 18 Сн может иметь более высокий гемостатический эффект);
- планируемый перкутанный хемолиз.
Предоперационная визуализация
Что касается ЧНЛТ, информацию об органах, расположенных по ходу прохождения инструментов при осуществлении доступа к ЧЛС (например, селезенке, печени, толстой кишке, плевре, легкому), можно получить с помощью УЗИ или КТ [211]. Адекватная визуализация позволяет избегать такого грозного осложнения, как повреждение кишки. Последнее возможно у пациентов с аномальным ретроренальным расположением отделов толстой кишки, встречаемого с частотой до 1%. Частота встречаемости подобной позиции кишки составляет от 1 до 10% и зависит от положения пациента (на животе или на спине) [212, 213].
Положение пациента
Традиционно пациент при ЧНЛТ находится в положении лежа на животе. Также возможно выполнение операции в положении лежа на спине с подложенным под поясницу валиком или без него. Оба положения одинаково безопасны.
К достоинствам положения лежа на спине при ЧНЛТ относятся [214, 215]:
- меньшая длительность операции;
- возможность одновременного ретроградного трансуретрального вмешательства;
- более удобная позиция хирурга;
- более легкая анестезия.
Существуют работы, свидетельствующие о том, что интерпозиция толстой кишки по ходу пункционного канала встречается реже при положении на спине [215, 216]. Кроме того, заболевания сердечно-сосудистой системы не позволяют больному длительно находиться на животе.
Пункция
Как отмечено выше, расположение толстой кишки на пути доступа к почке может приводить к ее повреждению. Хотя такие повреждения случаются довольно редко, они более вероятны при операции на левой почке и положении больного на животе. Предоперационная МСКТ с контрастированием либо интраоперационное УЗИ позволяют идентифицировать ткани, расположенные между кожей и почкой, уменьшая риск повреждений кишечника [216–219]. Пункция лоханки должна осуществляться только под рентгенотелевизионным контролем с предварительной ретроградной пиелографией либо под УЗИ-наведением.
Дилатация
Расширение чрескожного доступа осуществляется с помощью металлических телескопических бужей, одиночных или баллонного тефлоновых дилататоров. Разница в результатах в большей степени зависит от подготовленности и опыта оперирующего хирурга, чем от выбора инструмента [217]. Результаты глобального исследования CROES свидетельствуют о предпочтительности небаллонного бужирования [219].
Нефростомия и стентирование
Решение вопроса об оставлении нефростомического дренажа после ЧНЛТ зависит от нескольких факторов, среди которых:
- наличие резидуальных конкрементов;
- вероятность повторной нефроскопии в ближайшем послеоперационном периоде;
- значительная интраоперационная кровопотеря;
- мочевой затек;
- обструкция мочеточника;
- возможная стойкая бактериурия из-за инфекционных конкрементов;
- единственная почка;
- геморрагический диатез;
- планируемый чрескожный хемолиз.
Есть данные, свидетельствующие о том, что установка нефростом большего размера ассоциирована с меньшей вероятностью кровотечений в послеоперационном периоде [220]. Бездренажной (tubless) ЧНЛТ называется литотрипсия, которая выполняется без установки нефростомического дренажа. Если не устанавливается ни нефростомический дренаж, ни мочеточниковый стент, такую операцию называют полностью бездренажной (totally tubless) ЧНЛТ. Выполнение полностью бездренажной ЧНЛТ возможно при мини-ЧНЛТ и в неосложненных случаях, что позволяет сократить время пребывания в стационаре и более раннюю реабилитацию без каких-либо отрицательных последствий для пациента [221–228].
Противопоказания
К противопоказаниям к ЧНЛТ следует отнести все противопоказания к общей анестезии. Также она противопоказана пациентам, получающим антикоагулянтную терапию. Последние должны тщательно наблюдаться до и после операции. Антитромботическая терапия должна быть прекращена перед проведением ЧНЛТ в соответствии с механизмом действия препарата и по рекомендации кардиолога и может быть возвращена не ранее 5 сут после операции во избежание геморрагических осложнений [229]. Для снижения риска тромбоэмболии на период отмены антикоагулянтной терапии показаны компрессия нижних конечностей (трикотажная либо пневматическая) и ранняя активизация.
Другие важные противопоказания:
- неконтролируемая ИМП;
- атипичная интерпозиция кишечника;
- опухоль в зоне предполагаемого операционного доступа;
- потенциально злокачественная опухоль почек;
- беременность.
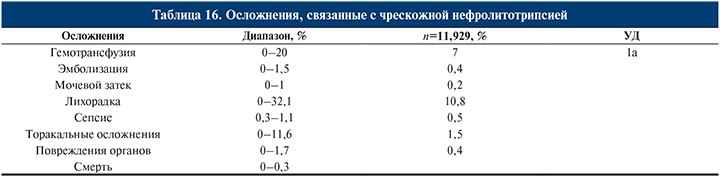
Осложнения чрескожной нефролитотрипсии и литоэкстракции (табл. 16)
- На этапе пункции:
- пункция через лоханку или межшеечное пространство;
- ранение крупных сосудов в момент пункции или бужирования;
- ранение плевральной полости или органов брюшной полости,
- сквозная перфорация лоханки;
- образование подкапсульной либо паранефральной гематомы.
- На этапе выполнения операции и после нее:
- потеря нефротомического хода и необходимость повторных пункций;
- ранение слизистой оболочки лоханки или межшеечного пространства с развитием кровотечения;
- создание неконтролируемого повышенного давления в лоханке;
- острый пиелонефрит;
- тампонада лоханки сгустками;
- отхождение или неадекватное функционирование нефростомического дренажа.
Согласно данным глобального исследования CROES, в которое были включены 5803 пациента [230], показатель полного избавления от камней составил 75,7%, а 84,5% не требовали дополнительного лечения.
У 85,5% не наблюдалось каких-либо осложнений. Среди наблюдавшихся осложнений отмечено: кровотечение (7,8%), перфорации ЧЛС (3,4%), гидроторакс (1,8%), гемотрансфузии (5,7%), лихорадка >38,5°C (10,5%). По классификации Clavien (79,5%), I (11,1%), II (5,3%), IIIa (2,3%), IIIb (1, 3%), IVa (0, 3%), IVb (0, 2%), V (0, 03%).
Профилактика осложнений чрескожной нефролитотрипсии и литоэкстракции
- Квалифицированная сертифицируемая подготовка специалистов по эндоурологии.
- Трансуретральное дренирование почки катетером как возможность выполнения пиелографии и создание условий для пункции, профилактика миграции фрагментов.
- Владение ультразвуковой диагностикой позволит минимизировать процент осложнений на этапе пункции.
- Установка в лоханку страховой струны позволит при любой ситуации восстановить нефротомический ход.
- Недопустимо неконтролируемое введение ирригационных растворов.
- Предоперационная антибактериальная терапия.
Согласно данным глобального исследования CROES [231], позитивный посев отмечается у 16% пациентов, подвергавшихся ЧНЛТ; 40% из числа пациентов с позитивным посевом приходится на E. coli. Лихорадка отмечается у 8,8% с негативным посевом и у 18,2% с позитивным. В 10% лихорадка наблюдается, несмотря на антибактериальную терапию. Факторами риска служат коралловидный камень, позитивный посев, нефростома и сахарный диабет. В другом исследовании [232] было показано, что превентивная антибактериальная терапия пациентов с негативным посевом мочи снижает частоту инфекционных осложнений – 2,5% по сравнению с 7,4%.
Мини-перкутанные операции
Ряд исследований [233–235] свидетельствует о том, что мини-, ультрамини-перкутанные вмешательства могут выполняться с одинаковой эффективностью, что и стандартные операции. К преимуществам данной методики следует прежде всего отнести меньший риск кровотечения, однако в литературе отсутствуют результаты крупных исследований высокого качества, поддерживающие данное утверждение путем прямого сравнения стандартной методики и мини-перкутанного вмешательства. Отдельного внимания заслуживает микроперкутанная операция: данная техника подразумевает доступ к почке и удаление камня через инструмент (иглу) размером 4,85 Fr. Согласно проведенным исследованиям, данный метод позволяет удалять небольшие конкременты с эффективностью, сопоставимой со стандартной ЧНЛТ, при этом частота гемотрансфузии составляет не более 0,71%.
В табл. 17 указаны рекомендованные методы удаления конкрементов в зависимости от их размеров и состава.

Для конкрементов больших размеров (более 2 см) или высокой плотности, плохо поддающихся ДУВЛ, чрескожное удаление камня – лучшая альтернатива лечения. Эффективность одноэтапной ЧНЛТ достигает 74–85%. При комбинированном подходе ЧНЛТ и ДУВЛ эффективность всего 66% (AUA, Guidelines on staghorn calculi, 2009).
В то же время низкая плотность мочевых камней и высокая эффективность ДУВЛ, быстрое отхождение фрагментов по мочевыводящим путям делают метод приоритетным при дроблении даже крупных камней почек. Исследование отдаленных результатов (5–8 лет) применения ДУВЛ в отношении детей не выявило ни у одного больного травматического повреждения почки (Дзеранов Н.К., 1998).

ОТКРЫТОЕ И ЛАПАРОСКОПИЧЕСКОЕ УДАЛЕНИЕ КАМНЕЙ ПОЧЕК
Во всех случаях, когда мини-инвазивные методы (ДУВЛ, УРС, ЧНЛТ) не могут быть применены по техническим либо медицинским показаниям, больным проводят открытую или лапароскопическую операцию.
Эффективность ДУВЛ и эндоурологической хирургии (УРС и ЧНЛТ) значительно уменьшили количество показаний к открытым операциям, которые теперь являются методами терапии второй и третьей линии и применяются только в 1,0–5,4% случаев [236–240]. Открытые операции составляют около 1,5% всех вмешательств по поводу удаления конкрементов в развитых странах, а в развивающихся государствах количество таких операций за последние годы снизилось с 26 до 3,5% [238, 240]. Однако открытые операции все еще необходимы в сложных случаях, когда требуются навыки и опыт выполнения таких открытых хирургических вмешательств на почках и мочеточнике, как обширная пиелолитотомия, пиелонефролитотомия, анатрофическая нефролитотомия, множественная радиальная нефротомия, резекция почки и операции на почках с гипотермией [241–245].
Виды открытых операций
- Пиелолитотомия (передняя, задняя, нижняя).
- Пиелонефролитотомия.
- Анатрофическая нефролитотомия.
- Уретеролитотомия.
- Нефрэктомия (сморщенная почка, пионефроз, множественные карбункулы либо абсцессы почки).
Показания к открытой операции
- Неэффективность или невозможность проведения ДУВЛ и/или
- ЧНЛТ, а также уретероскопической операции.
- Анатомические аномалии почки: инфундибулярный стеноз, конкремент в дивертикуле чашечки (особенно в передней чашечке), обструкция лоханочно-мочеточникового сегмента, стриктура.
- Тяжелая степень ожирения.
- Деформация опорно-двигательного аппарата, контрактуры, стойкая деформация таза и нижних конечностей.
- Сопутствующие заболевания.
- Сопутствующие открытые операции (пластика грыжевых ворот).
- Нефункционирующий нижний полюс (резекция почки), нефункционирующая почка (нефрэктомия).
- Выбор пациента после неэффективной минимально инвазивной операции (пациент может отдавать предпочтение одной операции, чтобы не подвергаться риску многократных вмешательств).
- Конкремент в аномально расположенной почке, при которой чрескожный доступ и ДУВЛ могут быть затруднены или невозможны.
- В педиатрии учитываются те же факторы, что и при лечении взрослых пациентов.
Существует единодушное мнение специалистов, будто наиболее сложные случаи МКБ, включая таковые коралловидных конкрементов, должны лечиться в первую очередь с помощью ЧНЛТ или комбинации ЧНЛТ и ДУВЛ. Если велика вероятность, что допустимое количество чрескожных вмешательств окажется неэффективным или если неоднократные эндоурологические операции не привели к желаемому результату, то приемлемым способом лечения является открытая операция.
Осложнения открытых операций
Осложнения можно разделить на общие и урологические.
К общим осложнениям относят обострение следующих сопутствующих заболеваний.
- Ишемическая болезнь сердца – 5, 6%.
- Желудочно-кишечное кровотечение – 2, 4%.
- Плевропневмония – 2, 1%.
- Тромбоэмболия – 0, 4%.
Наибольшее внимание привлекают интраоперационные осложнения.
- Ятрогенные травмы близлежащих органов – 9,8%.
- Кровотечение (более 500 мл) – 9,1%.
- Острый пиелонефрит – 13,3%.
- Мочевой затек – 1,8%.
- Нагноение операционной раны – 2,1%.
- Послеоперационные стриктуры – 2,5%.
Профилактика осложнений
- Выполнение высококвалифицированными урологами (особенно при повторных операциях).
- Минимальная травматизация почечной паренхимы во время операции.
- Выполнение пиелонефролитотомий при пережатой почечной артерии.
- Адекватное дренирование почки нефростомическим дренажом достаточного диаметра (16–18 Сн) с фиксацией ее к паренхиме и коже.
- Герметичное ушивание разреза почечной лоханки и лигирование раненых сосудов.
- Тщательный уход и наблюдение за работой нефростомического дренажа.
- Наибольшее количество (до 75%) осложнений регистрируют при повторных операциях, когда в силу рубцовых процессов изменяется топографическая анатомия забрюшинного пространства.
Лапароскопические операции
Открытые операции стремительно вытесняются лапароскопическими вмешательствами. В настоящее время лапароскопическая хирургия применяется для удаления конкрементов как почек, так и мочеточников в определенных ситуациях, например при сложных формах конкрементов, при неэффективности проведенной ДУВЛ и/или эндоурологических операций, анатомических аномалиях и тяжелой степени ожирения, а также если запланирована нефрэктомия по поводу нефункционирующей почки с конкрементом. Несмотря на то что пиелолитотомия применяется редко (см. ниже), в отдельных случаях может выполняться лапароскопическое удаление камня с резекцией и пластикой расширенной лоханки [250] или конкремента дивертикула передней чашечки [251]. Частота полного избавления от конкрементов при ЧНЛТ и лапароскопической ретроперитонеальной пиелолитотомии представляется одинаковой, однако при применении лапароскопического доступа более высок риск осложнений [252]. Кроме того, лапароскопическая нефролитотомия как малоинвазивный способ эффективна при удалении сложных коралловидных камней. ЧНЛТ является методом выбора, в то время как лапароскопическое удаление конкрементов следует отнести к резервным методам, применяемым в отдельных случаях [253, 255].
Это довольно несложная операция, при которой частота полного избавления от конкрементов достигает 100% при условии наличия опыта лапароскопической хирургии [256–259]. В большинстве случаев она может заменить открытую операцию [248, 259]. В специальной литературе описаны как ретроперитонеальный, так и трансперитонеальный лапароскопические доступы ко всем участкам мочеточника [258, 260–265]. Лапароскопическая уретеролитотомия в дистальном отделе мочеточника несколько уступает по эффективности операции в среднем и проксимальном отделах, но размер конкремента не влияет на результат операции. Несмотря на свою эффективность, в большинстве случаев лапароскопическая уретеролитотомия не считается терапией первой линии ввиду ее инвазивности, более длительного срока восстановления и более высокого риска осложнений по сравнению с ДУВЛ и УРС [255–258].
Показания к лапароскопическому удалению конкремента
Показания к лапароскопическому удалению камней почек включают:
- камень сложной формы;
- неэффективность проведенной ДУВЛ и/или эндоурологических операций;
- анатомические аномалии;
- тяжелую степень ожирения;
- нефрэктомию по поводу нефункционирующей почки.
Показания к лапароскопическому удалению камней мочеточника включают:
- крупные вколоченные конкременты мочеточника;
- необходимость хирургического вмешательства по поводу сопутствующих заболеваний;
- когда другие неинвазивные или малоинвазивные вмешательства оказались неэффективными;
- в отношении камней верхнего отдела мочеточника лапароскопическая уролитотомия имеет более высокую частоту полного избавления от конкрементов по сравнению с УРС и ДУВЛ [266](УД: 1b).

ПРИНЦИПЫ ЛЕЧЕНИЯ БОЛЬНЫХ МОЧЕКАМЕННОЙ БОЛЕЗНЬЮ

ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ КАЛЬЦИЕВОЙ ФОРМОЙ УРОЛИТИАЗА
Рекомендации по фармакологическому лечению уролитиаза представлены в табл. 19.

Назначение тиазидов повышает реабсорбцию кальция в проксимальных и дистальных канальцах, снижая его экскрецию мочой. Альтернативой может служить назначение ортофосфатов (ингибиторов кристаллизации) и ингибиторов простагландина (диклофенак, индометацин).
Назначение натрия гидрокарбоната (4–5 мг/сут) показано пациентам, устойчивым к терапии цитратными смесями.
Два вида камней из фосфата кальция формируются и зависят от рН мочи. Струвитные камни (смесь аммония магния фосфата и карбонатного апатита) встречаются в инфицированной щелочной моче. Только максимально полное удаление камней может дать результат последующей метафилактики. Брушиты формируются в моче рН, диапазон которой варьируется от 6,5–6,8 – не связан с инфекцией.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ УРОЛИТИАЗОМ В ПРИСУТСТВИИ ИНФЕКЦИИ
Пациентам, у которых камни состоят из магния-аммония фосфата и карбонат-апатита, что вызвано уреаза-синтезирующими микроорганизмами, во время операции необходимо добиваться настолько полного удаления конкрементов, насколько это возможно. Антибактериальную терапию назначают в соответствии с данными посева мочи. Рекомендованы длительные курсы антибактериальной терапии для максимальной санации мочевыводящих путей.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ УРАТНОЙ ФОРМОЙ УРОЛИТИАЗА
Предотвратить формирование камней из мочевой кислоты можно назначением большого количества жидкости (соответственно с диурезом более 2000 мл/сут). Нормализации содержания мочевой кислоты можно достичь строгим соблюдением диеты. Увеличение растительных продуктов и уменьшение мясных, содержащих много пуринов, позволят предотвратить рецидив камнеобразования. Подщелачивание мочи имеет основное значение, поэтому 3–7 ммоль калия гидрокарбоната и/или 9 ммоль натрия цитрата назначают 2 или 3 раза в сутки. В тех случаях, когда сывороточная концентрация уратов или мочевой кислоты повышена, показан аллопуринол в суточной дозе 300 мг или фебуксостат 80–120 мг в день. Чтобы достичь растворения камней, состоящих из мочевой кислоты, необходимо потребление большого количества жидкости в комбинации с приемом 6–10 ммоль калия гидрокарбоната и/или 9–18 ммоль натрия цитрата 5 раз в сутки, а также 300 мг аллопуринола, когда содержание уратов в сыворотке крови и моче нормальное. Химическое растворение камней из урата аммония невозможно.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ЦИСТИНОВОЙ ФОРМОЙ УРОЛИТИАЗА
Потребление жидкости должно составлять более 3000 мл/сут. Чтобы достичь этого, необходимо пить 150 мл жидкости каждый час. Подщелачивание необходимо проводить до тех пор, пока рН мочи не закрепится в пределах более 7,5. Этого можно добиться, принимая 3–10 ммоль калия гидрокарбоната, разделенных на 2–3 дозы. Пациентам с суточным уровнем экскреции цистина более 3 ммоль необходимо применение 250–2000 мг тиопронина в сутки или 75–150 мг каптоприла в сутки.
ЗАКЛЮЧЕНИЕ
Формирование конкрементов в мочевом тракте – патологическое состояние, которое поражает людей разных возрастных групп большинства стран мира и имеет широкую распространенность. Таким образом, уролитиаз и рецидивный его характер, нередко тяжелые осложнения и инвалидизация пациентов имеют большое медикосоциальное значение для здравоохранения в целом. Пациенты с МКБ должны находиться под постоянным диспансерным наблюдением и лечиться не менее 5 лет после полного удаления камня. Коррекция метаболических нарушений должна осуществляться урологами с подключением к лечебному процессу консультантов: эндокринологов, диетологов, гастроэнтерологов, педиатров. Важно не только удаление конкремента из мочевого тракта, но и предотвращение рецидивов камнеобразования, назначение соответствующей терапии, направленной на коррекцию метаболических нарушений для каждого конкретного пациента.
Наименее инвазивные технологии удаления конкрементов, широко внедренные в отечественную практику, позволили сделать один этап лечения МКБ относительно безопасным и рутинным. Отсутствие в арсенале лечебного учреждения малоинвазивных высокотехнологичных методов не может быть основанием для выполнения пациентам травматичных оперативных вмешательств. Настало время организации второго, наиболее важного и эффективного этапа лечения МКБ – консервативной и медикаментозной метафилактики. Это стало возможным с недавних пор благодаря созданию Национального регистра хирургического лечения МКБ (http:// uroreg.org/) при поддержке Российского общества урологов (Н. Гаджиев, В. Малхасян, Н. Тагиров, проф. Б. Гулиев, проф. А. Мартов, проф. С. Петров, проф. Д. Пушкарь), в котором не только выполняется мониторинг хирургического лечения МКБ и ее метафилактики, но и проводится анализ полученных данных для решения новых клинических вопросов и задач. И как следствие – улучшение результатов хирургического лечения МКБ.



