Введение. В настоящее время этиологическая роль высокоонкогенных типов вируса папилломы человека (ВПЧ) при плоскоклеточном раке шейки матки и верхних дыхательных путей считается доказанной. Вместе с тем появились публикации, указывающие на влияние ВПЧ на возникновение РМП, однако данные их весьма противоречивы [1–3]. Что касается ВПЧ высокого онкогенного риска, то все больше исследователей склоняются к причастности вируса к развитию рецидивных форм РМП [2] и появлению инвазивных и низкодифференцированных его форм [4]. Кроме того, Д. А. Головина и соавт. [5] указывают на изменения уротелия вокруг опухоли (микроокружения) вирусом папилломы человека и вовлечение нормального эпителия в онкопроцесс с развитием рецидивных форм опухоли уже в отсутствие вируса [5]. T. Griffiths и соавт. [6] сделали вывод, согласно которому вирус играет определенную роль в канцерогенезе у иммунокомпрометированных пациентов, тогда как у пациентов с нормальным уровнем иммунной защиты ВПЧ в развитии уротелиальной опухоли мочевого пузыря роли не играет [6].
Цель исследования: определить роль ВПЧ высокого онкогенного риска в развитии РМП.
Материалы и методы. Проведено обследование и лечение 100 больных (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет), поступивших в стационар с направительным диагнозом «рак мочевого пузыря». Дополнительно к общепринятым методам обследования взяты анализы крови на IgG, M к вирусу простого герпеса (ВПГ) 1-го и 2-го типов (ВПГ-1 и ВПГ-2), цитомегаловирусу (ЦМВ), вирусу Эпштейна–Барр (ВЭБ). Ткань опухоли и моча взяты на ПЦР-диагностику с целью выявления вирусов ВПГ-1 и ВПГ-2, ВПЧ высокого онкогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68), ЦМВ, ВЭБ. Было исследовано и проанализировано 100 гистологических случаев с эпителиальными злокачественными образованиями мочевого пузыря. Операционный и биопсийный материалы фиксировались в 10%-ном растворе формалина, использовался метод спиртовой проводки с последующей заливкой в парафин. В микропрепаратах, представляющих собой парафиновые срезы, окрашенные гематоксилин-эозином, оценивалась степень анаплазии и мышечной инвазии.
Семидесяти больным была проведена оценка воспалительной инфильтрации в опухолевой ткани и подлежащей строме.

Полуколичественно от 0 до 3 баллов (отсутствие, слабая, умеренная и выраженная степени) оценивались следующие признаки:
- Лимфоцитарно-плазмоцитарный инфильтрат: а) в опухоли, б) рассеянный в подлежащей строме, в) периваскулярная инфильтрация, г) очаговая гиперплазия лимфоидной ткани в виде лимфоидных фолликулов.
- Активность воспаления: а) степень лейкоцитарного инфильтрата, б) степень эозинофильной инфильтрации.
- Цитопатические изменения: а) внутриклеточные включения (койлоцитоз), б) внутриядерные включения.
 В работе использованы общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определены средние значения (M), стандартное отклонение (SD), ошибка среднего (m), в работе данные представлены как M±m, 95% доверительный интервал, частоты (%). Различия между количественными показателями осуществлялись с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна–Уитни. Различия между частотой признаков находились с помощью критерия χ2, точного критерия Фишера. Для малых выборок, для случаев частоты, равной 0% или 100%, использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применен корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p<0,05.
В работе использованы общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определены средние значения (M), стандартное отклонение (SD), ошибка среднего (m), в работе данные представлены как M±m, 95% доверительный интервал, частоты (%). Различия между количественными показателями осуществлялись с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна–Уитни. Различия между частотой признаков находились с помощью критерия χ2, точного критерия Фишера. Для малых выборок, для случаев частоты, равной 0% или 100%, использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применен корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p<0,05.
Результаты. Стадия процесса соответствовала T1NxM0 для 51 больного, в 1 случае имела место папиллома мочевого пузыря, T2NxM0 у 25 больных, в 23% случаев выявлен местнораспространенный процесс. У 7 пациентов диагностировано лимфогенное метастазирование. Трансуретральная резекция стенки мочевого пузыря с опухолью выполнена 70 больным, радикальная цистэктомия с формированием гетеротопического резервуара (уретерокутанеостомией в двух случаях и в ряде случаев с сигмостомией) – 16, резекция мочевого пузыря – 14 пациентам. Опухоль была рецидивой для 24 пациентов.
Вирусные ДНК в опухолевой ткани были выявлены у 34 пациентов (21 мужчина и 13 женщин). Инфицирование ткани ВЭБ имело место в 27 случаях, ЦМВ – в 6, ВПЧ высокого онкогенного риска (16, 39, 45, 52, 59) – в 5, ВПГ-1 и ВПГ-2 – в 1. В 4 наблюдениях выявлена ДНК нескольких вирусов: ВПЧ+ВЭБ (1), ВЭБ+ЦМВ (2), ЦМВ+ВЭБ+ВПЧ (1). Опухоли являлись низкодифференцированными в 56% случаев.
Результаты морфологического исследования образцов тканей представлены в табл. 1. По степени анаплазии пациенты распределились следующим образом: уротелиальная карцинома высокой степени злокачественности имела место у 46 пациентов, умеренной – у 21 больного и низкой – у 32 человек.
В нашем исследовании ВПЧ высокого онкогенного риска (типы 16, 31, 39, 45, 52, 59) были выявлены у 8 больных. Большинство пациентов были в возрасте от 46 до 66 лет (средний возраст – 54,8 года) и только 2 человека в возрасте 75 лет. У 3 пациентов ВПЧ сочетался с ВЭБ, у 1 – с ЦМВ и ВЭБ. Начальная стадия заболевания имела место в 5 случаях, в остальных заболевание соответствовало стадии Т2–Т3N0M0. В 1 случае выявлено множественное поражение мочевого пузыря, у 2 пациентов опухоли были рецидивными. Низкодифференцированная опухоль выявлена в 50% случаев, в 1 случае имел место плоскоклеточный ороговевающий вариант РМП. В соскобе из уретры у 3 мужчин и 2 женщин выявлен такой же тип ВПЧ, как и в опухоли. Наличие ВПЧ высокого онкогенного риска в опухоли коррелировало с выявлением других вирусов в опухоли (R=0,32, р=0,001) и имела место обратная корреляция с наличием лимфоцитов (R=-0,381, p=0,009). Выделение ВПЧ в соскобе из уретры слабо коррелировало с наличием ВЭБ в опухоли (R=0,189, p=0,038) и с наличием других вирусов в опухоли (R=0,238, p=0,026).
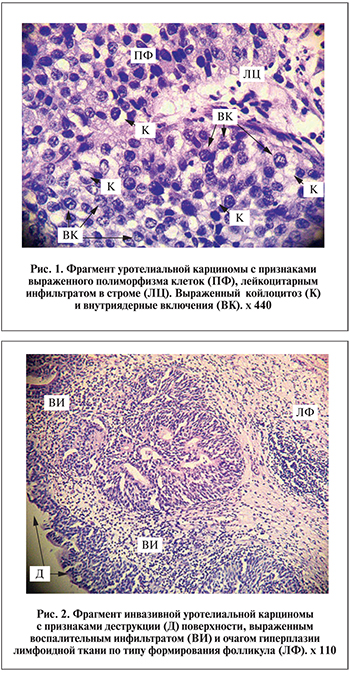
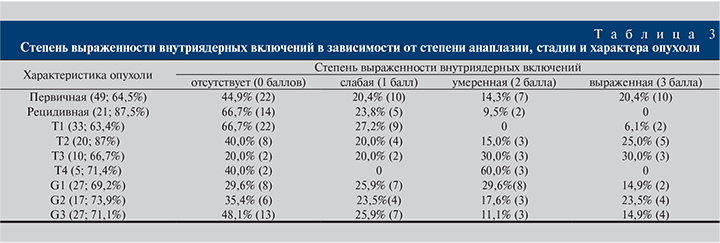
Несмотря на то что непосредственно сам вирус был обнаружен только у 8 пациентов, койлоцитоз как проявление ВПЧ-инфекции из 71 пациента был выявлен у 44 (62%). Вирусная ДНК в опухоли, индуцированной вирусом, присутствует в очень малом количестве – примерно 1 вирусная ДНК на 10 опухолевых клеток, что в свою очередь затрудняет диагностику [7]. Выраженный койлоцитоз (3 балла) имел место у 12 больных, умеренный (2 балла) – у 15, слабый (1 балл) – у 20. У пациентов как с первичным, так и с рецидивным поражением мочевого пузыря в большинстве случаев диагностирован койлоцитоз различной степени выраженности – 64,7 и 57,1% случаев соответственно. Однако у пациентов с первичным поражением в 27,5% случаев имел место слабовыраженный койлоцитоз, в 21,5% – выраженная степень койлоцитоза, тогда как при рецидивном характере опухолевого процесса в 33,3% наблюдений имела место умеренная степень койлоцитоза. Что касается стадии процесса, то чем выше стадия процесса, тем более часто определялся койлоцитоз различной степени выраженности. Если рассматривать степень койлоцитоза в зависимости от степени анаплазии, она была примерно одинаковой вне зависимости от степени дифференцировки опухоли (табл. 2). Были выявлены умеренные и высокие коррелятивные связи койлоцитоза (рис. 1) с наличием ЦМВ в опухоли (R=0,237, p=0,04), уровнем анти-ВПГ-1 и анти-ВПГ-2 IgG (R=0,266, p=0,026), наличием очаговой гиперплазии лимфоидной ткани (R=0,338, p=0,004) (рис. 2), внутриядерными включениями (R=0,463, p=0,00), лейкоцитами (R=0,438, p=0,000). Обратная зависимость имела место между наличием койлоцитоза и множественностью поражения мочевого пузыря (R=-0,364, p=0,001).
 Если рассматривать койлоцитоз в зависимости от присутствия вирусов в опухоли, то умеренно выраженный койлоцитоз (2 балла) был более характерным для вируснегативных пациентов (10,3 против 28,6%; р=0,046), тогда как выраженный койлоцитоз, наоборот, был более характерен для пациентов с выявленной вирусной ДНК в опухоли (27,6 против 9,5%; p=0,06). По всей видимости, у данной категории больных имеет место суперинфекция, т.е. сочетание ВПЧ и других вирусов, что и приводит к более выраженным цитопатическим изменениям.
Если рассматривать койлоцитоз в зависимости от присутствия вирусов в опухоли, то умеренно выраженный койлоцитоз (2 балла) был более характерным для вируснегативных пациентов (10,3 против 28,6%; р=0,046), тогда как выраженный койлоцитоз, наоборот, был более характерен для пациентов с выявленной вирусной ДНК в опухоли (27,6 против 9,5%; p=0,06). По всей видимости, у данной категории больных имеет место суперинфекция, т.е. сочетание ВПЧ и других вирусов, что и приводит к более выраженным цитопатическим изменениям.
В частности, известно, что на фоне ЦМВ-инфекции может развиваться инфицирование другими видами вирусов или бактериями. Доказано, что ЦМВ инфицирует В-клетки, латентно инфицированные ВЭБ, более эффективны, чем ВЭБ-негативные [8]. Нельзя не отметить высокий уровень герпес-вирусных антител у этой категории больных.
Выраженные внутриядерные включения (3 балла) были выявлены у 10 больных из 71, умеренные (2 балла) — у 9, незначительные (1 балл) – у 15, в остальных случаях внутриядерных включений выявлено не было (рис. 3). Сводные данные о степени выраженности внутриядерных включений в зависимости от степени анаплазии и стадии опухолевого процесса представлены в табл. 3.
Как и в случае койлоцитоза, отмечается тенденция повышения степени внутриядерных включений в зависимости от стадии, но не от степени анаплазии, а также наличие более выраженных включений у пациентов с первичной опухолью мочевого пузыря.
Внутриядерные включения слабой степени выраженности и деструктивно-некротические изменения в опухоли умеренной степени статистически значимо чаще встречались в группе пациентов с отсутствием вируса в опухоли (10,7 против 28,6%, p=0,053; 4% против 22%, p=0,02). По всей видимости, здесь имеется цитопатическое действие вируса, однако непосредственно в опухоли он уже не определяется. Наличие внутриядерных включений коррелировало с периваскулярной лимфоидной инфильтрацией (R=0,332, p=0,005), очаговой гиперплазией лимфоидной ткани (R=0,43, p=0,000), наличием лейкоцитов в опухолевой ткани (R=0,463, p=0,000), деструктивно-некротическими изменениями поверхностного слоя клетки опухоли (R=0,306, p=0,013), т.е. сочетания цитопатических изменений с морфологическими признаками герпес-вирусных инфекций (ЦМВ и ВЭБ). Обратная зависимость имела место при первичном характере опухолевого роста (R=-0,28, p=0,018) и множественном поражении уротелия (R=0,237, p=0,048).
Папилломатоз (papillary urothelial hyperplasia) – это гиперпластический процесс в эпителии, характеризующийся образованием сосочковых выростов с пролиферацией эпителия на поверхности (но без формирования отдельно существующего образования с собственной стромой и сосудами), по сути этот процесс является фоновым для развития папилломы, полипа или уротелиальной карциномы низкой степени злокачественности [9, 10].
В нашем исследовании папилломатоз (рис. 4) был выявлен у 30 обследованных, при этом пациенты с папилломатозом были моложе тех, у кого папилломатоз отсутствовал, – 63,3 и 66,8 года соответственно.
Было выявлено статистически значимое увеличение уровня анти-ЦМВ IgG у пациентов с отсутствием папилломатоза (660,8 ЕД/мл vs. 327,2 ЕД/мл, р=0,006), уровня ранних анти-ВЭБ Ig-EA (27,7 ЕД/мл против 11,4 ЕД/мл, р=0,05), а также более выраженные деструктивно-некротические изменения в опухоли (1,4 против 0,7 балла; р=0,02) по сравнению с пациентами с наличием папилломатоза. Различия в подгруппах с и без папилломатоза по наличию лимфоидной инфильтрации, рассеянной в строме (1,7 и 2,1 балла соответственно), и лимфоцитов в опухоли (1,2 и 1,7 балла соответственно, хотя и имели место, не достигали уровня статистической значимости (р=0,09 и р=0,06 соответственно). Существенных отличий между наличием периваскулярной и очаговой лимфоидной инфильтрации, койлоцитозом и наличием внутриядерных включений при количественном определении (в баллах) выявлено не было. Имела место обратная корреляция между папилломатозом и уровнем анти-ЦМВ IgG (R=-0,386, р=0,006), анти-ВЭБ Ig-EA (R=-0,288, p=0,045), стадией процесса (R=-0,538, p=0,00), высокой степенью аналазии (R=-0,36, p=0,01), рецидивным характером процесса (R=-0,356, p=0,011), лимфоидной инфильтрацией, рассеянной в строме (R=-0,265, p=0,063), наличием лимфоцитов в опухоли (R=-0, 268, p=0,06), деструктивно-некротическими изменениями в опухоли (R=-0,0309, p=0,029). Коррелятивные связи наличия папилломатоза с уровнем противовирусных антител и другими морфологическими изменениями представлены на рис. 5.
 Таким образом, в нашей работе мы не выявили ассоциации иммунологических и морфологических признаков папилломатоза и герпес-вирусных инфекций. Наличие папилломатоза свидетельствует о более благоприятном течении опухолевого процесса, что не противоречит данным литературы [9, 11].
Таким образом, в нашей работе мы не выявили ассоциации иммунологических и морфологических признаков папилломатоза и герпес-вирусных инфекций. Наличие папилломатоза свидетельствует о более благоприятном течении опухолевого процесса, что не противоречит данным литературы [9, 11].
Обсуждение. Вирус папилломы человека является онкогенным ДНК-содержащим вирусом. В большинстве случаев в инфицированных клетках выявляется вирусная ДНК, продукция вирусных частиц отсутствует. Функциональный вирусный геном стимулирует пролиферацию эпителиальных клеток организма-хозяина, что может приводить к появлению папиллом. Известно, что до 30% здоровых мужчин имеют в клетках половых органов последовательности ВПЧ, являясь таким образом естественным резервуаром этого вируса [2, 12, 13]. Основным онкогеном является ген Е6, его продукт инактивирует противоопухолевый ген р53 [2, 14, 15].
Роль ВПЧ в развитии РМП исследовалась различными авторами, частота присутствия вируса в опухолевых клетках варьировалась от 2 [16, 17] до 35% [18]. В работе Г. И. Мяндиной и соавт. [1] выявляли ВПЧ 16-го типа в клетках опухоли и периферической крови у пациентов, страдающих РМП [1]. Частота инфицированности данным вирусом составила 28,3%, что согласуется с данными, приведенными в работах других авторов [2, 19, 20].
По данным группы российских авторов, при сравнении групп ВПЧ-положительных и ВПЧ-отрицательных больных выявлено, что ВПЧ-положительный РМП характеризуется более высокой степенью анаплазии клеток, чем ВПЧ-отрицательный, при этом первичный рак бывает ВПЧ-положительным чаще, чем рецидивный. Не отмечено корреляции присутствия ВПЧ в опухоли мочевого пузыря с полом, возрастом и инвазией в мышечный слой [5]. ДНК ВПЧ 16-го типа в первичной опухоли обнаруживается чаще, чем в рецидивной. Авторы предполагают, что ВПЧ 16-го типа нередко оказывается вовлеченным в процесс инициации РМП, ВПЧ-положительные клетки опухоли до того, как в ходе лечения их удается удалить, влияют на микроокружение РМП, в результате чего микроокружение приобретает способность ускорять развитие рецидива из клеток условно нормального уротелия, прилегавшего к удаленной впоследствии опухоли. Воздействие на микроокружение ВПЧ-положительной опухоли в дополнение к воздействию непосредственно на опухоль может стать эффективным способом помощи таким больным – подобные разработки уже ведутся применительно к раку шейки матки [21].
В то же время в литературе есть сообщения о более тяжелом клиническом течении РМП в случае присутствия ДНК ВПЧ в раковых клетках [19].
Ю. Ю. Андреева [2] указывает на связь ВПЧ 16-го типа с рецидивами поверхностной уротелиальной карциномы (ДНК ВПЧ выявлена в 30,2% рецидивных опухолей), при этом возрастает риск развития рецидива поверхностного уротелиального рака при наличии вирусной ДНК, особенно с коэкспрессией p53. Подобные данные получили M. Barghi и соавт. [22], которые выявили ДНК ВПЧ преимущественно 16-го типа у женщин с опухолями мочевого пузыря в 35,6% случаев. Ученые сделали вывод о том, что, по всей видимости, ВПЧ-инфекция является своеобразным триггером развития опухоли мочевого пузыря [22]. В разных географических регионах распространенность разных типов ВПЧ различна. В работе иранских исследователей ВПЧ 18-го типа был выявлен у 34,7% пациентов, страдающих РМП. Авторы указывают на высокую выявляемость данного заболевания в возрастной группе от 51 года до 60 лет [23]. Исследования, проведенные при плоскоклеточном раке и папилломах мочевого пузыря, выявляли лишь единичные ВПЧ-позитивные случаи вирусной инфекции [24]. Индийские ученые предлагают использовать койлоцитоз, выявляемый при цитологическом исследовании мочи, как прогностический фактор наличия ВПЧ-инфекции [25]. В одном из последних обзоров [26], касающихся этиологической роли ВПЧ-инфекции в генезе РМП, представлено 52 работы за 2006–2010 гг., где авторы указывают на этиологическую роль ВПЧ в развитии РМП. Исследователи подчеркивают, что оценка риска онкогенности вируса зависит от его типа, географического региона, гистологического вида опухоли, методики определения ВПЧ и т.д. На основании двух мета-анализов определен высокий риск возникновения РМП, ассоциированного с ВПЧ-инфекцией, что подтверждено данными предыдущих исследований [27, 28]. Продемонстрирован высокий риск развития рака мочевого пузыря у пациентов с высокоонкогенными типами ВПЧ, особенно 16-го типа. Таким образом, именно этот тип ВПЧ обладает более выраженными канцерогенными свойствами в отношении эпителия мочевого пузыря. Установлено умеренное влияние географического положения на распространенность ВПЧ. Нет убедительных данных, касающихся распространенности ВПЧ среди мужчин и женщин, что требует проведения дополнительных исследований.
По нашему мнению, в развитии вирус-индуцированных опухолей мочевого пузыря основополагающими являются два фактора: молодой возраст и латентно протекающая вирусная инфекция (ВПЧ, ВЭБ, ЦМВ, ВПГ) с периодической реактивацией. Реактивация вируса может протекать без клинической симптоматики. Ни у одного из наших пациентов не было клинических признаков вирусной инфекции, кроме наличия опухолевого процесса как проявления атипичного течения вирусной инфекции. Необходимо отметить выраженный рост уровня противовирусных антител у пациентов молодого возраста. Мы поддерживаем точку зрения K. Shigara и соавт. [29], согласно которой основополагающим моментом возникновения ВПЧ-положительного РМП является возраст. Вирус папилломы человека рассматривается как триггер развития опухоли у пациентов молодого возраста на фоне латентной инфекции. При этом не только ВПЧ 16-го или 18-го типа имеет отношение к этиологии РМП, но и другие типы (31, 33, 52, 56, 58) [29]. В нашей работе цитопатические изменения (койлоцитоз и внутриядерные включения) как проявления ВПЧ-инфекции были ассоциированы с активностью и морфологическими признаками герпес-вирусных инфекций, таких как ЦМВ и ВЭБ, ВПГ. Однако их степень варьировалась в зависимости от стадии процесса, но не от степени анаплазии. В данном случае мы предполагаем наличие онкомодулирующего эффекта ЦМВ. На наш взгляд, можно рассматривать ВПЧ и ВЭБ в качестве онкогенов-триггеров, а ЦМВ — как вирус, оказывающий возможный онкомодулирующий эффект. По предварительным данным, папилломатоз не был ассоциирован с высокой стадией процесса, степенью анаплазии, а также не выявлено ассоциации папилломатоза с иммунологическими и морфологическими признаками герпес-вирусных инфекций (ЦМВ и ВЭБ). Эти данные свидетельствуют о более благоприятном течении опухолевого процесса, что не противоречит данным литературы [9–11].
Таким образом, роль ВПЧ высокого онкогенного риска доказана для развития рака шейки матки [28]. Коррелятивные связи развития РМП, ассоциированного с ВПЧ-инфекцией, примерно такие же, как при орофарингеальном раке [30] и раке молочной железы [31]. В настоящее время требуется проведение многоцентровых исследований по выявлению ВПЧ в разных типах опухолей мочевого пузыря, в различных географических регионах с распределением больных по полу, типу определения ДНК вируса в опухоли, ее гистологическому строению и т.д. [25].
Выводы
- Были выявлены коррелятивные связи между койлоцитозом как проявлением ВПЧ и наличием ЦМВ в опухоли, уровнем анти-ВПГ IgG 1-го и 2-го типов, наличием очаговой гиперплазии лимфоидной ткани, внутриядерными включениями, наличием лейкоцитов в опухоли (т.е. морфологическими признаками ВЭБ и ЦМВ), а также обратные коррелятивные связи койлоцитоза и множественности поражения мочевого пузыря.
- Наличие внутриядерных включений коррелировало с периваскулярной лимфоидной инфильтрацией, очаговой гиперплазией лимфоидной ткани, наличием лейкоцитов в опухолевой ткани, деструктивно-некротическими изменениями поверхностного слоя клетки опухоли. Обратная зависимость имела место при первичном характере опухолевого роста и множественном поражении уротелия.
- Было выявлено статистически значимое увеличение уровня анти-ЦМВ IgG, уровня анти-ВЭБ Ig-EA, наличие деструктивно-некротических изменений в опухоли у пациентов с отсутствием папилломатоза стенки мочевого пузыря. Имела место обратная корреляция между папилломатозом и уровнем анти-ЦМВ IgG, анти-ВЭБ Ig-EA, стадией процесса, высокой степенью анаплазии, рецидивным характером процесса, лимфоидной инфильтрацией, рассеянной в строме, наличием лимфоцитов в опухоли, деструктивно-некротическими изменениями в опухоли.



