В марте 2017 г. в Лондоне (Великобритания) прошел очередной, 32-й съезд Европейской ассоциации урологов. Проблема симптомов нижних мочевыводящих путей (СНМП) вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ) традиционно являлась одной из наиболее часто обсуждаемых тем. Данному вопросу были посвящены одна пленарная, одна тематическая сессия и одна видеосессия. Наиболее новые сведения за последние годы были доложены на четырех постерных сессиях, которые затрагивали помимо вопросов консервативного и оперативного лечения еще и ряд спорных и неизученных вопросов этиологии, патогенеза и прогрессирования СНМП, отдельное внимание было уделено вопросам эпидемиологии СНМП.
В настоящем обзоре будут подробно освещены новые тенденции, спорные вопросы по данной проблематике. Поскольку после 31-го Европейского урологического конгресса также был написан аналогичный обзор, представляется актуальным проведение тех или иных параллелей с анализом перспектив развития каждого конкретного направления.
Начиная разбирать и анализировать новые данные по этиологии и патогенезу заболевания, нельзя не остановиться на работе [1], в которой были представлены новые данные, свидетельствующие о нейроэндокринной этиологии ДГПЖ. Авторами были проведены исследования на мышах, которые показали, что снижение периферического синтеза серотонина приводит к развитию фиброзной гиперплазии стромы предстательной железы посредством стимуляции андрогенных рецепторов. Подавление выработки серотонина в переходной зоне простаты может сопровождаться развитием гиперплазии последней. Прогрессирование заболевания характеризуется дальнейшим угнетением синтеза серотонина в тканях простаты. Одним из важных терапевтических подходов терапии СНМП в будущем может стать разработка препаратов, позволяющих нормализовать обмен серотонина в тканях простаты, что может быть реализировано путем либо стимуляции рецепторов серотонина, либо медикаментозного увеличения его концентрации в тканях простаты [1].
Новые данные об эпидемиологии СНМП у корейских мужчин были приведены в работе Y. Park и соавт. [2]. Авторы обследовали более 11 тыс. корейских мужчин старше 40 лет. Выполнялось трансректальное УЗИ предстательной железы и расширенное биохимическое обследование крови. Основной задачей исследования стало обнаружение возможных биохимических отклонений у пациентов с факторами риска прогрессирования заболевания (показатель IPSS более 8 баллов, объем простаты более 30 см3).
Средняя скорость увеличения объема простаты в год в исследуемой когорте составила 0,48 см3 в год. Выявлено, что при повышении уровня α-фетопротеина риск прогрессирования заболевания увеличивается, подобной зависимости не было выявлено ни для липидов высокой плотности, ни для печеночных трансаминаз и уровня азотистых шлаков крови [2].
S. Kim и соавт. [3] изучили сократимость гладкомышечной мускулатуры шейки мочевого пузыря и простатического отдела уретры в эксперименте. Релаксация гладких мышц шейки мочевого пузыря происходила как при воздействии тамсулозина, так и при использовании силденафила. Относительно новыми фактами можно считать то, что величина эффекта зависела от возраста и объема гиперплазированной ткани, т.е. теоретически эффективность α-адреноблокаторов и ингибиторов фосфодиэстеразы 5-типа может быть более высокой для пожилых пациентов с большим объемом простаты, чем для относительно молодых больных без выраженного увеличения предстательной железы [3].
Еще один возможный из терапевтических подходов к терапии СНМП был изучен в работе [4]. Авторами был уточнен механизм релаксации гладких мышц шейки мочевого пузыря под воздействием пикотамида. В эксперименте сокращение гладких мышц вызывалось воздействием эндотелина, последний cпособствует мышечному спазму путем стимуляции как непосредственно эндотелиновых рецепторов, так и через α-адренэргические механизмы и путем активации рецепторов тромбоксана. Установлено, что пикотамид, ингибитор α-адренорецепторов и рецепторов тромбоксана, вызывает более сильную релаксацию, чем просто блокирование α-адренорецепторов. Результатом последующих работ по изучению блокаторов рецепторов тромбоксана может стать разработка новых лекарственных препаратов для терапии СНМП.
Как и на прошлогоднем конгрессе Европейской урологической ассоциации было представлено несколько работ, посвященных изучению дефектов протекания воспалительного процесса в тканях предстательной железы в виде нарушения аутофагоцитоза; считается, что последние могут быть ответственными за развитие как доброкачественной гиперплазии простаты, так и рака предстательной железы. Работа [5] посвящена изучению индекса воспаления, связанного с нарушением аутофагоцитоза, в тканях предстательной железы, полученных после различных диагностических и лечебных вмешательств. Авторы оценивали активность данных процессов у 28 пациентов с ожирением и нормальной массой тела (46 больных). В качестве критериев активности воспалительного процесса авторы использовали уровни экспрессии белков LC3B и р62. Высокий уровень р62 и низкий уровень LC3B были связаны со снижением аутофагоцитоза. Воспалительный индекс был выше у пациентов с низким содержанием LC3B и высоким уровнем p62. Большее количество таких биоптатов было получено в группе пациентов с ожирением, различия между группами были статистически значимыми. Клинические перспективы исследователи видят в возможности как разработки новых молекул для обеспечения лекарственных воздействий, связанных со снижением активности воспаления в тканях простаты, так и выявления повышенного риска прогрессирования ДГПЖ на основании экспрессии данных белков в биоптатах простаты. Авторы считают, что проведение комплексной и длительной противовоспалительной терапии может считаться патогенетическим лечением СНМП при гиперплазии простаты, особенно при наличии избыточной массы тела.
Та же группа авторов доложила результаты эпидемиологического исследования по изучению частоты развития симптомов накопления и ноктурии у пациентов с доброкачественной гиперплазией предстательной железы. Начиная с 2009 г. в данном исследовании приняли участие 495 пациентов с установленным диагнозом доброкачественной гиперплазии предстательной железы и СНМП легкой степени. Пациенты, которым после обследования назначалась медикаментозная терапия, были исключены из исследования. Целью исследования стало выявление факторов риска прогрессирования симптомов накопления и ноктурии (количество ночных мочеиспусканий более 2). В качестве потенциальных факторов рассматривались возраст, объем простаты, масса тела, объем талии, уровень АД и курение. Статистически значимое возрастание риска прогрессирования симптомов накопления и ноктурии было выявлено при наличии метаболического синдрома (отношение рисков [ОР]=2,5) и курении (ОР=1,8). Интересно и дискутабельно, что такие факторы, как возраст и объем простаты, не оказывали статистически значимого влияния на ирритативную симптоматику и ноктурию [6].
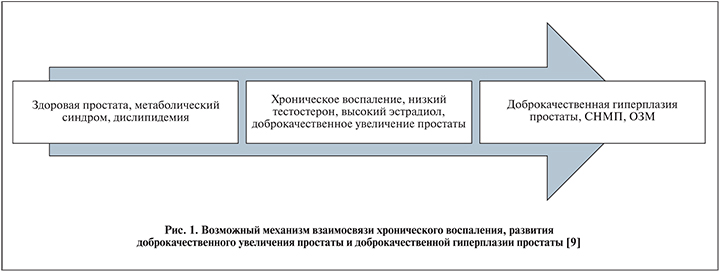
Пленарная сессия, посвященная доброкачественной гиперплазии предстательной железы, имела огромный успех среди участников. Как наиболее значимое событие следует выделить лекцию M. Gacci о роли воспаления в развитии доброкачественной гиперплазии предстательной железы и его влиянии на естественное течение заболевания [7]. Была высказана концепция, согласно которой наличие хронического воспаления предстательной железы приводит к большему увеличению объема простаты и повышению риска возникновения острой задержки мочеиспускания. В качестве иллюстрации вышеуказанного утверждения приводились данные из работы J. Nickel и соавт. [8], которые в течение 4 лет наблюдали группу пациентов с доброкачественной гиперплазией предстательной железы с наличием установленного ранее диагноза «хронический простатит» и без указаний на наличие воспаления простаты в анамнезе [8]. Всего в исследование были включены 4064 пациента со средним объемом простаты 43 см3, контрольное обследование через 2 года прошли 3207 пациентов, в группе c наличием воспаления в предстательной железе средний объем составил 58 см3, в группе без воспаления – 54 см3. Кроме еще одного доказательства, что доброкачественная гиперплазия предстательной железы является прогрессирующим заболеванием, авторы отмечают, что наличие воспаления в предстательной железе способствует более ее быстрому увеличению в размерах. Данная закономерность получила свое отражение в различиях в ОР развития острой задержки мочеиспускания в обеих группах: спустя 4 года ОР в группе с наличием воспаления было в 2 раза выше, чем в группе без воспаления, – 0,08 против 0,04. В завершении лекции автор представил предварительную концепцию влияния хронического воспаления предстательной железы на развитие доброкачественного увеличения простаты и риск развития СНМП (рис. 1) [9].
Следующим небезынтересным исследованием является работа группы исследователей из Голландии по эпидемиологии распространенности и прогрессирования СНМП [10]. Объем представленной выборки составил 36,5 тыс. пациентов с СНМП в возрасте от 55 до 75 лет и находившихся в течение 4 лет под динамическим наблюдением по поводу скрининга рака предстательной железы. На этапе включения в исследование СНМП легкой степени были у 71% пациентов, средней – у 23%, тяжелой степени – у 6%. В более старших возрастных группах частота симптомов была закономерно выше. За период 4-летнего наблюдения авторами были получены следующие данные. В возрастной когорте пациентов старше 65 лет частота симптомов составила 30–35%. Общий риск прогрессирования был невысоким, основными факторами риска стали предшествовавшее объемное увеличение предстательной железы (ОР=2,4), наличие сопутствующего любого онкологического заболевания (ОР=3,8), наличие клинически значимой ишемической болезни сердца (ОР=2,05). Особо отмечено, что возникновение нежелательных явлений при проведении терапии СНМП также оказалось важным прогностическим критерием прогрессирования симптомов.
Лекция C. Roehrborn, ученого с мировым именем, прочитанная от лица Американской урологической ассоциации, была посвящена нерешенным вопросам в терапии доброкачественной гиперплазии предстательной железы и СНМП [12]. Среди наиболее интересных аспектов данной лекции следует выделить возрождение актуальности определения степени внутрипузырной протрузии (до 5 мм – I степень, от 6 до 1 см – II и более 1 см – III степень) в качестве основного критерия не только наличия инфравезикальной обструкции, но и изначальной неэффективности монотерапии α-адреноблокаторами. Следующим важным аспектом лекции явилось обсуждение диагностической ценности наличия остаточной мочи. В частности, было подчеркнуто, что наличие остаточной мочи служит серьезным негативным критерием прогрессирования заболевания в группах-плацебо контроля, но не в группах, где проводилась активная терапия СНМП. Исходные показатели остаточной мочи больных с острой задержкой мочеиспускания выше, чем у пациентов без данного осложнения. По сравнению с возрастом, уровнем простатоспецифического антигена (ПСА) и исходным объемом предстательной железы показатель остаточной мочи – недостаточно четкий критерий, на который стоит опираться при определении дальнейшей тактики ведения. Был еще раз подчеркнут известный факт, что более важен показатель соотношения количества остаточной мочи с исходным объемом мочевого пузыря, нежели показатель количества остаточной мочи у отдельно взятого пациента, и его нельзя использовать изолированно в отношении пациентов с СНМП для определения дальнейшей тактики ведения.
Дебаты по поводу роли комплексного уродинамического обследования пациентов с доброкачественной гиперплазией предстательной железы вызвали колоссальный интерес [12, 13]. В качестве основных аргументов в пользу более широкого использования уродинамических методов до и после операции представлены данные исследований о том, что в послеоперационном периоде около 40% пациентов продолжают испытывать симптомы, связанные как с исходным дооперационным состоянием детрузора, так и с продолжающимися явлениями инфравезикальной обструкции, так как у ряда больных последняя не устраняется в результате операции. В ряде случаев сочетание симптоматики может быть столь сложным, что наличие предоперационных данных о состоянии мочевого пузыря может быть ключом к назначению комбинированного лечения. Со стороны оппонентов широкого использования данного метода прозвучали следующие аргументы: у одного и того же пациента даже в один и тот же день данные этого исследования могут быть различными и только на основании одного исследования нельзя делать выводы, которые могут оказать решающее влияние на выбор тактики ведения. Еще одним аргументом против широкого использования уродинамических методов стал тот факт, что у большинства пациентов они не влияют на дальнейшую тактику ведения пациента, а лишь подтверждают уже имеющиеся клинические подозрения. В итоге участники дискуссии сошлись во мнении, что показаниями к использованию метода являются молодой и пожилой возраст пациента (моложе 50 лет и старше 80 лет), малый объем микции (менее 200 мл) и наличие в анамнезе факторов, которые могут вызывать гипотонию или гиперактивность детрузора, что полностью соответствует текущим рекомендациям Европейской ассоциации урологов [14].

Среди работ, посвященных изучению эффективности тамсулозина, можно выделить работу из Южной Кореи [15]. Авторы провели мета-анализ 7 рандомизированных клинических исследований, посвященных сравнительной оценке эффективности различных дозировок тамсулозина. Было выявлено, что для корейской популяции пациентов эффективность дозировок 0,2 и 0,4 мг оказалась одинаковой, на основании чего авторы сделали следующее заключение: оптимальной дозировкой тамсулозина для корейских пациентов является 0,2 мг вместо традиционных для остального мира 0,4 мг.
Новые данные были приведены для финастерида как базового препарата для лечения объемного увеличения простаты на фоне ее доброкачественной гиперплазии. Группой исследователей были представлены отдаленные результаты исследования PCPT – использования финастерида в качестве химиопрофилактики рака предстательной железы [16]. В данном исследовании, которое продолжалось 7 лет, основная группа пациентов принимала финастерид, в результате исследования данное показание по использованию финастерида было отменено. Исследование проводилось более 10 лет назад, и авторы провели post-hoc-анализ об изменениях, которые произошли с пациентами, принимавшими финастерид за это время. Согласно записям Medicare, были проанализированы счета у 14 из 19 тыс. пациентов, которые наблюдались в исследовании PCPT. Было выявлено общее снижение обращаемости и оперативного лечения в группе пациентов с финастеридом на 6% по сравнению с группой контроля, где с возрастом, напротив, отмечался рост обращаемости. Отдельно был прослежен анамнез пациентов с диагностированным раком предстательной железы и были выявлены две тенденции. Во-первых, в группе пациентов с обнаруженным раком высокого риска не было выявлено случаев прогрессирования заболевания и увеличения опухоль-обусловленной летальности после проведения оперативного лечения по сравнению со средними цифрами в популяции. Во-вторых, в группе пациентов, где было получено уменьшение количества случаев рака низкого риска, за истекшее время не было отмечено возрастания частоты прогрессирования выявленных заболеваний. Авторы делают вывод о безопасности длительного использования препарата и отсутствии значимых рисков для пациентов на фоне данного лечения, а также необходимости отдельного выделения пользы препаратов для более быстрого обнаружения рака высокой степени риска и отдельного снижения риска развития рака простаты низкой степени риска.
Сравнительные данные об эффективности фитотерапии и тадалафила 5 мг в течение 6 мес лечения были проведены в исследовании SPRITE группой авторов во главе с M. Gacci [17]. C апреля 2015 по сентябрь 2016 г. в 21 итальянской клинике были отобраны 439 мужчин в возрасте с 50 до 75 лет. Критериями включения были отсутствие подозрений на рак простаты по данным физикального и лабораторного обследования, показатель IPSS более 12 баллов, объем остаточной мочи менее 100 мл и показатель максимальной скорости мочеиспускания в пределах от 4 до 15 мл/с. Целью исследования стало выявление неменьшей эффективности (non-inferiority efficacy) фитотерапии по сравнению с тадалафилом. В основную группу были набраны 300 пациентов, которые получали фитотерапию, в группу контроля – 139 пациентов, которым был назначен тадалафил 5 мг на срок 6 мес. Исследование завершили 303 пациента, из них 199 из основной и 104 – из группы контроля. Авторами были получены одинаковые результаты в отношении влияния на исследуемые показатели в обеих группах.

Данные еще по одному спорному вопроса были получены в исследовании A. Haider и соавт. [18]. Авторы изучили долговременные эффекты заместительной терапии тестостероном мужчин с возрастным андрогенным дефицитом и сахарным диабетом 2-го типа на СНМП, а также риск развития кардиальных осложнений. Исследование длилось 8 лет. Авторы наблюдали 656 мужчин с возрастным андрогенным дефицитом, из которых в исследование были отобраны 230 мужчин с сахарным диабетом 2-го типа. Средний возраст пациентов на момент включения в исследование составил 63 года. Срок терапии в основной группе (n=113) составил 18 нед. В основной группе было получено статистически значимое снижение балла IPSS и объема остаточной мочи. Вышеуказанные данные были выявлены и ранее, однако наиболее интересной представляется информация о нежелательных явлениях в обеих группах. За период наблюдения в группе заместительной терапии констатировали только один летальный исход. В контрольной группе у 14 пациентов диагностировали инфаркт миокарда, у 16 – нарушения мозгового кровообращения, в 6 случаях имел место летальный исход. Рак простаты был выявлен у 4 пациентов основной группе и у 5 – контрольной. Авторы отмечают важность заместительной терапии тестостероном у пациентов с возрастным гипогонадизмом и удовлетворительный профиль безопасности препарата при длительном наблюдении за пациентами [18].
В Тайване было проведено национальное исследование по оценке влияния сопутствующего приема статинов на необходимость выполнения трансуретральной резекции предстательной железы [19]. Изучена частота выполнения трансуретральной резекции предстательной железы более чем у 3,5 млн пациентов. Проводилась оценка частоты выполнения операции у пациентов на фоне приема α-адреноблокаторов, ингибиторов 5α-редуктазы. Были получены интересные данные, которые, к сожалению, нельзя полностью экстраполировать на российскую популяцию пациентов с ДГПЖ вследствие хорошо изученной различной аффинности рецепторов. Было выявлено, что прием статинов снижает риск проведения операции в 3 раза. На фоне комбинированной терапии этот риск может быть уменьшен до 2 раз, но все равно остается выше в группе пациентов без приема статинов. Авторы делают вывод о целесообразности длительного приема статинов для уменьшения операционного риска. Сами же авторы указывают и на другой серьезный недостаток проделанной ими работы. Ими не были анализированы другие факторы, по поводу которых пациенты вынуждены были длительно принимать статины, возможно, данные пациенты имели серьезные интеркуррентные заболевания, которые являлись противопоказанием к оперативному лечения.
P. Rosier и соавт. изучали прогностические критерии неэффективности терапии СНМП на фоне ДГПЖ [20]. В результате данной работы был разработан специальный индекс, названный CLIPS. Последний определялся авторами как разница между объемом простаты (в см3) и утроенным показателем максимальной объемной скорости мочеиспускания. Данный показатель был определен у 452 пациентов, которым было проведено исследование «давление–поток». Согласно полученным результатам, при отрицательном значении CLIPS у пациентов маловероятно наличие инфравезикальной обструкции. Например, у пациента с объемом простаты 48 см3, максимальной объемной скоростью мочеиспускания 20 мл/с показатель CLIPS (48–-3•20 = -12) имеет отрицательное значение. У данного пациента маловероятно наличие инфравезикальной обструкции.
С другой стороны, у пациента с подобной скоростью мочеиспускания и без данного показателя отсутствуют серьезные подозрения на наличие обструкции.
 К тому же при большом объеме простаты, например, (150 см3) показатель CLIPS всегда будет положителен, что не всегда коррелирует с клинической практикой, так как не у всех пациентов с большими размерами простаты отмечается инфравезикальная обструкция. Скорее всего, использование данного показателя правомерно для пациентов с небольшими и средними объемами предстательной железы. Безусловно, указанный критерий не отменяет необходимости проведения исследования «давление–поток» у пациентов, которым оно показано.
К тому же при большом объеме простаты, например, (150 см3) показатель CLIPS всегда будет положителен, что не всегда коррелирует с клинической практикой, так как не у всех пациентов с большими размерами простаты отмечается инфравезикальная обструкция. Скорее всего, использование данного показателя правомерно для пациентов с небольшими и средними объемами предстательной железы. Безусловно, указанный критерий не отменяет необходимости проведения исследования «давление–поток» у пациентов, которым оно показано.
Результаты анализа счетов за хирургическое лечение пациентов с доброкачественной гиперплазией простаты были представлены С. P. Meyer и соавт. из США [21]. В работе проведено сравнение счетов за монополярную, биполярную трансуретральную резекции простаты и лазерную вапоризацию простаты с использованием зеленого лазера. Авторы разбили счета на следующие составляющие: стоимость палаты и питания, стоимость аренды операционной, стоимость расходных материалов, цена лабораторных тестов, дополнительных обследований и т.д. Операции в порядке увеличения стоимости расположились следующим образом: монополярная резекция предстательной железы (4400 долл. США), биполярная резекция (5500 долл. США), лазерная вапоризация (около 6000 долл. США).
В среднем основные отличия в счетах касались только стоимости расходных материалов. Так, для лазерной вапоризации она составляет треть от стоимости всего счета (примерно 1700 долл. США), для биполярной резекции данный показатель составил 500 долл. США и для монополярной – только 200 долл. Авторы отмечают, что с экономической точки зрения использование лазерной вапоризации не оказывает значимого экономического эффекта на койко-день, а оправданно лишь в случаях, когда использование традиционной операции рискованно.
Продолжением данного анализа считается работа J. Leow о месте малоинвазивной аденомэктомии в США и сравнении ее эффективности с традиционной открытой аденомэктомией [22]. Авторами проведено сравнение основных показателей в трех группах больных: открытая операция, экстраперитонеоскопическая и робот-ассистированная аденомэктомия. Не было получено значимых отличий в показателях 3-месячной летальности (0,4% во всех группах), частоте послеоперационного использования вазопрессоров (6,2%). В группе лапароскопической и робот-ассистированной хирургии было выявлено уменьшение койко-дня в сочетании и незначительным возрастанием стоимости операции (11 и 13 тыс. долл. США). Важным отличием робот-ассистированной операции оказалась ее большая продолжительность (3,5 ч) по сравнению с таковой открытой (2,25 ч) и лапароскопической (2,42 ч). В заключение авторы делают выводы об отсутствии видимых преимуществ у робот-ассистированной технологии при данной операции.
Среди инноваций в области хирургического лечения стоит отметить работу L. Cindolo и соавт. [23] по уточнению новых возможностей зеленого лазера. Авторы выделяют традиционную вапоризацию, энуклеацию и так называемую анатомическую вапоризацию. Суть новой хирургической техники состоит в комбинации вапоризации и энуклеации. С помощью механической энуклеации авторы находят требуемый для проведения энуклеации слой, а далее выпаривают ткани, не проникая глубже данного уровня, при этом не остается резидуальных тканей и в то же время снижен риск перфорации хирургической капсулы. Метод легок в освоении, не требует морцелляции и лишен нерадикальности вапоризации при значительном объеме предстательной железы. Авторами был проведен сравнительный анализ различных показателей интра- и послеоперационного периода. В результате авторами не было получено статистически значимых различий в эффективности всех трех методов.
Сравнение кривых обучения при гольмиевой энуклеации и выполнении подобной операции зеленым лазером было проведено B. Peyronnet и соавт. В обе группы были включены по 100 пациентов. Среди основных отличий авторы отмечают меньшее время операции в группе зеленого лазера – 60 мин против 90 – и более быстрое наступление плато в кривой обучения – 20 операций в группе зеленого лазера против 30 в группе гольмиевого лазера. Авторы считают, что зеленый лазер более прост в освоении [24].
Частота послеоперационного применения м-холиноблокаторов у пациентов после трансуретральной резекции простаты была исследована группой из Южной Кореи [25]. Больные наблюдались в течение 4 лет после операции. Частота использования м-холиноблокаторов в течение первого года после операции снизилась с 31,2 до 10,8%. К 4-му году наблюдения этот показатель снизился незначительно и достиг 7,8%. Другой тенденцией стало уменьшение дозировки препарата: к концу первого года дозировка м-холиноблокатора у 85% пациентов, которые после операции стали принимать препарат, была уменьшена вдвое. Еще одним из результатов явилось отсутствие показанной зависимости от объема удаляемой во время операции ткани. Также было дополнительно установлено, что пациенты, которые использовали м-холиноблокаторы до операции, продолжают принимать данные препараты и после операции.
Важной работой является анализ тенденций назначения консервативной терапии СНМП вследствие ДГПЖ во Франции за 10 лет [26]. Из выбранной популяции пациентов 15% (59 тыс. человек) с данным заболеванием были подвергнуты хирургическому лечению. Средний возраст прооперированных составил 71,1 года, средний срок консервативной терапии от момента установки диагноза до операции – 3,5 года. Наиболее частым видом операции были трансуретральные эндоскопические вмешательства (резекция, вапоризация и энуклеация простаты) – 82%, или более 48 тыс. пациентов. Открытая аденомэктомия была выполнена в 14% наблюдений (более 8000 человек), инцизия простаты – менее чем у 4% пациентов. Остальные методы лечения были использованы менее чем у 1% прооперированных. Наиболее часто первичная терапия состояла из комбинации α-адреноблокаторов, ингибиторов 5α-редуктазы и фитотерапии (31,1%), чуть реже использовалась комбинация α-адреноблокаторов и ингибиторов 5α-редуктазы (22,9%), α-адреноблокаторов и фитопрепаратов (22,3%) и т.д. Автор делает вывод, согласно которому монотерапия α-адреноблокаторами, как и другими классами препаратов, не является наиболее часто используемой, в то же время известные недостатки комбинированной терапии открывают поле для более широкого использования фитотерапии, несмотря на отсутствие четких рекомендаций со стороны Европейской ассоциации урологов. Третьим разделом данного исследования явился анализ частоты прекращения терапии. За 10 лет наблюдения 54 тыс. пациентов прекратили лечение (14% от всей популяции наблюдаемых пациентов во Франции). Среди основных причин были выделены следующие: летальный исход, операция, лечение выявленного рака простаты и только затем прекращение терапии по причинам развития нежелательных явлений. Автор делает вывод об удовлетворительном профиле безопасности различных вышеупомянутых комбинаций препаратов.
В тематической лекции, посвященной анализу хирургических методов лечения доброкачественной гиперплазии простаты, J. Cornu представил собственный анализ применяемых физических факторов, используемых для удаления аденоматозных узлов [27].
Как видно из табл. 1, наиболее часто используемыми методиками являются монополярная и биполярная резекции, затем следует тулиевая лазерная резекция и т.д. При выпаривании тканей для устранения инфравезикальной обструкции первое место принадлежит зеленому лазеру, далее следует плазменная или биполярная вапоризация простаты. Ранее «золотым» стандартом энуклеации была открытая аденомэктомия, однако с внедрением гольмиевого лазера в клиническую практику именно он используется наиболее часто, когда речь идет об энуклеации тканей. Далее следует биполярная и тулиевая энуклеация тканей.
В табл. 2 представлены современные данные об используемых альтернативных хирургических методах лечения.
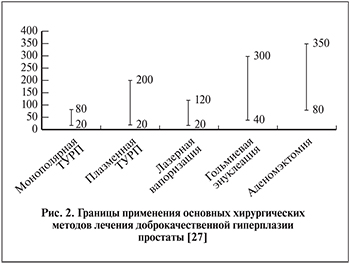
Обилие методов воздействия на ткань простаты, огромное количество медицинских приборов, которые исследуются или уже зарегистрированы, приводят к неутешительному выводу об отсутствии идеального метода, с одной стороны, и наличии серьезных ограничений в применении данных методов, с другой. Автор доклада акцентировал внимание на том, каким больным предлагается использование данных методов лечения (желание избежать недостатков традиционной хирургической операции, выраженные сопутствующие заболевания). Жирным шрифтом выделены методы, которые активно используются в клинической практике. Терапия ботулотоксином не получила в этом году одобрения Европейской ассоциации урологов. В заключении обзора данного выступления приводим диаграмму зависимости использования метода от объема простаты (рис. 2).
В конце лекции автор делает следующий вывод: на данный момент универсальными методами, применимыми практически при любом размере железы, являются гольмиевая энуклеация и биполярная электрохирургия простаты. Как видно на рис. 2, место бывшего «золотого» стандарта – монополярной резекции простаты весьма ограничено и только экономические факторы мешают постепенному уменьшению частоты применения данной методики. Автор доклада выразил твердую уверенность в том, что спустя 10 лет молодые врача-урологи уже будут изучать данный метод как имевший большую распространенность в прошлом, подобно тому, как в настоящее время большинство урологов относятся к открытой аденомэктомии.
В заключение следует отметить, что большинство авторов отмечают необходимость проведения дальнейших исследований по каждой из обсужденных частей данной темы, что позволит улучшить результаты диагностики и лечения пациентов с ДГПЖ.



