Введение. Мочекаменная болезнь (МКБ) остается важной медико-социальной проблемой, затрагивающей в зависимости от региона от 0,5 до 20% населения земного шара, при этом главной минералогической фазой конкрементов у 70–90% пациентов являются гидраты оксалата кальция [1–3]. Постоянный рост заболеваемости и высокая частота рецидивов МКБ [4, 5] заметно увеличивают расходы на амбулаторное и стационарное лечение пациентов, взывая о необходимости внесения концептуальных изменений в стратегию диагностики и тактику лечения заболевания [5–8]. Тем не мене до сих пор после удаления камня или его фрагментов должная профилактика повторного камнеобразования в отечественных клиниках не проводится [5]. Многие практикующие урологи формально подходят к выявлению причин МКБ и назначению противорецидивного лечения, обычно ограничиваясь лишь общими и рассчитанными на короткий срок рекомендациями без проведения каких-либо дополнительных лабораторных исследований [5]. Этого часто оказывается недостаточно. Имеющиеся в литературе и проведенные нами исследования показывают [9, 10], что, например, для нормализации суточной экскреции цитратов обычно требуется не менее двух месяцев терапии цитратными смесями, при этом эффект существенно зависит от начального уровня экскреции и, как свидетельствуют данные [9], сохраняется лишь в течение нескольких месяцев. Отсутствие сведений о количественном минералогическом составе конкрементов, имеющих место факторах риска и метаболических нарушениях у пациентов с МКБ создает большие сложности в установлении причин камнеобразования. В результате множество пациентов после проведенного лечения достаточно скоро попадают в стационар с рецидивом МКБ [5].
Цель данного исследования состояла в выявлении наиболее вероятных нарушений метаболизма и факторов риска камнеобразования у группы пациентов с кальций-оксалатным уролитиазом, а также установлении взаимосвязи минералогического состава конкрементов с имеющими место нарушениями экскреции ингибиторов и промоутеров камнеобразования.
Материалы и методы. Нами были обследованы 50 пациентов (32 женщины и 18 мужчин) с кальций-оксалатным уролитиазом. Средний возраст обследованных составил 48,6±6 лет (женщин – 49,4±2,0 года, мужчин – 46,9±4,0 года). У большинства пациентов камнеобразование было первичным. Больные с известными из анамнеза заболеваниями, объективно увеличивающими риск МКБ, такими как гиперпаратиреоз, дистальный почечно-канальцевый ацидоз, саркоидоз и т.п., не были включены в данное исследование. Во всех случаях изучали анамнез, определяли количественный минералогический состав камня, величину индекса массы тела (ИМТ), суточный диурез и рН-профиль мочи; дополнительно исследовали экскрецию с мочой уратов, ионов кальция, магния, фосфат-, оксалат- и цитрат-ионов. Количественный минералогический анализ камня проводили с помощью дифрактометра Bruker D 8 Advance (медное или молибденовое излучение с длиной волны 0,154 или 0,071 нм соответственно). Анализ дифрактограмм осуществляли с помощью пакета программ Topas 4 c использованием базы данных PDF 2 или Кембриджской структурной базы данных.
Определение концентрации ионов кальция, магния, фосфат-ионов и мочевой кислоты в суточной моче проводили с использованием стандартных наборов Hospitex Diagnostics и Fluitest MG XB с точностью ±7–8%. Оксалаты и цитраты определяли ферментативным методом с использованием аттестованных в Минздраве РФ наборов (ООО «Импакт», Россия) с аналогичной точностью. Измерения рН мочи проводили непосредственно после мочеиспускания с помощью карманных рН-метров рН-009(I) (RoHS) с точностью ±0,1, которые предварительно были откалиброваны по стандартным буферным растворам. Объем суточной мочи определяли волюмометрически с погрешностью ±50–100 мл.
Для анализа статистической значимости выводов исследования при сравнении групп пациентов рассчитывали показатели достоверности различий p с использованием одномерного теста ANOVA в варианте Бонферрони. Все расчеты проводили с помощью пакета программ ORIGIN 7.0.
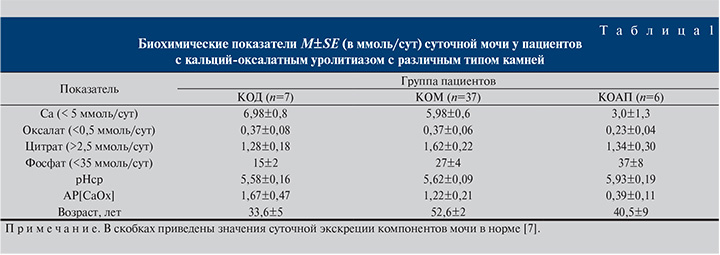
Результаты и обсуждение. Анализ состава конкрементов показал, что наиболее распространенной минералогической фазой камней являлся кальция оксалат моногидрат (КОМ) и лишь в 7 случаях доминировал термодинамически нестабильный дигидрат оксалата кальция (КОД). Монокомпонентные камни (КОМ) диагностированы у 46% пациентов, в остальных случаях конкременты содержали два (КОМ+КОД) или три компонента (КОМ+КОД+гидроксилапатит [ГА] или КОМ+КОД+урат).
С целью установления взаимосвязи между минералогическим составом камней и выявленными нарушениями метаболизма пациенты были разделены на три группы (табл. 1):
- пациенты с камнями из КОМ или его смесей с КОД или ГА (КОМ≥55 мас.%, доля ГА <10 мас.%);
- пациенты с камнями на основе КОД (КОД≥55 мас.%, доля ГА <10 мас.%);
- пациенты с кальций-оксалатными камнями с долей ГА≥10 мас.% (КОАП).
Статистический анализ показал, что пациенты с камнями на основе КОМ существенно старше пациентов с КОД (p=0,001) или КОАП (p=0,04), указывая на то, что в более молодом возрасте вероятность появления камней на основе дигидрата выше. Суточная экскреция кальция у пациентов с КОАП-камнями заметно ниже, чем у пациентов с камнями на основе КОД (p=0,02) или КОМ (p=0,04). Одновременно эти больные обнаружили более высокую экскрецию фосфатов, чем пациенты с КОД (p=0,01), и меньшую величину индекса пересыщения мочи оксалатом кальция AP [CaOx] (p=0,03), рассчитанную по уравнению Тизелиуса [11]. Как видно, наличие 10 и более % ГА в кальций-оксалатных камнях заметно снижает AP[CaOx], что, казалось бы, свидетельствует о снижении риска камнеобразования. Однако рост экскреции фосфата и одновременный сдвиг рН в щелочную область (см. табл. 1) повышают вероятность появления кристаллов апатита в моче, что часто приводит к гетерогенной кристаллизации CaOx даже при относительно низком индексе пересыщения мочи. Очевидно, что таким пациентам необходимо уделять повышенное внимание с целью предотвращения рецидива МКБ.
Из табл. 1 видно, что среднесуточная экскреция оксалата у пациентов обеих групп находилась в пределах нормы, при этом каких-либо статистически значимых различий между ними не наблюдалось. Это хорошо согласуется с данными A. Trinchieri и соавт. [12], полученными для группы пациентов с кальций-оксалатными камнями из Северной Италии [12]. Аналогичный вывод можно сделать и относительно рН мочи. Хотя у пациентов с большой долей апатита в камнях (КОАП) среднее значение рН суточной мочи несколько выше, отличие от групп КОМ и КОД не было статистически значимым (p=0,11). Что касается суточной экскреции кальция и цитрата, то пациенты с камнями на основе КОД имели более высокий уровень кальция и одновременно пониженный уровень цитрата в моче, однако отличие от группы КОМ вследствие большой дисперсии не достигло статистической значимости (p=0,10). По всей видимости, использование более широкой выборки должно позволить выявить статистическую значимость установленных различий. Полученные данные, тем не менее, однозначно свидетельствуют, что для пациентов с камнями из КОД гиперкальциурия и гипоцитратурия являются основными метаболическими нарушениями, существенно повышающими риск камнеобразования [8].
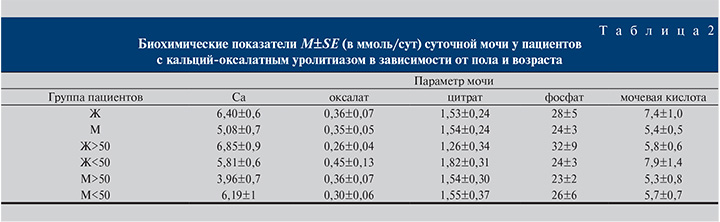
В табл. 2 приведены показатели суточной мочи у пациентов с кальций-оксалатными камнями в зависимости от пола и возраста. Как видно, экскреция цитрата была заметно снижена для всех групп пациентов с МКБ, при этом наименьшее значение концентрации цитрат-ионов в моче отмечено у женщин старше 50 лет. Наоборот, суточная экскреция оксалата находилась в пределах нормы во всех случаях, но опять-таки для женщин старше 50 лет она несколько ниже. Статистический анализ, однако, показал, что наблюдаемые различия в суточной экскреции цитрата и оксалата не достигают уровня статистической значимости (p=0,18). Аналогичная картина имела место и для фосфатов, хотя для женщин в период мено- и постменопаузы имеется тенденция к превышению нормы.
Уровень суточной экскреции уратов с мочой был существенно превышен во всех групп пациентов, в особенности у женщин молодого возраста (см. табл. 2).
В рамках ограниченной выборки различия между группами оказались статистически незначимыми. Тем не менее повышенная экскреция уратов, сниженный уровень цитратов в моче при достаточно низких среднесуточных значениях рН у большого числа пациентов (см. табл. 1, 2) указывают на то, что причина гиперурикозурии преимущественно диетическая, обусловленная недостаточно сбалансированным питанием с избыточным потреблением животного протеина.
Среднесуточная экскреция кальция превышена во всех групп пациентов, за исключением мужчин пожилого возраста (см. табл. 2). Наиболее значительное различие имело место между группами женщин и мужчин старше 50 лет, при этом, несмотря на достаточно большую величину дисперсии, оно приближалось к статистически значимому (p=0,06).
В совокупности со сниженной экскрецией цитрата [9] это указывает на необходимость особого внимания к данной эстрогензависимой группе пациенток.
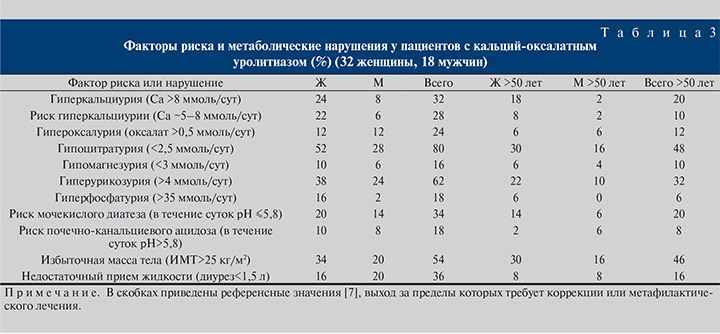
Согласно данным табл. 3, наиболее часто диагностируемым нарушением в анализируемой выборке являлась гипоцитратурия, отмеченная у 80% пациентов. Это значение несколько выше величины, обычно указываемой для стран Евросоюза [9, 12], но очень близко к данным, полученным для большого числа пациентов с МКБ из Южного Китая [13]. Использование более низкого референсного значения суточной экскреции цитрата (1,67 ммоль/сут) [14] снижает частоту гипоцитратурии до 64%, что находится в согласии с данными [9]. Очевидно, что недостаток цитрат-ионов – ингибиторов нуклеации и агрегации кристаллов оксалата кальция служит очень важным фактором риска образования кальций-оксалатных камней в Ивановском регионе.
Не менее важным метаболическим нарушением является гиперкальциурия: у 32% обследованных нами пациентов суточная экскреция промоутеров камнеобразования – ионов кальция превышала 8 ммоль и еще 28% находились в группе риска с уровнем секреции более 5 ммоль/сут. В отличие от пациентов стран Евросоюза [2, 4, 12] гипероксалурия была выявлена лишь у 24% больных, в то время как гиперурикозурия имела место более чем у 60% пациентов. Необходимо отметить, что суточная экскреция уратов у многих пациентов превышала норму в 2–3 раза. Высокий уровень уратов в моче в совокупности со сдвигом суточного рН-профиля в кислую область (более 30% пациентов) создает условия для образования кристаллов мочевой кислоты, что промотирует рост камней на основе КОМ на уратной матрице. Как показало анкетирование, основной причиной избыточной экскреции мочевой кислоты являются перегрузка принимаемой пищи пуринами и низкий уровень физической активности. Гипомагнезурия и гиперфосфатурия встречались значительно реже и затрагивали 16 и 18% больных с кальций-оксалатными камнями соответственно.
Среди факторов риска наиболее часто встречавшимися были избыточная масса тела, диагностированная более чем у 50% пациентов (см. табл. 3), а также недостаточный суточный диурез (36%), в ряде случаев не превышавший 1 л. Интересные результаты обнаружились при разделении пациентов по гендерному признаку. Как видно, гиперкальциурия обнаруживалась значительно чаще у женщин, чем у мужчин, при этом в период мено- и постменопаузы это различие проявляется значительно сильнее. Гипоцитратурия, гиперурикозурия, риск мочекислого диатеза, избыточная масса тела, и особенно гиперфосфатурия, также чаще встречались у женщин, чем у мужчин, независимо от возраста. Наоборот, частота выявления гипероксалурии и недостаточная величина суточного диуреза одинакова как для мужчин, так и для женщин в возрасте старше 50 лет. Важно отметить, что в результате проведенных исследований нами был обнаружен лишь единственный случай идиопатического образования камней. Подавляющее большинство пациентов имели два и более факторов риска МКБ. В связи с этим соблюдение требований базовой метафилактики [7, 8], заключающихся главным образом в изменении диетических предпочтений, нормализации массы тела и поддержании достаточного диуреза, следует признать обязательным даже в случае первичного камнеобразования.
Заключение. Результаты проведенных нами исследований по анализу взаимосвязи наиболее вероятных метаболических нарушений и факторов риска с минералогическим составом кальций-оксалатных конкрементов показали следующее:
- пациенты с кальций-оксалатными камнями на основе КОД значительно моложе, имеют несколько более высокий уровень кальция в суточной моче и сниженный уровень цитратов, чем пациенты с камнями из КОМ. Средняя суточная экскреция оксалатов для обеих групп не различается и находится в пределах нормы;
- пациенты с кальций-оксалатными камнями, содержащими 10 и более мас.% апатита, имеют статистически значимо более высокий уровень фосфатов в моче, сниженную суточную экскрецию кальция и оксалата, а также обнаруживают сдвиг рН мочи в щелочную область. Очевидно, что при обнаружении в кальций-оксалатных камнях значительных количеств апатитов пациентам следует проводить специальную диагностику по составу камня [8] для определения суточной экскреции фосфата с мочой и исследования ее суточного рН-профиля. Аналогичный вывод следует сделать при обнаружении в камне большого количества уратов;
- женщины в период мено- и постменопаузы находятся в группе повышенного риска вследствие эстрогензависимой экскреции цитрата и кальция [9].
В связи с этим независимо от частоты рецидивов МКБ определение суточной экскреции кальция и цитратов с мочой для данной группы следует признать обязательным и внести в стандарт обследования; - знание минералогического состава конкремента является краеугольным камнем любых диагностических и метафилактических мероприятий при МКБ. Количественный минералогический анализ состава депозитов для всех без исключения пациентов методами РФА или ИК-спектроскопии следует признать обязательным и также внести в стандарт обследования пациентов с МКБ.
Работа поддержана РФФИ (проект 15-44-03016- рег.)



