Болезни мочеполовой системы в структуре общей заболеваемости населения РФ по всем классам составляют 7,2%. При этом отмечается стойкое увеличение числа зарегистрированных пациентов, которое, по данным официальной статистики, в настоящее время достигает 17 047 406 человек [1]. Особую актуальность данной проблеме придает повышение влияния ряда неблагоприятных факторов окружающей среды и особенности современной жизни на течение заболеваний мочеполовой системы.
Следствием увеличения заболеваемости является неуклонный рост числа выполняемых операций на органах мочевой системы. Так, например, только в 2014 г. пациентам с впервые установленным урологическим диагнозом выполнено 475 376 оперативных вмешательств. Большую часть (55,5%) этих пособий составляют операции на почках и мочеточниках. Расширение диапазона и объема подобных операций за последние десятилетия способствовало значительному увеличению частоты осложнений. На данные операции среди всех урологических вмешательств приходится основная доля осложнений – 62,3% [1]. Приведенные статистические данные, несомненно, поддерживают интерес клиницистов, ориентированных на совершенствование оказания хирургической помощи пациентам с заболеваниями почек.
Ошибки, опасности и осложнения, возникающие при операциях на почках, являются наиболее сложной проблемой клинической урологии. Особая важность данной проблемы обусловлена тем, что именно эти осложнения дают неудовлетворительные результаты оперативного лечения и влияют на дальнейшее течение заболеваний.
К основным заболеваниям, требующим хирургического вмешательства на верхних мочевых путях, относятся мочекаменная болезнь и новообразования почки.
Опухоли почки представляют собой многочисленную группу новообразований различной морфологической структуры и составляют около 3% в структуре всех онкологических заболеваний. Радикальная нефрэктомия – наиболее распространенный метод лечения, однако в настоящее время все более широкое применение находят органосохраняющие операции. Техническое осуществление такого вмешательства должно быть максимально продумано и запланировано на основании тщательно проведенного предоперационного обследования. Особого внимания требуют пациенты с полностью внутрипочечным расположением опухоли, что делает данный вид пособия наиболее трудным в техническом исполнении.
Другим не менее сложным хирургическим заболеванием почки является мочекаменная болезнь, точнее – коралловидный нефролитиаз, наиболее тяжелая форма ее проявления. Встречаемость его достигает 7% среди всех урологических больных и до 35% среди всех форм мочекаменной болезни. Основополагающими факторами в принятии решения о выборе тактики лечения служит информация не только о форме коралловидного камня или индивидуальной стереоанатомии чашечно-лоханочной системы (ЧЛС), но и об их пространственных взаимоотношениях.
Несмотря на прогресс в изучении заболеваний почек, вопрос диагностики, выбора обоснованной тактики и способа лечения остается одним из наиболее обсуждаемых и противоречивых. А профилактика осложнений и применение совершенных методов их ранней диагностики и лечения – важнейшая проблема современной урологии.
Многие ошибки и осложнения, наблюдающиеся при операциях на почках, могут быть предупреждены. Недостаточный или неадекватный операционный доступ, отсутствие у хирурга опыта выполнения операций, незнание основных вариантов и возможных аномалий важных анатомических почечных структур, невнимательность и технические ошибки – все это может служить причиной развития осложнений различной степени тяжести. Поэтому понимание непредвиденных, в том числе и интраоперационных, осложнений в хирургии почки, а также способов их устранения необходимо для всех урологов.
В большинстве своем эти ошибки общеизвестны. Такое осложнение, как кровотечение, присуще практически всем операциям на почках, и связано оно в первую очередь с отсутствием детального знания ангиоархитектоники почки. Положительный хирургический край обусловлен недооцененной распространенностью патологического процесса и/или его взаимоотношения с внутрипочечными структурами. Резидуальные камни чаще всего являются следствием неправильно выбранных пункционных доступов или их количеств, что объясняется отсутствием детального понимания индивидуального строения почки в совокупности с течением патологического процесса. По той же причине могут возникать трудности с определением локализации полностью внутрипочечно расположенной опухоли. Пожалуй, вряд ли есть другие операции, сопряженные с таким риском и множеством неожиданностей, как операции на почках. Техническая ошибка и невнимательность хирурга могут принести больному столько вреда, что устранить его не удастся до конца его жизни. Однако большинство осложнений и ошибок можно предотвращать, если тщательно соблюдать ряд технических и тактических правил.
Во-первых, самое главное условие – четкое понимание анатомии этой сложной области, наиболее частых вариантов внутреннего строения почки и ее ангиоархитектоники. Избежать ошибок позволяют современные методы дооперационной диагностики и правильно выбранная тактика лечения.
Во-вторых, в ходе операций на почках важно детальное представление о патологическом процессе, позволяющем установить характер поражения почек и мочевых путей и предпринять необходимое оперативное вмешательство.
В-третьих, при выполнении операций на почках необходимо знать и строго выполнять ряд технических приемов, что позволит в каждом конкретном случае с успехом выйти из трудной ситуации и избежать тяжелых осложнений.
Залогом успешного результата оперативного лечения при любых заболеваниях почек является верная формулировка урологического диагноза. Именно точный диагноз с указанием стадии, распространенности патологического процесса и его особенностей позволяет выбрать оптимальный вид и объем хирургического вмешательства. Здесь не может быть мелочей, каждая особенность течения заболевания должна быть учтена.
В хирургии XXI в. практически все вопросы диагностики должны быть решены до начала операции, а во время вмешательства лишь подтверждаются заранее известные факты. Таким образом, уролог еще до операции располагает всей информацией о возможных трудностях предстоящего вмешательства, четко представляет себе вид и детали планируемого пособия. Только взвесив все выявленные особенности течения патологического процесса в сочетании с пониманием внутреннего строения почки, можно правильно выбрать способ хирургического лечения.
История развития диагностики, как и всей медицины в целом, начала свое исчисление лишь немногим позже появления на земле человека, и в связи с этим не будет преувеличением сказать, что главным событием прошедшего века было создание и развитие основных методов визуализации внутренних органов.
Различные методы медицинской визуализации, основанные на качественно разных физических принципах, развивались в большинстве случаев независимо друг от друга. Наметившаяся лишь в последнее время тенденция к комплексному использованию этих методов обусловила интерес к их сравнительному анализу и выявлению общих проблем медицинской визуализации в целом.
Создание изображения внутреннего анатомического строения и функций человеческого тела является фундаментальным для медицинской науки.
Несмотря на прогресс методов визуализации, процесс интерпретации результатов исследования и оценки течения патологического процесса существенных изменений не претерпел, по-прежнему необходимы хорошие знания лучевой анатомии.
В настоящее время найдено множество публикаций, посвященных использованию методики 3D-печати для разных медицинских специальностей (травматологии и ортопедии, челюстно-лицевой хирургии). Так, D. Rohner и соавт. [2] успешно использовали 3D-печать для планирования и навигации в сложном случае реконструкции лица. Zein и соавт. [3] использовали пластичный материал из серии TangoPlus для предоперационной подготовки живой донорской трансплантации печени. Модель донорской печени от близкого родственника включала паренхиму, воротную вену, внутрипеченочное желчное дерево. Отклонения в размерах составляли менее 4 мм, а отклонения трубчатых структур – менее 1,4 мм. Авторы утверждают, что данная методика повышает успех оперативного пособия, тем самым улучшает совместимость живой донорской трансплантации печени.
С развитием визуализирующих технологий и их усовершенствованием для врачей различных специальностей стало возможным иметь в своем арсенале 3D-визуализирующие технологии. Идея создания осязаемой анатомической модели органа на основании данных КТ принадлежит итальянскому доктору Alberti (1979) [4].
Первая анатомическая модель костей таза по результатам КТ была выполнена пациентам с фибросаркомой костей таза и изготовлена из полистирола при помощи фрезерных станков с числовым программным управлением. На основании сделанной модели изготовлен металлический имплантат [5]. Первые модели были несовершенны, имели грубую ребристую структуру ввиду отсутствия точного копирования анатомического объекта за счет слабой разрешающей способности ранее используемых томографов и несовершенства самой методики изготовления [6]. В последующем для создания 3D-объектов не для медицинских целей была предложена методика лазерной стереолитографии [7]. Автор данной методики впервые в мире предложил термин «3D-печать». По его определению, 3D-печать – это способ, при котором 3D-модель создается путем наслоения с использованием систем автоматизированного проектирования и программного обеспечения, которые передают сигналы на 3D-принтер.
Для медицинских целей методика лазерной стереолитографии впервые в мире была применена в 1994 г. [8]. В настоящее время предложено множество различных методик 3D-печати, которые используются в различных сферах жизнедеятельности человека – от создания домов до печати живых органов и тканей. При этом материалы, используемые в 3D-печати, также различны – от бумаги и пластмасс до керамических и металлических порошков и живых клеток. Эволюция технологий привела к тому, что в данный момент появилась возможность печатать несколькими материалами одновременно, что позволяет создавать сложные функциональные компоненты, например встроенные электронные датчики [9].
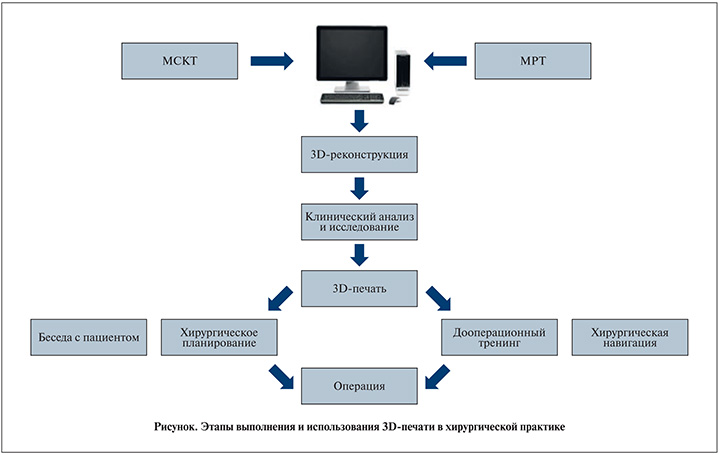
Процесс любой 3D-печати состоит из нескольких этапов (см. рисунок). На первом этапе выполняется исследование при помощи различных визуализирующих методов с контрастным усилением (МСКТ, МРТ). Затем используются различные системы программного обеспечения, которые позволяют загружать разные данные в формате DICOM/PACS, в результате чего получаются 3D-изображения. Получаемые 3D-изображения интересуемой области обрабатываются применительно к различным методикам 3D-печати, после чего при помощи различных видов 3D-принтеров формируются печатные 3D-модели [10].
В зависимости от вида 3D-принтеров существует несколько разновидностей 3D-печати: стеролитография – методика с применением фотополимеров, которые укладываются послойно на подвижной платформе и формируют модель под воздействием ультрафиолетового лазера (Stereolithography (SLA); селективное лазерное «спекание», при котором в процессе изготовления используются различные порошки (металл, керамика, полимеры), которые выдуваются из сопла и при помощи СО2-лазера спекаются послойно (Selective Laser Sintering (SLS); плавленое осажденное моделирование (Fused Deposition Modeling (FDM), где применяются мелкие шарики, которые под высоким давлением выдавливаются и наплавляются с формированием модели; ламинированное производство (Laminated Object Manufacturing (LOM), в процессе которого используется бумага или полиэтилен, которые складываются и формируют модель; струйная печать (Inkjet printing techniques) – технология, которая нашла свое применение в 3D-биопринтинге живых тканей и органов [11].
Спектр применения 3D-печати очень широк, но в целом ограничивается тремя основными направлениями: 1) печать анатомических моделей органов, 2) производство протезов и имплантатов, 3) производство хирургического инструментария.
Применительно к урологии печать анатомических моделей почки и предстательной железы используют для двух основных целей: для планирования оперативного вмешательства и для образования [12, 13].
Первое сообщение в мировой печати о применении 3D-моделей почки для планирования резекций почки при опухоли принадлежит J. Silberstein. Авторы сообщили об использовании данных моделей почки в отношении пяти больных раком почки, четверым из которых была выполнена роботическая резекция почки, одному вмешательство проведено открытым доступом. В заключение авторы отметили, что применение 3D-напечатанных моделей почки значительно улучшает результаты проводимых оперативных вмешательств за счет точного понимания врачом-хирургом нормальной и патологической анатомии оперируемого органа [14].
При планировании операции изучение анатомии органа с помощью 3D-модели с возможностью осязания рукой имеет большое преимущество перед простым просмотром 3D-моделей на мониторе компьютера, а тем более просмотром данных МСКТ или МРТ с контрастированием.
Доказательством служит ряд исследований. Так, в работе [15] врачам-хирургам было предложено провести предоперационное планирование, руководствуясь 3D-изображением на мониторе или 3D-печатной моделью. Хирурги отметили, что предоперационное планирование на основании 3D-печатных моделей имело больше преимуществ, чем использование лишь 3D-визуализации.
Другой пример успешного использования 3D-печати опухоли с почкой был представлен в 2015 г. Y. Komai и соавт. [16]. Авторы показали, что использование 3D-модели для предоперационной подготовки сокращает время использования ультразвукового контроля в ходе операции в 2 раза по сравнению с контрольной группой без использования 3D-модели. В заключение исследователи утверждают, что применение 3D-печатных моделей почки с опухолью для предоперационного планирования называют методикой 4Д-интраоперационной навигации.
В настоящее время используемые для лечения больных высокотехнологичные оперативные вмешательства требуют от врача-оператора глубоких знаний. И применение на этапе предоперационного планирования тренинга предстоящей операции очень эффективно [17].
M. Maddox и соавт. [18] считают, что это особенно полезно при выполнении так называемых сложных резекций. Предоперационный тренинг перед выполнением робот-ассистированных резекций почки при опухоли с возможностью наложения швов на рану почки был проведен шести больным. Показано, что в этой группе по сравнению с сопоставимой группой пациентов без предварительного тренинга время операции и величина кровопотери были значительно меньше.
Самым главным преимуществом 3D-печатных моделей почки авторы считают возможность четкого предоперационного планирования операции с выбором оптимального варианта выполняемой резекции и оценкой остающейся части почечной паренхимы. Кроме того, напечатанные модели позволяют хирургу четко понять реальные размеры опухоли, глубину инвазии, а также определиться с линией разреза и углом разреза паренхимы почки, что особенно важно при выполнении лапароскопических пособий и служит простым способом интраоперационной навигации.
3D-модели почки интересны не только опытным хирургам, но и студентам. С их помощью можно более точно определять шкалы морфометрической оценки сложности предстоящей резекции почки и иметь четкие представления о патологической анатомии опухолевого процесса в почке [19].
Применение 3D-печатных моделей почки в процессе предоперационной беседы врача-хирурга с пациентом очень сильно помогает в понимании больным своего заболевания и всех сложностей предстоящей операции, что помогает установить доверительные отношения между врачом и пациентом [20, 21].
Методика 3D-печати применяется и при лечении мочекаменной болезни почки, особенно это значимо в лечении коралловидной формы заболевания.
В недавней публикации [22] были представлены 3D-модели ЧЛС для проведения тренинга чрескожных вмешательств. Автор отмечает, что опыт проведения чрескожных пособий необходимо нарабатывать не в операционной, а на недорогих моделях в симуляционных центрах. На начальном этапе осуществляли построение трехмерных моделей элементов ЧЛС. Затем выполняли 3D-печать водорастворимых пластиковых моделей ЧЛС, размещали полученные модели в силиконовой основе, растворяли их при помощи специальных химических веществ, в результате чего в силиконовой конструкции оставалась точная полая модель ЧЛС. Полученную таким образом точную модель ЧЛС в силиконовом основании заполняли рентгенконтрастным веществом и герметизировали. В дальнейшем при тренинге чрескожного доступа под рентгенологическим контролем для воссоздания эффекта наличия мягких тканей между почкой и поверхностью кожи вокруг силиконовой модели размещали слой из плотного губчатого вещества. В результате была продемонстрирована практическая пригодность данной модели, позволяющей отрабатывать чрескожный доступ при разнообразных анатомических вариантах строения ЧЛС, посредством чего достигается снижение частоты повторных вмешательств и количества интра- и послеоперационных осложнений.
3D-печатные модели в урологии используются не только для лечения хирургических заболеваний почки, но и для улучшения качества диагностики и лечения заболеваний предстательной железы. Опубликована работа о применении 3D-печати предстательной железы с целью улучшения морфологической диагностики рака предстательной железы после операции, точного определения патологических участков в предстательной железе, выявленных в предоперационном периоде по данным МРТ с контрастированием [23].
В работе Т. Shin и соавт. [24] для пяти пациентов с локализованным раком предстательной железы были напечатаны 3D-модели предстательных желез c сосудисто-нервными пучками и с указанием зон, подозрительных на инвазию капсулы, по данным выполненного МРТ с контрастированием. По результатам послеоперационного морфологического исследования у всех пяти пациентов констатировали отрицательный хирургический край.
В заключение было отмечено неоспоримое преимущество применения 3D-печатных моделей предстательной железы перед выполнением робот-ассистированных нервосберегающих простатэктомий [24].
Производство хирургических инструментов в медицинских учреждениях может снизить затраты на 25–30% за счет снижения стоимости производства, упаковки, транспортировки [25]. Несколько учреждений успешно распечатали и протестировали базовые хирургические инструменты: щипцы, ретракторы, зажимы, иглодержатели. Показано, что высокая температура при печати позволяет производить стерильные объекты непосредственно из принтера [26, 27].
Совершенно фантастически выглядит другое применение 3D-печати в урологии. Экспериментальное исследование [28] проведено для решения вопроса о целесообразности создания персонифицированных инструментов и расходных материалов при помощи 3D-печати. Напечатанные лапароскопичекие троакары и мочеточниковые катетеры-стенты были использованы в эксперименте на трупах человека и живых свиньях. В заключение отмечено, что это – опция будущего развития медицинских технологий и данная методика даст возможность изготавливать и применять разовый расходный инструментарий перед операцией и интраоперационно – при возникновении потребности в нем. В том же году было опубликовано исследование, в ходе которого успешно разработан и изготовлен антирефлюксный стент с использованием технологии 3D-печати [29]. Авторы утверждают, что созданный ими стент эффективно предотвращает везикоуретральный рефлюкс, при этом минимизируя снижение пассажа антеградного тока мочи.
Несмотря на все положительные стороны применения использования 3D-печати в урологии, нельзя не отметить и отрицательные моменты. На современном этапе развития научно-технического прогресса они преимущественно связаны со стоимостью изготовления 3D-печатных моделей, которая состоит из суммы затрат на материалы для печати и собственно стоимости 3D-принтера. Кроме того, немаловажный фактор – время, необходимое для изготовления 3D-печатных моделей. В большинстве случаев оно равно 12 ч и более [30].
Несмотря на это, D. Hoang и соавт. [31] приводят следующие данные: время, потраченное на 3D-печать, различно, но сэкономленные 10 мин операционного времени равнозначны 1 ч, потраченному на 3D-печать модели. При этом точно оценить, насколько уменьшается время анестезии, величина кровопотери и улучается ли результат операции, невозможно [31]. Ввиду этого все проведенные исследования по данной тематике в количественном составе невелики, поэтому невозможно статистически достоверно доказать эффективность и преимущество использования данной технологии.
В заключение хотелось бы отметить, что все приведенные выше современные виртуальные технологии целесообразны и должны быть в арсенале работы врача-уролога третьего тысячелетия.



