Теории камнеобразования и бляшки Рэндалла. Моче-каменная болезнь (МКБ) – это заболевание, основным проявлением которого является образование камней в мочевыводящих путях. По распространенности среди заболеваний мочеполовой системы уролитиаз занимает второе место после воспалительных неспецифических заболеваний почек и мочевых путей [1]. Многие авторы связывают высокую частоту заболевания с местными условиями (климатические, качество питьевой воды) и обращают внимание на географический фактор риска возникновения уролитиаза. Однако в последнее время настораживает увеличение заболеваемости МКБ не только в эндемических зонах, но и в районах, бывших благоприятными в этом отношении [2].
В литературе значительное внимание уделяется патогенезу МКБ. К настоящему времени сформулирована масса теорий развития МКБ, каждая из которых вносит свой вклад в объяснение образования камней. Наибольшее распространение получили две концепции [1].
1. Теория перенасыщения мочи камнеобразующими ионами. В основе патогенеза образования камней в мочеполовой системе лежит гиперсатурация мочи камнеобразующими компонентами, включая кальций, оксалаты, соли мочевой кислоты (ураты). Считается, что с помощью этого механизма можно объяснить образование камней, состоящих из солей кальция.
2. Коллоидно-кристаллоидная теория, которая больше подходит для объяснения формирования оксалатных камней и заключается в том, что при определенных условиях происходит отложение «цементирующего» материала на кальций-фосфатных ядрах. Соли фосфорной кислоты откладываются на базальной мембране тонкой петли Генле, попадают в интерстициальную ткань, а затем накапливаются в субэпителиальных пространствах почечных сосочков. Субэпителиальные отложения солей кальция в конечном итоге разрушают эпителий почечных сосочков. Однако в конечном итоге ни одна из этих теорий не позволяет объяснить глубинные патогенетические механизмы камнеобразования, в частности кальцийоксалатного [1, 2].
Открытие бляшек Рэндалла в прошлом столетии перевернуло представление о патогенезе МКБ. Бляшки Рэндалла – это минеральные (кальциевые) отложения в области почечных сосочков чашечно-лоханочной системы (ЧЛС). За последние два десятилетия было проведено немало исследований, направленных на выявление причин формирования бляшек. Как результат – к настоящему времени накоплено немало сведений об их структуре [3–13]. Несмотря на то что бляшки Рэндалла впервые были описаны в 1940-х гг. [4], первые исследовательские работы появились только недавно одновременно с распространением эндоурологических методик, позволяющих их визуализировать.
Встречаемость бляшек Рэндалла. Заболеваемость МКБ в последнее время прогрессивно увеличивается в индустриальных странах, особенно это касается камней, состоящих из оксалата кальция (около 70% всех конкрементов) [1], но распространенность бляшек Рэндалла в общей популяции к настоящему времени не известна. Emmanuel Letavernier с коллективом ученых в 2015 г. закончил одно из самых больших исследований, посвященное бляшкам Рэндалла [14]. В данной работе [14] была предпринята попытка выявить факторы, ассоциированные с формированием бляшек Рэндалла в общей популяции. Также исследователи проводили анализ 30 149 конкрементов для определения состава [14]. Показано, что 34,1% пациентов с МКБ имели бляшки Рэндалла, которые выявляли в ходе эндоурологических манипуляций. У 105 пациентов был исследован биохимический и гормональный профиль, а также проведен генетический анализ на предмет полиморфизма гена витамина D (Fokl I ген) [14]. По результатам регриссионного анализа показано, что вероятность камнеобразования у больных МКБ с бляшками Рэндалла выше по сравнению с пациентами с МКБ, но без бляшек. Особенно это касается больных, у которых зафиксировано повышение концентрации остеокальцина в моче (OR=0,97, СI – 0,934–0,997, p=0,03), а также обнаружен полиморфизм гена витамина D (p=0,047). В частности, у больных рецидивирующим уролитиазом отмечено повышение экспрессии аллеля Folk I гена рецептора витамина D, что приводит к более продолжительному возбуждению рецепторов. В заключение автор отмечает, что полиморфизм гена витамина D неизвестным образом связан с образованием бляшек Рэндалла, что в свою очередь влияет на процесс камнеобразования, но при этом полиморфизм гена витамина D не может объяснить повышение концентрации остеокальцина [14]. Важным аспектом данной работы стало эпидимеологическое исследование, показавшее, что бляшки Рэндалла формируются у пациентов задолго до образования камней, в частности еще в подростковом возрасте, что указывает на наследственные механизмы формирования бляшек [12, 14].
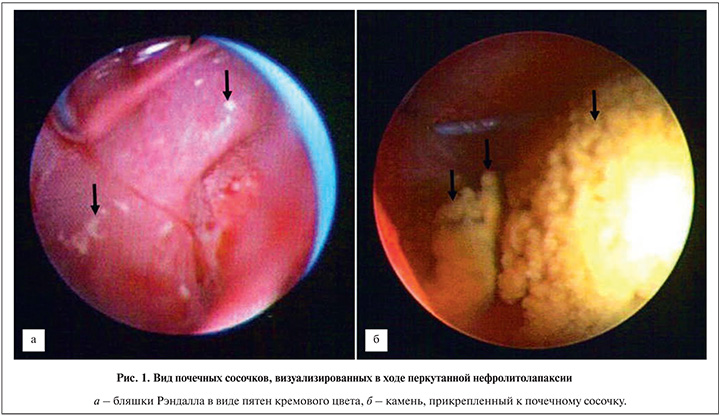
Морфологические характеристики бляшек Рэндалла. Заслуживающее внимания исследование проведено в США в 2012 г. Группа исследователей попыталась взять холодную биопсию лоханки у больных рецидивирующим нефролитиазом во время перкутанной нефролитолапаксии из тех мест, где начинали формироваться бляшки Рэндалла [12]. Авторы предположили, что формирование этих структур происходит аналогично кальцификации сосудов или клапанов сердца, что служит признаком старения. У 15 больных идиопатическим нефролитиазом были взяты кусочки переходно-клеточного эпителия, зафиксированы и исследованы с помощью различных методик световой и электронной микроскопии.
В исследовании показано, что для всех бляшек характерны субэпителиальные депозиты фосфата и оксалата кальция. Сам процесс образования точек нуклеации происходит путем минерализации коллагена в субэпителиальных тканях почечного клубочка вокруг петли Генле, vasa recta, собирательных трубочек. В ходе гистологического исследования не было получено никаких доказательств интерстициального фиброза, внутриканальцевого депонирования солей кальция или признаков хронического воспаления [12]. В субэпителиальных депозитах фосфата кальция была повышена концентрация белка остеопонтина, формировавшего органический матрикс.
Сегодня известны состояния, при которых повышается вероятность рецидивного уролитиаза. К этим состояниям относятся гиперкальциурия, гипероксалурия, гипоцитратурия и др., но образование кальцийоксалатных камней у больных нормокальциурией, нормокальциемией до сих пор патогенетически не обосновано [15]. В настоящее время интерес к бляшкам Рэндалла растет со стороны урологов ввиду распространенности перкутанной нефролитолапаксии, контактной уретеронефролитотрипсии, что позволяет напрямую визуализировать эти образования (рис. 1). Предполагается, что бляшки Рэндалла – это «фундамент» для образования конкремента, т.е. точка нуклеации, или кристаллизации, вокруг которой формируются новые кристаллы, что приводит к образованию камня, который в конечном итоге отсоединяется от стенки и попадает в ЧЛС [8]. Такие молекулы, как бикунин, остеопонтин, калликреин, которые являются ингибиторами камнеобразования, формируют органический матрикс камня и служат «склеивающей» субстанцией [6, 15].
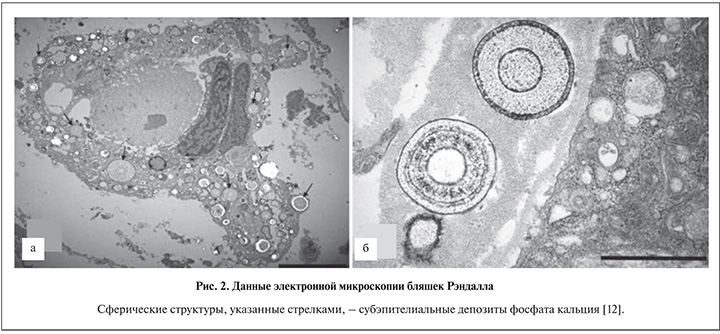
Связь бляшек Рэндалла и полиморфизма гена витамина D. Поскольку депозиты состоят из солей кальция, нельзя исключить, что на образование бляшек Рэндалла влияет экспрессия рецепторов витамина D или концентрация самого витамина D, так как последний ингибирует реабсорбцию фосфатов из почечных канальцев, что гипотетически усиливает их субэпителиальное депонирование [4]. Субэпителиальные депозиты фосфата кальция могут быть визуализированы с помощью электронной микроскопии (рис. 2). Некоторые авторы также показали, что образование бляшек Рэндалла – это процесс, сходный с образованием кальцификатов в сосудах [16]. Авторы также подчеркивают, что необходимо проведение массы подобных исследований в различных регионах мира с целью подтверждения данного механизма камнеобразования [12].
Патогенез формирования бляшек Рэндалла. Традиционно считается, что гиперсатурация мочи служит необходимым условием кристаллизации с последующим формированием камней. К настоящему времени широко известна гипотеза посткристаллизационного механизма камнеобразования, заключающаяся в образовании ковалентных связей между клетками канальцев и кристаллами [7]. В тубулярном эпителии, который подвергается экспозиции гиперсатурированной мочи, постепенно развиваются такие процессы, как окислительный стресс, хроническое воспаление, фиброз, апоптоз, фагоцитоз, что в итоге приводит к агрегации кристаллов в эпителии канальцев [4, 7, 12, 17, 18]. Подобный процесс чем-то напоминает механизм формирования атерослклеротических бляшек, в ходе которого клетки гладких мышц сосудов накапливают ЛПНП [5].
На первом этапе происходит изменение свойств переходно-клеточного эпителия, при этом клетки начинают вырабатывать ингибиторы камнеобразования в меньшем количестве, чем необходимо [4]. Уменьшение концентрации ингибиторов приводит к оксидативному стрессу и метаплазии эпителия в сторону остеобластоподобных клеток, а также к депонированию солей кальция на поверхности базальной мембраны. Трансформация переходно-клеточного эпителия сводится к усилению экспрессии остеобластоспецифических генов и уменьшению экспрессии маркеров эпителиальных клеток. Происходит активация сигнальных путей RUNX2/MSX-2 и osterix путем апрегуляции транскрипционных факторов [19]. В дальнейшем экспрессируются маркеры костной ткани, такие как костный морфогенный протеин, сиалопротеин, щелочная фосфатаза. Изначально в проекции базальной мембраны происходит отложение солей кальция в виде небольших частиц диаметром от 1 до 10 мкм [10]. Однако депонирование в дальнейшем распространяется в более глубокие слои паренхимы (к собирательным трубочкам и vasa recta) за пределы базальной мембраны, что приводит к разрыву десмосом между клетками тубулярного эпителия [20]. Депозиты начинают аггрегировать, образуя конгломераты солей большего размера, при этом процесс кристаллизации выходит за пределы поверхности эпителия, что способствует формированию точек кристаллизации уже непосредственно в ЧЛС [21]. Соли кальция обусловливают фиброз интерстициальной ткани и хроническое воспаление, что приводит к усилению экспрессии коллагена и остеопонтина, которые выполняют роль каркаса в структуре кристаллов [22]. Целостность переходно-клеточного эпителия нарушается за счет увеличения продукции матричных металлопротеиназ, которые расщепляют гемидесмосомы, следствием чего является потеря интегративности эпителия [13]. По завершении этого процесса бляшка начинает вдаваться в полость ЧЛС и абсорбирует на себя соли кальция, а также макромолекулы [16]. Органический матрикс, состоящий из массы разных белков, которые могут выступать в качестве маркеров камнеобразования, служит триггером роста кристаллов [10].
Процесс образования камней до недавнего времени всегда рассматривался как пассивный физико-химический процесс, в основе которого лежала гиперсатурация мочи.
С появлением такого понятия, как бляшки Рэндалла, подход к патогенезу камнеобразования изменился. Эпителиальные клетки в проекции бляшек Рэндалла по неизвестным причинам превращаются в остеобластподобные клетки, которые генерируют кальциевые соли в пределах переходно-клеточного эпителия [23–25]. Депонированию солей также способствуют факторы воспаления, такие как ИЛ-8.
M. Daudon и соавт. [8], выполняя радиографию бляшек, выделенных из почек трупов, показали, что депонирование солей происходит не только в пределах переходно-клеточного эпителия. Он также обнаружил более глубокие, вплоть до сосочков, отложения оксалата кальция и пирофосфата, при этом процесс кальцификации особенно интенсивно происходил около собирательных трубочек и vasa recta [8]. Все пациенты, у которых были посмертно исследованы почки, были хроническими камневыделителями.
Заключение. Наличие кальциевых депозитов, прогрессивно увеличивающихся в размерах, на поверхности переходно-клеточного эпителия в ЧЛС объясняет рецидивирующее камнеобразование. На сегодняшний день известны генетические механизмы гиперкальциурии, гипероксалатурии, однако пока нет объяснений тому, за счет чего происходит отложение кальция в переходно-клеточном эпителии. Такие молекулы, как остеопонтин, бикунин, калликреин, которые формируют органическую часть бляшек Рэндалла и конкрементов, могут быть использованы в качестве маркеров повышенной активности камнеобразования, что позволит заниматься активным мониторингом и профилактикой.



